4.4.3《氨》PPT课件(新人教版-必修1)
文档属性
| 名称 | 4.4.3《氨》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 136.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 23:03:24 | ||
图片预览






文档简介
(共39张PPT)
新课标人教版课件系列
《高中化学》
必修1
4.4.3《氨》
第四节《硫酸、硝酸和氨 》
第三课时
第四章 非金属及其化合物
教学目标
1.知识与技能
①使学生了解氨的物理性质和用途,掌握氨的化学性质及其实验室制法;
②了解铵盐的性质。
3.情感态度与价值观
通过演示实验,培养学生观察和分析问题的能力。学生通过自己动手实验,激发学习化学的兴趣和热情,培养学生透过现象看本质的辨证唯物主义观点和实事求是的科学态度,体验科学探究的艰辛和喜悦,增强学生对化学知识在社会生产中的重要作用的认识。
教学的重点和难点
氨和铵盐的化学性质、实验室制法。
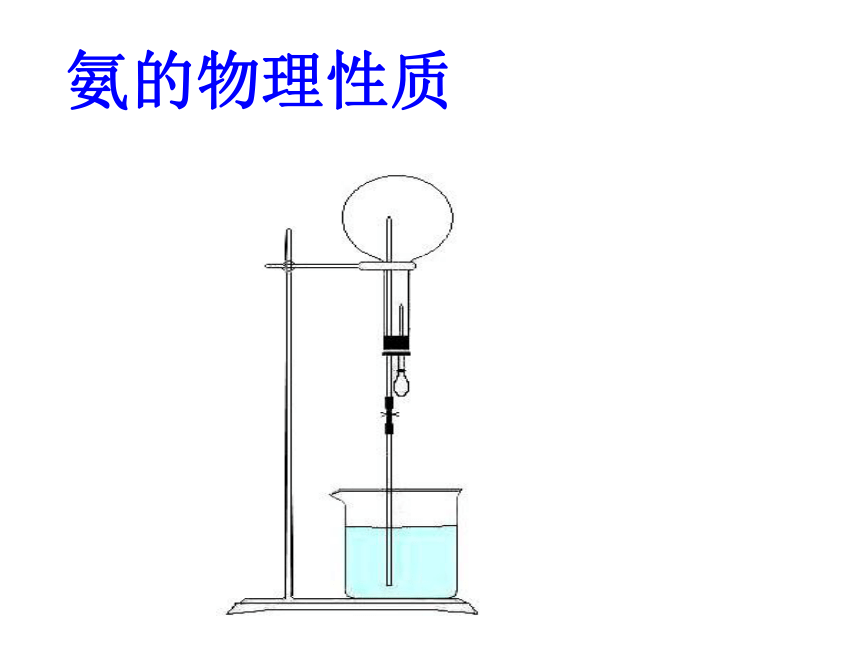
氨的物理性质
(1) 氨与水的反应
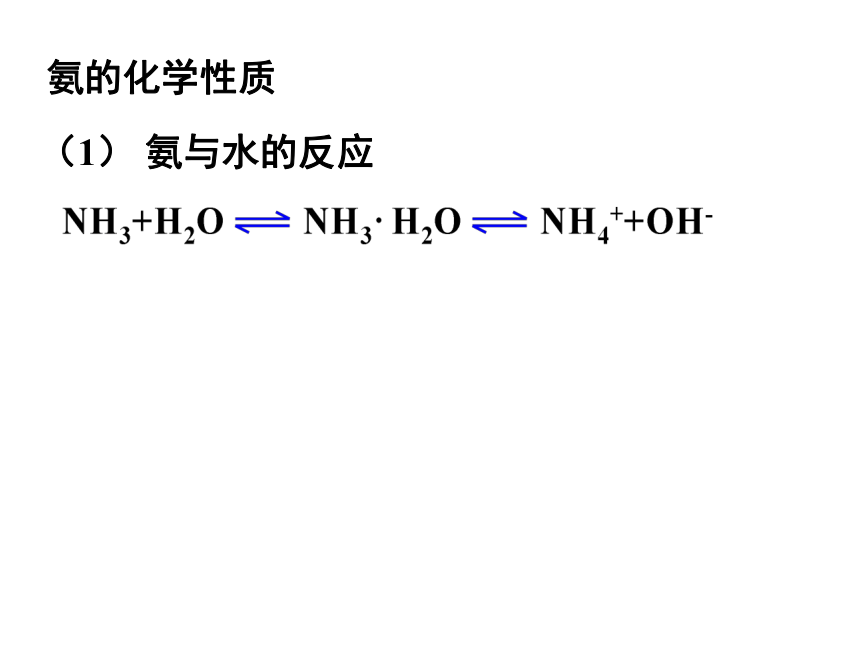
氨的化学性质
(1) 氨与水的反应
氨的化学性质
(1) 氨与水的反应
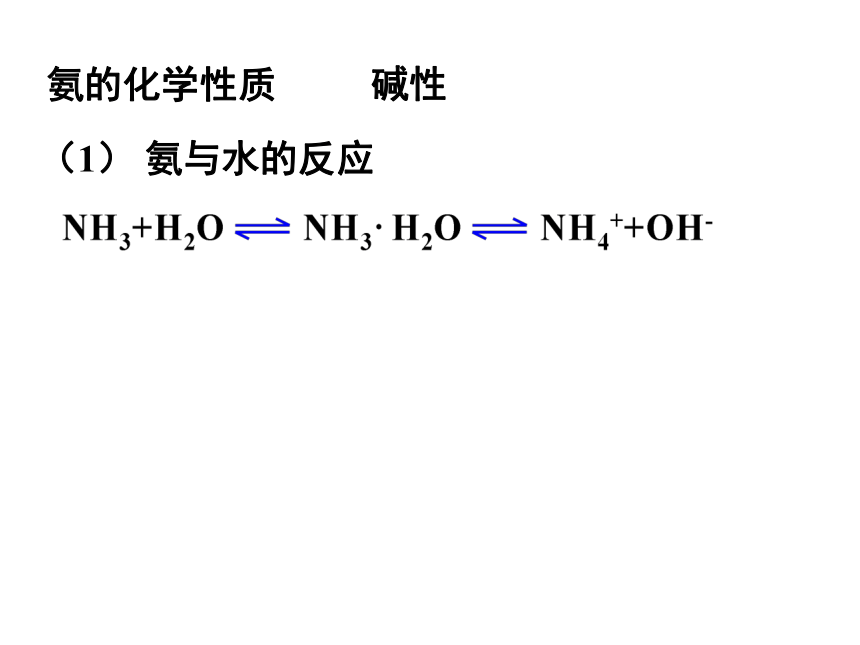
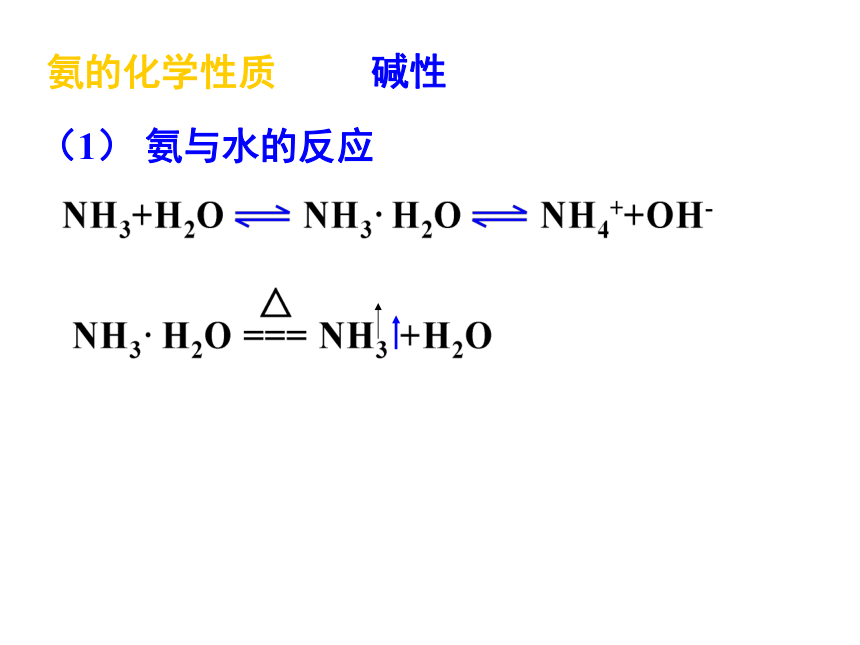
氨的化学性质
碱性
(1) 氨与水的反应
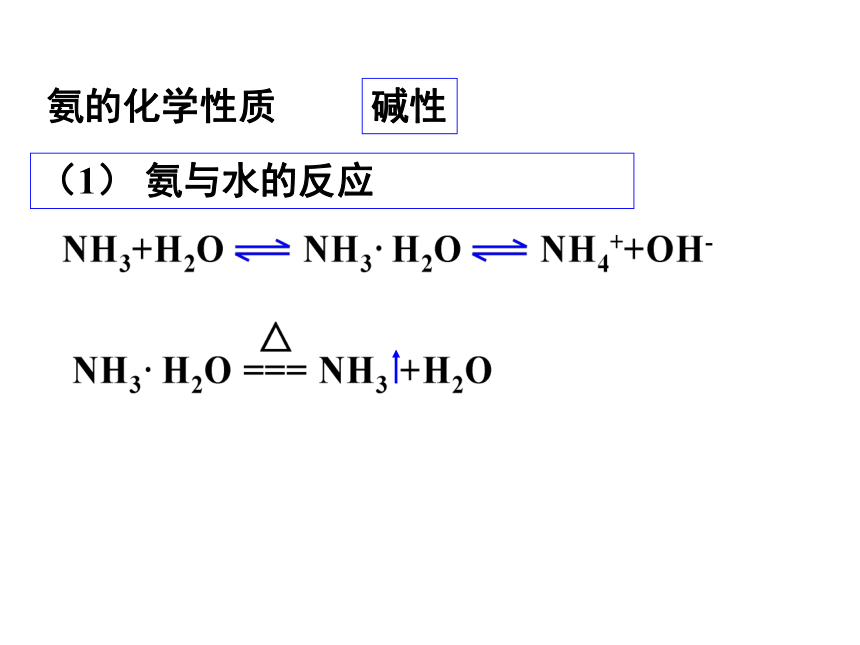
氨的化学性质
碱性
(1) 氨与水的反应
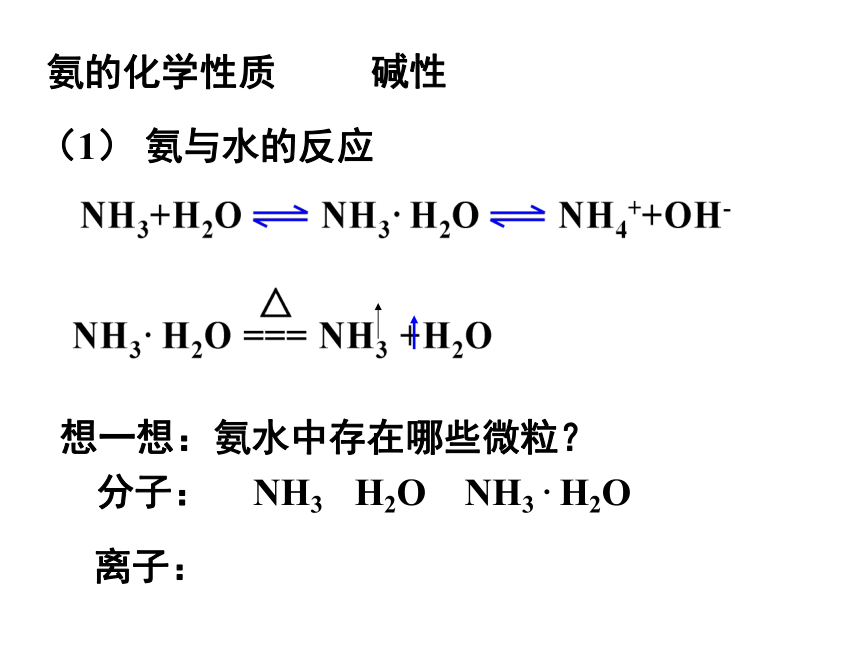
氨的化学性质
想一想:氨水中存在哪些微粒?
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
分子:
离子:
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
分子:
离子:
NH3 H2O NH3 · H2O
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
分子:
离子:
NH3 H2O NH3 · H2O
NH4+ OH-
碱性
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
解释:
现象:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
现象:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
NH3+HNO3
NH3+H2SO4
请写出下列反应的化学方程式
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
NH3+HNO3
NH3+HNO3===NH4NO3
NH3+H2SO4
请写出下列反应的化学方程式
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
NH3+HNO3
NH3+HNO3===NH4NO3
NH3+H2SO4
2NH3+H2SO4===(NH4)2SO4
请写出下列反应的化学方程式
铵盐的性质
铵盐的性质
(1)易溶于水,受热易分解
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
NH4HCO3===NH3 +H2O +CO2
△
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
NH4HCO3===NH3 +H2O +CO2
△
(2)与碱反应放出氨气
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
NH4HCO3===NH3 +H2O +CO2
△
(2)与碱反应放出氨气
NH4NO3+NaOH===NaNO3+H2O+NH3
△
氨气的实验室制法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
收集方法:
验满方法:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
干燥方法:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
干燥方法:
用碱石灰(NaOH和 CaO)干燥。
在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:
反应:
在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:
固体由蓝色变为灰白色,溶液仍为无色。
反应:
在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:
固体由蓝色变为灰白色,溶液仍为无色。
反应:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
在点滴板中放入少量胆矾,再加入少量浓硫酸
新课标人教版课件系列
《高中化学》
必修1
4.4.3《氨》
第四节《硫酸、硝酸和氨 》
第三课时
第四章 非金属及其化合物
教学目标
1.知识与技能
①使学生了解氨的物理性质和用途,掌握氨的化学性质及其实验室制法;
②了解铵盐的性质。
3.情感态度与价值观
通过演示实验,培养学生观察和分析问题的能力。学生通过自己动手实验,激发学习化学的兴趣和热情,培养学生透过现象看本质的辨证唯物主义观点和实事求是的科学态度,体验科学探究的艰辛和喜悦,增强学生对化学知识在社会生产中的重要作用的认识。
教学的重点和难点
氨和铵盐的化学性质、实验室制法。
氨的物理性质
(1) 氨与水的反应
氨的化学性质
(1) 氨与水的反应
氨的化学性质
(1) 氨与水的反应
氨的化学性质
碱性
(1) 氨与水的反应
氨的化学性质
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
分子:
离子:
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
分子:
离子:
NH3 H2O NH3 · H2O
碱性
(1) 氨与水的反应
氨的化学性质
想一想:氨水中存在哪些微粒?
分子:
离子:
NH3 H2O NH3 · H2O
NH4+ OH-
碱性
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
解释:
现象:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
现象:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
NH3+HNO3
NH3+H2SO4
请写出下列反应的化学方程式
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
NH3+HNO3
NH3+HNO3===NH4NO3
NH3+H2SO4
请写出下列反应的化学方程式
(2) 氨与酸反应
使两根分别蘸有浓氨 水 和浓盐酸的玻璃棒
接近。
两根玻璃棒靠近时产生大量白烟。
解释:
NH3+HCl==NH4Cl
现象:
NH3+HNO3
NH3+HNO3===NH4NO3
NH3+H2SO4
2NH3+H2SO4===(NH4)2SO4
请写出下列反应的化学方程式
铵盐的性质
铵盐的性质
(1)易溶于水,受热易分解
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
NH4HCO3===NH3 +H2O +CO2
△
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
NH4HCO3===NH3 +H2O +CO2
△
(2)与碱反应放出氨气
铵盐的性质
(1)易溶于水,受热易分解
NH4Cl===NH3 +HCl
△
NH4HCO3===NH3 +H2O +CO2
△
(2)与碱反应放出氨气
NH4NO3+NaOH===NaNO3+H2O+NH3
△
氨气的实验室制法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
收集方法:
验满方法:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
干燥方法:
氨气的实验室制法
反应原理:利用氨盐与碱反应的性质制取氨气
收集方法:
向下排气法
验满方法:
将湿润的红色石蕊试纸放在试管口,
如果试纸变蓝,说明氨气已集满。
环保措施:
用稀硫酸吸收多余的氨气。
干燥方法:
用碱石灰(NaOH和 CaO)干燥。
在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:
反应:
在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:
固体由蓝色变为灰白色,溶液仍为无色。
反应:
在点滴板中放入少量胆矾,再加入少量浓硫酸
现象:
固体由蓝色变为灰白色,溶液仍为无色。
反应:
CuSO4·5H2O + H2SO4(浓)
= CuSO4 + H2SO4·5H2O
在点滴板中放入少量胆矾,再加入少量浓硫酸
