4.4.2《硝酸》PPT课件(新人教版-必修1)
文档属性
| 名称 | 4.4.2《硝酸》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 170.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 00:00:00 | ||
图片预览











文档简介
(共36张PPT)
新课标人教版课件系列
《高中化学》
必修1
4.4.2《硝酸》
第四节《硫酸、硝酸和氨 》
第二课时
第四章 非金属及其化合物
教学目标
知识与技能
1.了解硝酸的物理性质及保存方法。
2.理解硝酸的强酸性。
3.掌握硝酸的不稳定性、强氧化性。
过程与方法
1.学会全面观察、分析、设计实验,提高观察、实验、探索、思维和自学能力。
2.通过探究硝酸的性质,培养学生的动手、动脑和运用知识的能力、观察能力。
情感、态度和价值观
1.通过掌握浓、稀硝酸性质的差异,使学生进一步理解量变引起质变的规律,帮助学生树立起辩证唯物主义的世界观。
2.了解工业制硝酸中尾气的危害及处理方法,增强学生环保意识。
3.通过介绍化学家的故事,使学生树立热爱科学、尊重科学的品质,激发学生学习的兴趣。
【教学重点】
硝酸的不稳定性和强氧化性
【教学难点】
硝酸的强氧化性
【教具准备】
多媒体、试管、试管夹、无色透明气球、铜片、浓(稀)HNO3、酒精灯、胶头滴管
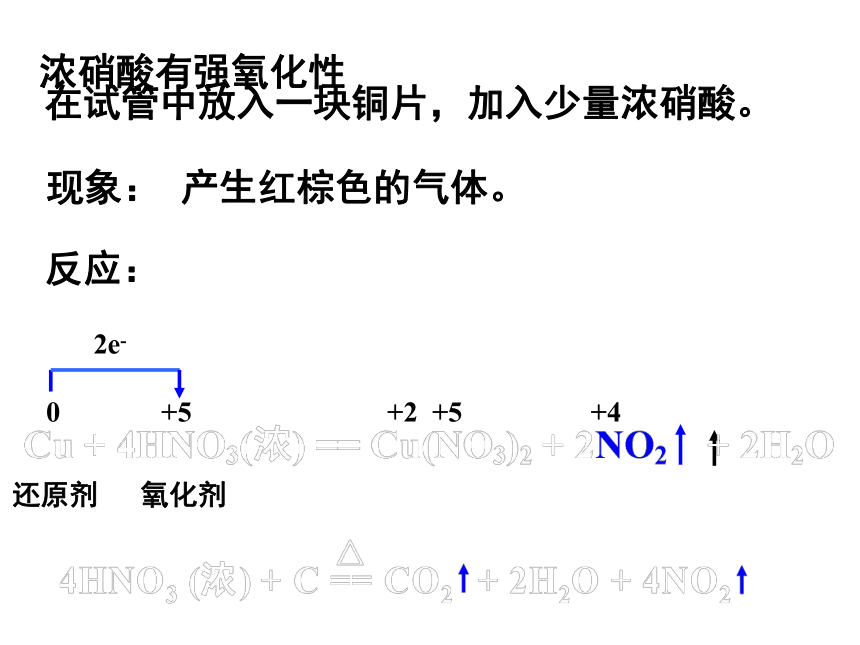
浓硝酸有强氧化性
在试管中放入一块铜片,加入少量浓硝酸。
现象:
产生红棕色的气体。
反应:
0
+5
+5
+4
+2
还原剂
氧化剂
2e-
在试管中放入一块铜片,加入少量稀硝酸。
现象:
反应:
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
氧化剂
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
氧化剂
6e-
△
稀硝酸有强氧化性
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
氧化剂
6e-
△
现象:
解释:
浓硝酸能使铁、铝等金属钝化
在试管中放入一块铁片,加入少量浓硝酸;
加热
现象:
常温无明显变化,加热后能反应。
解释:
浓硝酸能使铁、铝等金属钝化
在试管中放入一块铁片,加入少量浓硝酸;
加热
现象:
常温无明显变化,加热后能反应。
解释:
常温下,浓硝酸能使铁、铝等金属
表面生成一层致密的氧化物保护膜,
阻止内部金属继续跟硫酸起反应。
浓硝酸能使铁、铝等金属钝化
在试管中放入一块铁片,加入少量浓硝酸;
加热
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2
或NO,活泼金属与硝酸反应,硝酸的还原
产物很复杂。
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2
或NO,活泼金属与硝酸反应,硝酸的还原
产物很复杂。
王水
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2
或NO,活泼金属与硝酸反应,硝酸的还原
产物很复杂。
王水
V(浓硝酸) : V(浓盐酸) = 1 : 3
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
有吸水性、脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
有吸水性、脱水性
无
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
只能氧化金属活动
顺序表氢前的金属
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
只能氧化金属活动
顺序表氢前的金属
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
强
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
只能氧化金属活动
顺序表氢前的金属
可以氧化金属活动
顺序表氢后的金属
及某些非金属
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
强
新课标人教版课件系列
《高中化学》
必修1
4.4.2《硝酸》
第四节《硫酸、硝酸和氨 》
第二课时
第四章 非金属及其化合物
教学目标
知识与技能
1.了解硝酸的物理性质及保存方法。
2.理解硝酸的强酸性。
3.掌握硝酸的不稳定性、强氧化性。
过程与方法
1.学会全面观察、分析、设计实验,提高观察、实验、探索、思维和自学能力。
2.通过探究硝酸的性质,培养学生的动手、动脑和运用知识的能力、观察能力。
情感、态度和价值观
1.通过掌握浓、稀硝酸性质的差异,使学生进一步理解量变引起质变的规律,帮助学生树立起辩证唯物主义的世界观。
2.了解工业制硝酸中尾气的危害及处理方法,增强学生环保意识。
3.通过介绍化学家的故事,使学生树立热爱科学、尊重科学的品质,激发学生学习的兴趣。
【教学重点】
硝酸的不稳定性和强氧化性
【教学难点】
硝酸的强氧化性
【教具准备】
多媒体、试管、试管夹、无色透明气球、铜片、浓(稀)HNO3、酒精灯、胶头滴管
浓硝酸有强氧化性
在试管中放入一块铜片,加入少量浓硝酸。
现象:
产生红棕色的气体。
反应:
0
+5
+5
+4
+2
还原剂
氧化剂
2e-
在试管中放入一块铜片,加入少量稀硝酸。
现象:
反应:
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
氧化剂
△
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
氧化剂
6e-
△
稀硝酸有强氧化性
在试管中放入一块铜片,加入少量稀硝酸。
现象:
产生无色的气体在瓶口变成红棕色。
反应:
0
+5
+5
+2
+2
还原剂
氧化剂
6e-
△
现象:
解释:
浓硝酸能使铁、铝等金属钝化
在试管中放入一块铁片,加入少量浓硝酸;
加热
现象:
常温无明显变化,加热后能反应。
解释:
浓硝酸能使铁、铝等金属钝化
在试管中放入一块铁片,加入少量浓硝酸;
加热
现象:
常温无明显变化,加热后能反应。
解释:
常温下,浓硝酸能使铁、铝等金属
表面生成一层致密的氧化物保护膜,
阻止内部金属继续跟硫酸起反应。
浓硝酸能使铁、铝等金属钝化
在试管中放入一块铁片,加入少量浓硝酸;
加热
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2
或NO,活泼金属与硝酸反应,硝酸的还原
产物很复杂。
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2
或NO,活泼金属与硝酸反应,硝酸的还原
产物很复杂。
王水
大多数金属(Pt、Au除外)都能被硝酸氧化
不活泼金属与硝酸反应,硝酸被还原为NO2
或NO,活泼金属与硝酸反应,硝酸的还原
产物很复杂。
王水
V(浓硝酸) : V(浓盐酸) = 1 : 3
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
有吸水性、脱水性
浓硫酸和硝酸的性质
浓H2SO4 HNO3
与Cu
反应
钝化
现象
与C
反应
吸水性
脱水性
使Fe、 Al 钝化
浓HNO3 使Fe、 Al 钝化
有吸水性、脱水性
无
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
只能氧化金属活动
顺序表氢前的金属
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
只能氧化金属活动
顺序表氢前的金属
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
强
稀硫酸 浓硫酸
氧化性
本 质
氧化性
强 弱
H+
硫酸分子中+6价硫
弱
只能氧化金属活动
顺序表氢前的金属
可以氧化金属活动
顺序表氢后的金属
及某些非金属
思考:稀硫酸的氧化性和浓硫酸的氧化性有何不同
强
