3.2.2《铝的重要化合物》PPT课件(新人教版-必修1)
文档属性
| 名称 | 3.2.2《铝的重要化合物》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 737.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 00:00:00 | ||
图片预览






文档简介
(共14张PPT)
新课标人教版课件系列
《高中化学》
必修1
3.2.2《铝的重要
化合物》
教学目标
知识与能力
1.了解铝的几种重要化合物的性质。
2.理解Al(OH)3的两性。
【教学重点及难点】
Al(OH)3的两性。
【教学方法】
实验探究法
【教学用品】:
KAl(SO4)2·12H2O晶体、石蕊试液、试管、滴管、蒸馏水、0.5mol·L-1 Al2(SO4)3溶液、氨水、2 mol·L-1 HCl 2 mol·L-1 NaOH
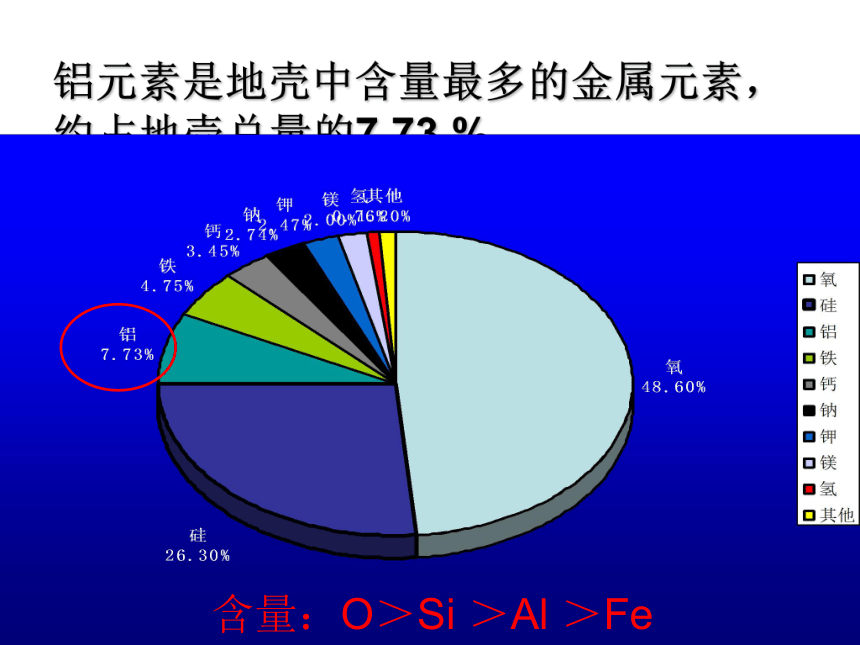
铝元素是地壳中含量最多的金属元素,约占地壳总量的7.73 %
含量:O>Si >Al >Fe
用耐磨的Al2O3
做成的轴承
耐高温氧化铝
陶瓷坩埚
一、氧化铝(aluminum oxide)的主要性质:
(1)物理性质:白色、不溶于水的固体,熔点很高。( 、 的主要成分)
红宝石
蓝宝石
探究氧化铝是否具有两性
方案
仪器
药品
步骤
现象
反应
结论
氧化铝是两性氧化物
取氧化铝粉末,分别滴加盐酸和氢氧化钠溶液
试管、滴管
氧化铝粉末、盐酸、氢氧化钠溶液
氧化铝在盐酸和氢氧化钠溶液中都溶解
Al2O3 + 6HCl == 2AlCl3 + 3H2O
Al2O3 + 2NaOH == 2NaAlO2 + H2O
1. 和酸反应:
Al2O3 +6HCl == 2AlCl3 + 3H2O
Al2O3 + 6H+ ==2Al3+ + 3H2O
2. 和碱反应:
Al2O3 + 2NaOH === 2NaAlO2 + H2O
Al2O3 + 2OH- === 2AlO2- + H2O
氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,所以氧化铝是两性氧化物。
(2)化学性质:
实验室如何制备少量氢氧化铝?
用硫酸铝和氨水制备
氢氧化铝溶解于强碱,但不溶于弱碱
实验3—7
得到氢氧化铝沉淀的方法有那些?
铝盐和氨水
铝盐和氢氧化钠
偏铝酸钠和盐酸反应
NaAlO2 + HCl + H2O ==Al(OH)3↓ + NaCl
偏铝酸钠和铝盐反应
3NaAlO2 + AlCl3 + 6H2O == 4Al(OH)3↓ + 3NaCl
……
(1)物理性质:
氢氧化铝是白色胶状物质,几乎不溶于水,有强的吸附性,能凝聚水中的悬浮物,并能吸附色素。
一、氢氧化铝(aluminum hydroxide)的主要性质:
探究氢氧化铝是否具有两性
氢氧化铝是两性氢氧化物
方案
仪器
药品
步骤
现象
反应
结论
取氢氧化铝,分别滴加盐酸和氢氧化钠溶液
试管、滴管
氢氧化铝、盐酸、氢氧化钠溶液
实验3—8
氢氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,氢氧化铝属于两性氢氧化物(amphoteric hydroxide)。
氢氧化铝不溶于弱酸、弱碱,而溶解在强酸、强碱中。
1、与酸反应:Al(OH)3+3HCl=AlCl3+3H2O
2、与碱反应: Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
偏铝酸钠
(2)化学性质:
3、不稳定性:氢氧化铝不稳定,受热易分解。 2Al(OH)3 = Al2O3+3H2O
硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子。
明矾是常用的净水剂
硫酸铝钾 KAl(SO4)2
KAl(SO4)2·12H2O(明矾)
某些药物、食物中含有Al的化合物
新课标人教版课件系列
《高中化学》
必修1
3.2.2《铝的重要
化合物》
教学目标
知识与能力
1.了解铝的几种重要化合物的性质。
2.理解Al(OH)3的两性。
【教学重点及难点】
Al(OH)3的两性。
【教学方法】
实验探究法
【教学用品】:
KAl(SO4)2·12H2O晶体、石蕊试液、试管、滴管、蒸馏水、0.5mol·L-1 Al2(SO4)3溶液、氨水、2 mol·L-1 HCl 2 mol·L-1 NaOH
铝元素是地壳中含量最多的金属元素,约占地壳总量的7.73 %
含量:O>Si >Al >Fe
用耐磨的Al2O3
做成的轴承
耐高温氧化铝
陶瓷坩埚
一、氧化铝(aluminum oxide)的主要性质:
(1)物理性质:白色、不溶于水的固体,熔点很高。( 、 的主要成分)
红宝石
蓝宝石
探究氧化铝是否具有两性
方案
仪器
药品
步骤
现象
反应
结论
氧化铝是两性氧化物
取氧化铝粉末,分别滴加盐酸和氢氧化钠溶液
试管、滴管
氧化铝粉末、盐酸、氢氧化钠溶液
氧化铝在盐酸和氢氧化钠溶液中都溶解
Al2O3 + 6HCl == 2AlCl3 + 3H2O
Al2O3 + 2NaOH == 2NaAlO2 + H2O
1. 和酸反应:
Al2O3 +6HCl == 2AlCl3 + 3H2O
Al2O3 + 6H+ ==2Al3+ + 3H2O
2. 和碱反应:
Al2O3 + 2NaOH === 2NaAlO2 + H2O
Al2O3 + 2OH- === 2AlO2- + H2O
氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,所以氧化铝是两性氧化物。
(2)化学性质:
实验室如何制备少量氢氧化铝?
用硫酸铝和氨水制备
氢氧化铝溶解于强碱,但不溶于弱碱
实验3—7
得到氢氧化铝沉淀的方法有那些?
铝盐和氨水
铝盐和氢氧化钠
偏铝酸钠和盐酸反应
NaAlO2 + HCl + H2O ==Al(OH)3↓ + NaCl
偏铝酸钠和铝盐反应
3NaAlO2 + AlCl3 + 6H2O == 4Al(OH)3↓ + 3NaCl
……
(1)物理性质:
氢氧化铝是白色胶状物质,几乎不溶于水,有强的吸附性,能凝聚水中的悬浮物,并能吸附色素。
一、氢氧化铝(aluminum hydroxide)的主要性质:
探究氢氧化铝是否具有两性
氢氧化铝是两性氢氧化物
方案
仪器
药品
步骤
现象
反应
结论
取氢氧化铝,分别滴加盐酸和氢氧化钠溶液
试管、滴管
氢氧化铝、盐酸、氢氧化钠溶液
实验3—8
氢氧化铝既能跟酸反应生成盐和水,又能跟碱反应生成盐和水,氢氧化铝属于两性氢氧化物(amphoteric hydroxide)。
氢氧化铝不溶于弱酸、弱碱,而溶解在强酸、强碱中。
1、与酸反应:Al(OH)3+3HCl=AlCl3+3H2O
2、与碱反应: Al(OH)3+NaOH=NaAlO2+2H2O
Al(OH)3 + 3H+ = Al3+ + 3H2O
Al(OH)3 + OH- = AlO2- + 2H2O
偏铝酸钠
(2)化学性质:
3、不稳定性:氢氧化铝不稳定,受热易分解。 2Al(OH)3 = Al2O3+3H2O
硫酸铝钾的电离:
KAl(SO4)2 = K++ Al3+ + 2SO42-
溶液中有三种自由移动的离子,两种阳离子,一种阴离子。
明矾是常用的净水剂
硫酸铝钾 KAl(SO4)2
KAl(SO4)2·12H2O(明矾)
某些药物、食物中含有Al的化合物
