3.4《归纳与整理-第三章 金属及其变化》PPT课件(新人教版-必修1)
文档属性
| 名称 | 3.4《归纳与整理-第三章 金属及其变化》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 984.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 21:08:37 | ||
图片预览






文档简介
(共21张PPT)
新课标人教版课件系列
《高中化学》
必修1
3.4《归纳与整理-
第三章 金属及其变化》
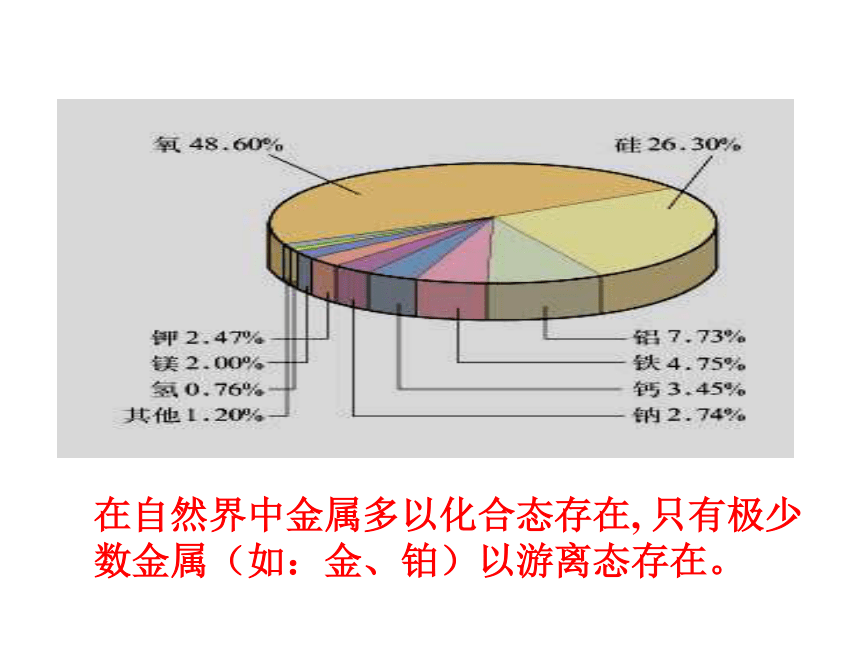
在自然界中金属多以化合态存在, 只有极少数金属(如:金、铂)以游离态存在。
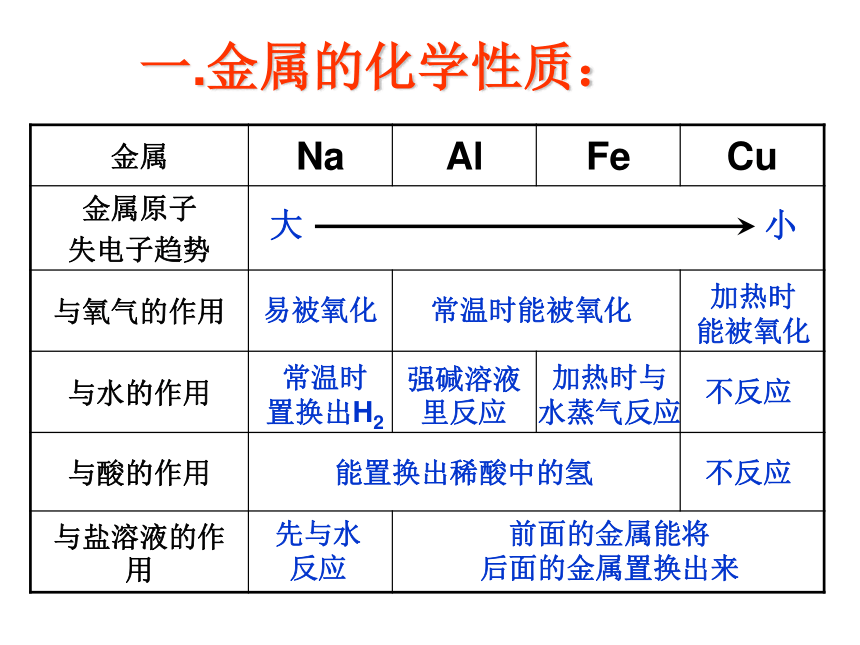
一.金属的化学性质:
金属 Na Al Fe Cu
金属原子
失电子趋势
与氧气的作用
与水的作用
与酸的作用
与盐溶液的作用
大
小
易被氧化
常温时能被氧化
加热时
能被氧化
常温时
置换出H2
强碱溶液里反应
加热时与
水蒸气反应
不反应
能置换出稀酸中的氢
不反应
前面的金属能将
后面的金属置换出来
先与水
反应
Ⅰ.钠的物理性质和化学性质
物理性质:为银白色的固体,质软(硬度小),密度比水还小,熔点较低。
化学性质:钠单质的化学性质活泼, 与氧气、水反应表现很强的还原性。
1.与氧气反应
4Na + O2 == 2Na2O (白色固体)
2Na + O2 === Na2O2
△
现象:
切口处银白色的金属光泽,在空气中很快变暗
钠的保存:保存在煤油或石蜡油中
(淡黄色固体)
思考:1、为什么钠要保存在煤油里?
2、能否用手直接拿钠?
3、如果钠着火了,该如何灭火?
4 、能否把钠保存在四氯化碳(CCl4)中?
不能。因为钠的密度比四氯化碳小,会浮于四氯化碳液面之上,四氯化碳无法隔绝空气与水蒸气。
因为钠会与水反应,所以不能用水或湿布灭火;
因此只能用沙土来灭火。
钠易与空气中的氧气、水反应,钠不与煤油反应,且密度比煤油大,保存在煤油里可以隔绝空气和水。
不能。因为手上有汗,汗里含有水份,钠会与
水反应。
现象:
可观察到钠先熔化后燃烧,发出黄色火焰,生成淡黄色的固体
2Na + O2 === Na2O2
△
4Al + 3 O2 ==== 2Al2O3
常温或加热
浮
游
熔
响
红
剧烈反应,浮在水面
产生的气体推动四处游动
熔成小球
发出“嘶嘶”响声
滴有酚酞的溶液变红
2Na + 2H2O == 2NaOH + H2
2.与水反应
3Fe+4H2O(g)== Fe3O4+4H2
2Al+2NaOH+2H2O==2NaAlO2+3H2
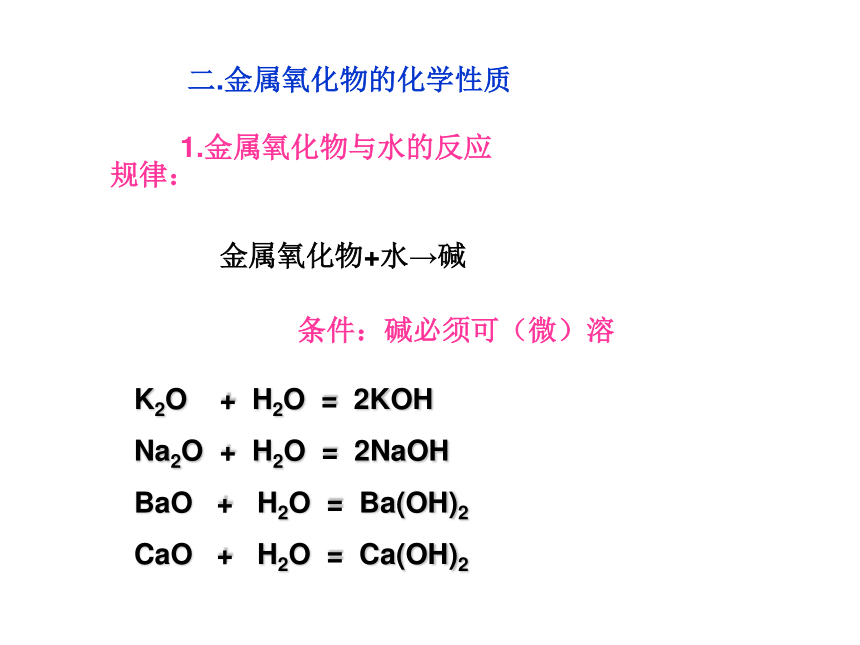
二.金属氧化物的化学性质
1.金属氧化物与水的反应
规律:
金属氧化物+水→碱
条件:碱必须可(微)溶
K2O + H2O = 2KOH
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
CaO + H2O = Ca(OH)2
1) 过氧化钠与水反应:
2)过氧化钠与二氧化碳反应:
2Na2O2+2H2O == 4NaOH + O2↑
2Na2O2+2CO2 == 2Na2CO3 + O2↑
实验现象:
①酚酞溶液变红 ②有气泡产生
③试管口的带火星木条复燃
氧化物 固体颜色 水溶性 与盐酸反应的化学方程式(注明溶液颜色)
Na2O
MgO
Fe2O3
CuO
白色
白色
红棕色俗称铁红
黑色
溶
不溶
不溶
不溶
Na2O+2HCl=2NaCl+H2O
MgO+2HCl=MgCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O
CuO+2HCl=CuCl2+H2O
2.金属氧化物与盐酸的反应
碱性氧化物:
凡能跟酸起反应,生成盐和水的氧化物叫做碱性氧化物.
酸性氧化物:
凡能跟碱起反应,生成盐和水的氧化物叫做酸性氧化物 。
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
既能和酸反应生成盐和水,又能和碱反应生成盐和水的氧化物叫两性氧化物。
三.金属氢氧化物的化学性质
1.铁的氢氧化物的制备
FeCl3溶液 FeSO4溶液
加NaOH溶液
化学方程式
生成红褐色
沉淀
先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀
FeCl3+3NaOH
=3Fe(OH)3
+3NaCl
FeSO4+2NaOH=Fe(OH)2 +Na2SO4
4Fe(OH)2 +O2+2H2O= 4Fe(OH)3
2.Fe(OH)2和Fe(OH)3与酸反应
Fe(OH)2+2HCl=FeCl2+2H2O
Fe(OH)3+3HCl=FeCl3+3H2O
3.氢氧化铁的不稳定性
2Fe(OH)3=Fe2O3+3H2O
这是难溶碱的共性——受热分解。
4.氢氧化铝制备
用铝盐溶液和氨水
Al2(SO4)3+6NH3·H2O=2Al(OH)3 +3(NH4)2SO4
5.氢氧化铝的性质
具有两性:
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
既能与酸起反应,又能与强碱溶液起反应的氢氧化物叫两性氢氧化物。
6.氢氧化铝的不稳定性
2Al(OH)3=Al2O3+3H2O
四.碳酸钠(苏打、纯碱)和碳酸氢钠(小苏打)的性质
1、Na2CO3和NaHCO3在水中的溶解性
溶解性: Na2CO3>NaHCO3
2、Na2CO3和NaHCO3的热稳定性
Na2CO3
NaHCO3
:受热不分解
:受热分解
2NaHCO3==Na2CO3+H2O+CO2
Na2CO3+2HCl=2NaCl+H2O+CO2
NaHCO3+HCl=NaCl+H2O+CO2
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
3、Na2CO3和NaHCO3与其它物质的反应
2NaHCO3=Na2CO3+H2O+CO2
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2= 2NaHCO3
4、Na2CO3和NaHCO3的相互转化
NaHCO3
Na2CO3
1
固体,加热
2
溶液,加NaOH
通入CO2
五. 铁离子
1、Fe3+的检验
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液显血红色
溶液颜色无变化
Fe3++3SCN- = Fe(SCN)3
(血红色)
2、Fe3+的氧化性
加入 现象 反应的化学方程式
铁粉,KSCN溶液
加入氯水,振荡
不显血红色
溶液显血红色
2FeCl3+Fe=3FeCl2
2FeCl2+Cl2=2FeCl3
3.Fe3+与Fe2+转化
还原剂
+氧化剂(Cl2)
+还原剂(Fe)
氧化剂
Fe2+
Fe3+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=2Fe2++I2
Fe3++Fe=3 Fe2+
2Fe2++Cl2=2Fe3++Cl2
六.焰色反应
钠
钾(透过蓝色钴玻璃呈 )
钙
锶
钡
铜
銣
(呈黄色)
紫色
新课标人教版课件系列
《高中化学》
必修1
3.4《归纳与整理-
第三章 金属及其变化》
在自然界中金属多以化合态存在, 只有极少数金属(如:金、铂)以游离态存在。
一.金属的化学性质:
金属 Na Al Fe Cu
金属原子
失电子趋势
与氧气的作用
与水的作用
与酸的作用
与盐溶液的作用
大
小
易被氧化
常温时能被氧化
加热时
能被氧化
常温时
置换出H2
强碱溶液里反应
加热时与
水蒸气反应
不反应
能置换出稀酸中的氢
不反应
前面的金属能将
后面的金属置换出来
先与水
反应
Ⅰ.钠的物理性质和化学性质
物理性质:为银白色的固体,质软(硬度小),密度比水还小,熔点较低。
化学性质:钠单质的化学性质活泼, 与氧气、水反应表现很强的还原性。
1.与氧气反应
4Na + O2 == 2Na2O (白色固体)
2Na + O2 === Na2O2
△
现象:
切口处银白色的金属光泽,在空气中很快变暗
钠的保存:保存在煤油或石蜡油中
(淡黄色固体)
思考:1、为什么钠要保存在煤油里?
2、能否用手直接拿钠?
3、如果钠着火了,该如何灭火?
4 、能否把钠保存在四氯化碳(CCl4)中?
不能。因为钠的密度比四氯化碳小,会浮于四氯化碳液面之上,四氯化碳无法隔绝空气与水蒸气。
因为钠会与水反应,所以不能用水或湿布灭火;
因此只能用沙土来灭火。
钠易与空气中的氧气、水反应,钠不与煤油反应,且密度比煤油大,保存在煤油里可以隔绝空气和水。
不能。因为手上有汗,汗里含有水份,钠会与
水反应。
现象:
可观察到钠先熔化后燃烧,发出黄色火焰,生成淡黄色的固体
2Na + O2 === Na2O2
△
4Al + 3 O2 ==== 2Al2O3
常温或加热
浮
游
熔
响
红
剧烈反应,浮在水面
产生的气体推动四处游动
熔成小球
发出“嘶嘶”响声
滴有酚酞的溶液变红
2Na + 2H2O == 2NaOH + H2
2.与水反应
3Fe+4H2O(g)== Fe3O4+4H2
2Al+2NaOH+2H2O==2NaAlO2+3H2
二.金属氧化物的化学性质
1.金属氧化物与水的反应
规律:
金属氧化物+水→碱
条件:碱必须可(微)溶
K2O + H2O = 2KOH
Na2O + H2O = 2NaOH
BaO + H2O = Ba(OH)2
CaO + H2O = Ca(OH)2
1) 过氧化钠与水反应:
2)过氧化钠与二氧化碳反应:
2Na2O2+2H2O == 4NaOH + O2↑
2Na2O2+2CO2 == 2Na2CO3 + O2↑
实验现象:
①酚酞溶液变红 ②有气泡产生
③试管口的带火星木条复燃
氧化物 固体颜色 水溶性 与盐酸反应的化学方程式(注明溶液颜色)
Na2O
MgO
Fe2O3
CuO
白色
白色
红棕色俗称铁红
黑色
溶
不溶
不溶
不溶
Na2O+2HCl=2NaCl+H2O
MgO+2HCl=MgCl2+H2O
Fe2O3+6HCl=2FeCl3+3H2O
CuO+2HCl=CuCl2+H2O
2.金属氧化物与盐酸的反应
碱性氧化物:
凡能跟酸起反应,生成盐和水的氧化物叫做碱性氧化物.
酸性氧化物:
凡能跟碱起反应,生成盐和水的氧化物叫做酸性氧化物 。
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
既能和酸反应生成盐和水,又能和碱反应生成盐和水的氧化物叫两性氧化物。
三.金属氢氧化物的化学性质
1.铁的氢氧化物的制备
FeCl3溶液 FeSO4溶液
加NaOH溶液
化学方程式
生成红褐色
沉淀
先生成白色絮状沉淀,而后迅速变为灰绿色,最后变为红褐色沉淀
FeCl3+3NaOH
=3Fe(OH)3
+3NaCl
FeSO4+2NaOH=Fe(OH)2 +Na2SO4
4Fe(OH)2 +O2+2H2O= 4Fe(OH)3
2.Fe(OH)2和Fe(OH)3与酸反应
Fe(OH)2+2HCl=FeCl2+2H2O
Fe(OH)3+3HCl=FeCl3+3H2O
3.氢氧化铁的不稳定性
2Fe(OH)3=Fe2O3+3H2O
这是难溶碱的共性——受热分解。
4.氢氧化铝制备
用铝盐溶液和氨水
Al2(SO4)3+6NH3·H2O=2Al(OH)3 +3(NH4)2SO4
5.氢氧化铝的性质
具有两性:
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
既能与酸起反应,又能与强碱溶液起反应的氢氧化物叫两性氢氧化物。
6.氢氧化铝的不稳定性
2Al(OH)3=Al2O3+3H2O
四.碳酸钠(苏打、纯碱)和碳酸氢钠(小苏打)的性质
1、Na2CO3和NaHCO3在水中的溶解性
溶解性: Na2CO3>NaHCO3
2、Na2CO3和NaHCO3的热稳定性
Na2CO3
NaHCO3
:受热不分解
:受热分解
2NaHCO3==Na2CO3+H2O+CO2
Na2CO3+2HCl=2NaCl+H2O+CO2
NaHCO3+HCl=NaCl+H2O+CO2
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
3、Na2CO3和NaHCO3与其它物质的反应
2NaHCO3=Na2CO3+H2O+CO2
NaHCO3+NaOH=Na2CO3+H2O
Na2CO3+H2O+CO2= 2NaHCO3
4、Na2CO3和NaHCO3的相互转化
NaHCO3
Na2CO3
1
固体,加热
2
溶液,加NaOH
通入CO2
五. 铁离子
1、Fe3+的检验
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液显血红色
溶液颜色无变化
Fe3++3SCN- = Fe(SCN)3
(血红色)
2、Fe3+的氧化性
加入 现象 反应的化学方程式
铁粉,KSCN溶液
加入氯水,振荡
不显血红色
溶液显血红色
2FeCl3+Fe=3FeCl2
2FeCl2+Cl2=2FeCl3
3.Fe3+与Fe2+转化
还原剂
+氧化剂(Cl2)
+还原剂(Fe)
氧化剂
Fe2+
Fe3+
2Fe3++Cu=2Fe2++Cu2+
2Fe3++2I-=2Fe2++I2
Fe3++Fe=3 Fe2+
2Fe2++Cl2=2Fe3++Cl2
六.焰色反应
钠
钾(透过蓝色钴玻璃呈 )
钙
锶
钡
铜
銣
(呈黄色)
紫色
