4.1《无机非金属材料的主角---硅》PPT课件(新人教版-必修1)
文档属性
| 名称 | 4.1《无机非金属材料的主角---硅》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 35.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 21:18:37 | ||
图片预览










文档简介
(共50张PPT)
新课标人教版课件系列
《高中化学》
必修1
第四章 非金属及其化合物
第一节
《无机非金属材料
的主角---硅》
教学目标
知识与能力
1、了解硅在自然界中的存在、用途及性质
2、了解二氧化硅物理性质,掌握其化学性质
3、掌握硅酸钠的化学性质了解硅酸盐相关性质及其多样性、复杂性,认识硅酸盐在生产中的应用;
4、了解单质硅性质、制取和用途。
5、了解结构决定性质、性质决定用途的原理
教学重、难点:
硅单质的结构和性质;硅酸盐的多样性和复杂性、单质硅的用途。
第一课时
硅橡胶
造房子用的砖、瓦、砂石、水泥、玻璃,吃饭、喝水用的瓷碗、水杯,洗脸间的洁具,它们看上去截然不同,其实主要成分都是硅的化合物。
背景知识回顾:
1.写出C、Si的原子结构示意图
___________、__________________。
分析它们在结构上有何共同点,判断它们与氧结合能力孰强孰弱?
硅结合氧能力强
背景知识回顾:
2.地壳中含量最多的元素是_______,其次是_______。空气中含量最多的元素是_______,其次是_______。
氧
硅
氮
氧
背景知识回顾:
3.以二氧化碳为例说明酸性氧化物的性质。
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
CO2+H2O=H2CO3
思考与交流
1.地球上的硅元素主要以什么形式存在 为什么?
硅元素主要以熔点很高的氧化物及硅酸盐的形式存在。
地球被氧化气氛包围,硅是一种亲氧元素,在自然界中它总是与氧化合。
思考与交流
2.二氧化硅与二氧化碳哪种物质更稳定?为什么?
二氧化硅更稳定
C+O2= CO2 放热393.5kJ
Si+O2= SiO2 放热910.9kJ
放热越多,其生成物通常越稳定。可见SiO2比CO2更容易生成,而且更稳定。
一、二氧化硅和硅酸
1. 二氧化硅
存在:天然二氧化硅约占地壳质量的_____,其存在形式有_________和_________两大类,统称____________。
12%
结晶形
无定形
硅石
一、二氧化硅和硅酸
1. 二氧化硅
用途
① SiO2是制造光导纤维的主要原料;
② 石英制作石英玻璃、石英电子表、石英钟等;
③水晶常用来制造电子工业的重要部件、光学仪器、 工艺品等;
④石英砂常用于制玻璃和建筑材料。
金刚石结构
金刚石结构
二氧化硅的结构
二氧化硅的结构
二氧化硅的结构
一、二氧化硅和硅酸
1. 二氧化硅
结构:二氧化硅的基本结构单元是________体,,每个Si周围结合____个O,Si在中心,O在4个顶角;许多这样的四面体又通过顶角的O相连,每个O为两个四面体所共有,即每个O跟____个Si 结合。实际上,SiO2晶体是由Si和O按______的比例所组成的_______________结构的晶体。
四面
4
2
1︰2
立体网状
1. 二氧化硅
结构:二氧化硅的基本结构单元是________体,,每个Si周围结合____个O,Si在中心,O在4个顶角;许多这样的四面体又通过顶角的O相连,每个O为两个四面体所共有,即每个O跟____个Si 结合。实际上,SiO2晶体是由Si和O按______的比例所组成的_______________结构的晶体。
四面
4
1︰2
立体网状
根据二氧化硅的存在和应用,请分析以下问题:二氧化硅具有哪些物理性质?化学稳定性如何?你的根据是什么?二氧化硅的这些性质是由什么决定的?
思考与交流
一、二氧化硅和硅酸
二氧化硅
二氧化碳
化学式的意义
物理性质
化学性质
SiO2晶体由Si和O原子按1:2比例组成,不存在分子
二氧化碳由CO2分子构成
不溶于水的无色晶体,熔点高,硬度大
可溶于水的
无色无气味气体
SiO2+4HF=SiF4↑+2H2O
SiO2+CaO=CaSiO3
SiO2+2NaOH=Na2SiO3 +2H2O
SiO2+3C=SiC+2CO ↑
CO2+CaO=CaCO3
CO2+2NaOH=
Na2CO3 +2H2O
SiO2+2C=Si +2CO
SiO2+CaO=CaSiO3
CO2+CaO=CaCO3
一、二氧化硅和硅酸
问题探究
1.为什么实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞?
玻璃的成分中含有二氧化硅,
SiO2+NaOH=Na2SiO3+H2O
生成有粘性的Na2SiO3,使玻璃塞打不开
问题探究
2.实验室能否用玻璃瓶保存氢氟酸?
不能,会发生反应而腐蚀玻璃SiO2+4HF=SiF4↑+2H2O
应该用塑料瓶
2.硅酸
二氧化硅是酸性氧化物,它对应的水化物是__________和_______________。SiO2既是H2SiO3的酸酐又是_______________的酸酐。
硅酸H2SiO3
原硅酸H4SiO4
原硅酸H4SiO4
硅酸是通过_________________与其他__________________反应制得的。
可溶性硅酸盐
酸性比它强的酸
制取硅酸:
现象___________________________________,
结论
________________________________________
化学方程式_______________________________
生成白色胶状沉淀
可溶性硅酸盐可以与其他酸反应
硅酸不溶于水
Na2SiO3+2HCl=H2SiO3↓+2NaCl
硅酸与硅胶
硅酸的颜色_________,状态__________,水溶性_________,硅酸能形成____________溶液。硅胶多孔,吸附水分能力强,常用作___________,也可以用作催化剂的_______________
白色
固体
不溶于水
胶体
干燥剂
载体
硅胶:
硅酸H2SiO3
聚合
胶体(硅酸溶胶)
浓度较大
干燥脱水
硅酸凝胶(胶冻状)
硅酸干胶(硅胶)
硅酸的酸性
硅酸酸性__________碳酸酸性,请你设计实验来证明并写出有关的化学方程式。
弱于
向硅酸钠溶液中通入二氧化碳
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
问题探究
1.硅酸能否用SiO2和水直接化合制备?
不能
2.如何由SiO2来制取H2SiO3?
Na2SiO3+2HCl=H2SiO3↓+2NaCl
SiO2+2NaOH=Na2SiO3 +2H2O
第一课时
背景知识回顾:
根据上节课的学习,请写出下列反应的化学方程式
(1)SiO2+CaO=
(2) SiO2+NaOH=
以上两个反应中生成的盐都是_________________。
硅酸盐
背景知识回顾:
对于反应:CaCO3=== CaO + CO2↑和
SiO2+CaO===CaSiO3,可以看出CaCO3
的稳定性比CaSiO3_______________。
弱
高温
高温
二、硅酸盐
(1)硅酸盐是由_____、____和_______组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都___________,化学性质__________。通常用____________和_________________的形式表示其组成。
硅
氧
金属
不溶于水
稳定
二氧化硅
金属氧化物
硅酸盐
(2)硅酸盐的表示方法——用氧化物的形式表示
氧化物的顺序:
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
注意:
①氧化物之间以“ ”隔开;
②系数配置出现分数应化为整数,氧化物前的系数仅代表该氧化物本身;
③实际上硅酸盐不是以简单氧化物形式存在的,而是以种种结构复杂的盐的形式存在的。
用氧化物形式表示硅酸盐的组成
①硅酸钠Na2SiO3 ______________
②硅酸钙CaSiO3______________
③高岭石Al2(Si2O5)(OH)4_____________
④正长石KAlSi3O8___________________
⑤普通玻璃的大致组成_____________________
⑥水泥的主要成分_________________________
⑦黏土的主要成分_________________________
用氧化物形式表示硅酸盐的组成
用氧化物形式表示硅酸盐的组成
Na2O SiO2
CaO SiO2
Al2O3 2SiO2 2H2O
K2O Al2O3 6SiO2
Na2O CaO 6SiO2
3CaO SiO2 、 2CaO SiO2、 3CaO Al2O3
Al2O3 2SiO2 2H2O
硅酸盐
硅酸钠的水溶液俗称______________,可用作肥皂填料、木材防火剂及黏胶剂等。
水玻璃
放入
蒸馏水 放入Na2SiO3
饱和溶液
现象
结论
水分蒸发后就燃烧
水分蒸发后不燃烧
木条、滤纸易燃烧
Na2SiO3可作防火剂
问题探究
土壤胶体是怎样形成的?为什么土壤胶体具有保肥能力?
硅酸盐岩石长期在水的侵蚀下,风化为黏土,并且形成土壤胶体。土壤胶体因其表面积较大且一般带负电,能吸收NH4+、K+等数十种生物所需的营养离子,所以土壤具有保肥能力。
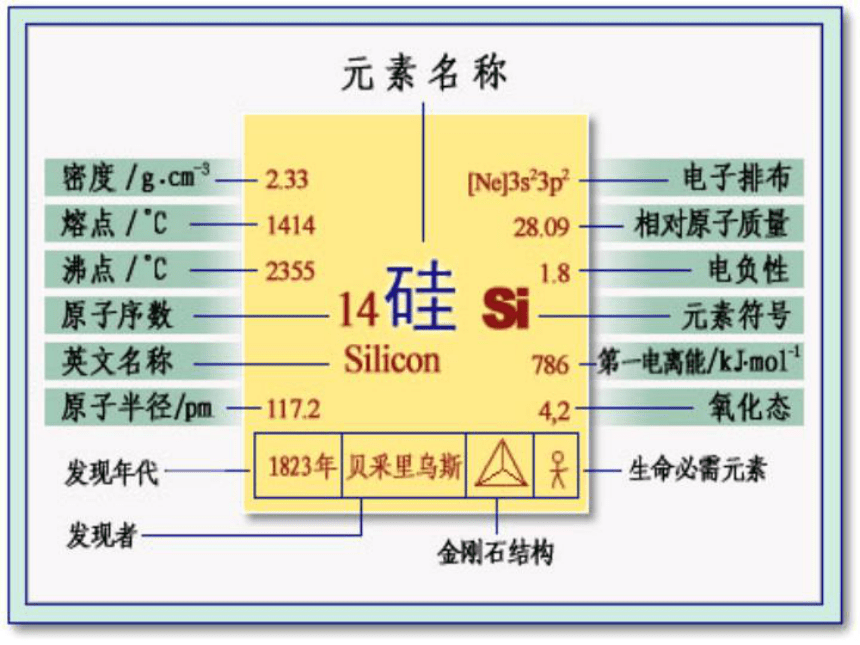
晶体硅为钢灰色,无定形硅为黑色,密度2.4g/cm3,熔点1420℃,沸点2355℃,晶体硅属于原子晶体,硬而有光泽,有半导体性质
单晶硅是一种重要的半导体材料,用于制造大功率晶体管、整流器、太阳能电池等。
双向可控硅
三、硅单质
(1)硅的同素异形体:硅有_____种同素异形体,分别是____________________________。
(2)晶体硅是______色、有___________、_____________的固体。它的结构类似于__________,其熔沸点都很高,硬度______,导电性______________________,是良好的_________
材料,广泛地应用于电子工业。硅是人类将______________转换____________的常用材料。
两
晶体和无定形
灰黑
金属光泽
硬而脆
金刚石
大
界于导体和绝缘体之间
半导体
太阳能
电能
化学性质
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2O
Si+2NaOH+2H2O=Na2SiO3+2H2 ↑
Si+O2===SiO2
加热
Si+2Cl2===SiCl4
加热
新课标人教版课件系列
《高中化学》
必修1
第四章 非金属及其化合物
第一节
《无机非金属材料
的主角---硅》
教学目标
知识与能力
1、了解硅在自然界中的存在、用途及性质
2、了解二氧化硅物理性质,掌握其化学性质
3、掌握硅酸钠的化学性质了解硅酸盐相关性质及其多样性、复杂性,认识硅酸盐在生产中的应用;
4、了解单质硅性质、制取和用途。
5、了解结构决定性质、性质决定用途的原理
教学重、难点:
硅单质的结构和性质;硅酸盐的多样性和复杂性、单质硅的用途。
第一课时
硅橡胶
造房子用的砖、瓦、砂石、水泥、玻璃,吃饭、喝水用的瓷碗、水杯,洗脸间的洁具,它们看上去截然不同,其实主要成分都是硅的化合物。
背景知识回顾:
1.写出C、Si的原子结构示意图
___________、__________________。
分析它们在结构上有何共同点,判断它们与氧结合能力孰强孰弱?
硅结合氧能力强
背景知识回顾:
2.地壳中含量最多的元素是_______,其次是_______。空气中含量最多的元素是_______,其次是_______。
氧
硅
氮
氧
背景知识回顾:
3.以二氧化碳为例说明酸性氧化物的性质。
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
CO2+H2O=H2CO3
思考与交流
1.地球上的硅元素主要以什么形式存在 为什么?
硅元素主要以熔点很高的氧化物及硅酸盐的形式存在。
地球被氧化气氛包围,硅是一种亲氧元素,在自然界中它总是与氧化合。
思考与交流
2.二氧化硅与二氧化碳哪种物质更稳定?为什么?
二氧化硅更稳定
C+O2= CO2 放热393.5kJ
Si+O2= SiO2 放热910.9kJ
放热越多,其生成物通常越稳定。可见SiO2比CO2更容易生成,而且更稳定。
一、二氧化硅和硅酸
1. 二氧化硅
存在:天然二氧化硅约占地壳质量的_____,其存在形式有_________和_________两大类,统称____________。
12%
结晶形
无定形
硅石
一、二氧化硅和硅酸
1. 二氧化硅
用途
① SiO2是制造光导纤维的主要原料;
② 石英制作石英玻璃、石英电子表、石英钟等;
③水晶常用来制造电子工业的重要部件、光学仪器、 工艺品等;
④石英砂常用于制玻璃和建筑材料。
金刚石结构
金刚石结构
二氧化硅的结构
二氧化硅的结构
二氧化硅的结构
一、二氧化硅和硅酸
1. 二氧化硅
结构:二氧化硅的基本结构单元是________体,,每个Si周围结合____个O,Si在中心,O在4个顶角;许多这样的四面体又通过顶角的O相连,每个O为两个四面体所共有,即每个O跟____个Si 结合。实际上,SiO2晶体是由Si和O按______的比例所组成的_______________结构的晶体。
四面
4
2
1︰2
立体网状
1. 二氧化硅
结构:二氧化硅的基本结构单元是________体,,每个Si周围结合____个O,Si在中心,O在4个顶角;许多这样的四面体又通过顶角的O相连,每个O为两个四面体所共有,即每个O跟____个Si 结合。实际上,SiO2晶体是由Si和O按______的比例所组成的_______________结构的晶体。
四面
4
1︰2
立体网状
根据二氧化硅的存在和应用,请分析以下问题:二氧化硅具有哪些物理性质?化学稳定性如何?你的根据是什么?二氧化硅的这些性质是由什么决定的?
思考与交流
一、二氧化硅和硅酸
二氧化硅
二氧化碳
化学式的意义
物理性质
化学性质
SiO2晶体由Si和O原子按1:2比例组成,不存在分子
二氧化碳由CO2分子构成
不溶于水的无色晶体,熔点高,硬度大
可溶于水的
无色无气味气体
SiO2+4HF=SiF4↑+2H2O
SiO2+CaO=CaSiO3
SiO2+2NaOH=Na2SiO3 +2H2O
SiO2+3C=SiC+2CO ↑
CO2+CaO=CaCO3
CO2+2NaOH=
Na2CO3 +2H2O
SiO2+2C=Si +2CO
SiO2+CaO=CaSiO3
CO2+CaO=CaCO3
一、二氧化硅和硅酸
问题探究
1.为什么实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞?
玻璃的成分中含有二氧化硅,
SiO2+NaOH=Na2SiO3+H2O
生成有粘性的Na2SiO3,使玻璃塞打不开
问题探究
2.实验室能否用玻璃瓶保存氢氟酸?
不能,会发生反应而腐蚀玻璃SiO2+4HF=SiF4↑+2H2O
应该用塑料瓶
2.硅酸
二氧化硅是酸性氧化物,它对应的水化物是__________和_______________。SiO2既是H2SiO3的酸酐又是_______________的酸酐。
硅酸H2SiO3
原硅酸H4SiO4
原硅酸H4SiO4
硅酸是通过_________________与其他__________________反应制得的。
可溶性硅酸盐
酸性比它强的酸
制取硅酸:
现象___________________________________,
结论
________________________________________
化学方程式_______________________________
生成白色胶状沉淀
可溶性硅酸盐可以与其他酸反应
硅酸不溶于水
Na2SiO3+2HCl=H2SiO3↓+2NaCl
硅酸与硅胶
硅酸的颜色_________,状态__________,水溶性_________,硅酸能形成____________溶液。硅胶多孔,吸附水分能力强,常用作___________,也可以用作催化剂的_______________
白色
固体
不溶于水
胶体
干燥剂
载体
硅胶:
硅酸H2SiO3
聚合
胶体(硅酸溶胶)
浓度较大
干燥脱水
硅酸凝胶(胶冻状)
硅酸干胶(硅胶)
硅酸的酸性
硅酸酸性__________碳酸酸性,请你设计实验来证明并写出有关的化学方程式。
弱于
向硅酸钠溶液中通入二氧化碳
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
问题探究
1.硅酸能否用SiO2和水直接化合制备?
不能
2.如何由SiO2来制取H2SiO3?
Na2SiO3+2HCl=H2SiO3↓+2NaCl
SiO2+2NaOH=Na2SiO3 +2H2O
第一课时
背景知识回顾:
根据上节课的学习,请写出下列反应的化学方程式
(1)SiO2+CaO=
(2) SiO2+NaOH=
以上两个反应中生成的盐都是_________________。
硅酸盐
背景知识回顾:
对于反应:CaCO3=== CaO + CO2↑和
SiO2+CaO===CaSiO3,可以看出CaCO3
的稳定性比CaSiO3_______________。
弱
高温
高温
二、硅酸盐
(1)硅酸盐是由_____、____和_______组成的化合物的总称。硅酸盐是一类结构复杂的物质,一般都___________,化学性质__________。通常用____________和_________________的形式表示其组成。
硅
氧
金属
不溶于水
稳定
二氧化硅
金属氧化物
硅酸盐
(2)硅酸盐的表示方法——用氧化物的形式表示
氧化物的顺序:
活泼金属氧化物→较活泼金属氧化物→二氧化硅→水
注意:
①氧化物之间以“ ”隔开;
②系数配置出现分数应化为整数,氧化物前的系数仅代表该氧化物本身;
③实际上硅酸盐不是以简单氧化物形式存在的,而是以种种结构复杂的盐的形式存在的。
用氧化物形式表示硅酸盐的组成
①硅酸钠Na2SiO3 ______________
②硅酸钙CaSiO3______________
③高岭石Al2(Si2O5)(OH)4_____________
④正长石KAlSi3O8___________________
⑤普通玻璃的大致组成_____________________
⑥水泥的主要成分_________________________
⑦黏土的主要成分_________________________
用氧化物形式表示硅酸盐的组成
用氧化物形式表示硅酸盐的组成
Na2O SiO2
CaO SiO2
Al2O3 2SiO2 2H2O
K2O Al2O3 6SiO2
Na2O CaO 6SiO2
3CaO SiO2 、 2CaO SiO2、 3CaO Al2O3
Al2O3 2SiO2 2H2O
硅酸盐
硅酸钠的水溶液俗称______________,可用作肥皂填料、木材防火剂及黏胶剂等。
水玻璃
放入
蒸馏水 放入Na2SiO3
饱和溶液
现象
结论
水分蒸发后就燃烧
水分蒸发后不燃烧
木条、滤纸易燃烧
Na2SiO3可作防火剂
问题探究
土壤胶体是怎样形成的?为什么土壤胶体具有保肥能力?
硅酸盐岩石长期在水的侵蚀下,风化为黏土,并且形成土壤胶体。土壤胶体因其表面积较大且一般带负电,能吸收NH4+、K+等数十种生物所需的营养离子,所以土壤具有保肥能力。
晶体硅为钢灰色,无定形硅为黑色,密度2.4g/cm3,熔点1420℃,沸点2355℃,晶体硅属于原子晶体,硬而有光泽,有半导体性质
单晶硅是一种重要的半导体材料,用于制造大功率晶体管、整流器、太阳能电池等。
双向可控硅
三、硅单质
(1)硅的同素异形体:硅有_____种同素异形体,分别是____________________________。
(2)晶体硅是______色、有___________、_____________的固体。它的结构类似于__________,其熔沸点都很高,硬度______,导电性______________________,是良好的_________
材料,广泛地应用于电子工业。硅是人类将______________转换____________的常用材料。
两
晶体和无定形
灰黑
金属光泽
硬而脆
金刚石
大
界于导体和绝缘体之间
半导体
太阳能
电能
化学性质
Si+2F2=SiF4
Si+4HF=SiF4↑+2H2O
Si+2NaOH+2H2O=Na2SiO3+2H2 ↑
Si+O2===SiO2
加热
Si+2Cl2===SiCl4
加热
