4.2.2《氯离子(Cl-)的检验》PPT课件(新人教版-必修1)
文档属性
| 名称 | 4.2.2《氯离子(Cl-)的检验》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 157.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 00:00:00 | ||
图片预览





文档简介
(共15张PPT)
新课标人教版课件系列
《高中化学》
必修1
4.2.2《氯离子(Cl-)
的检验》
第四章 非金属及其化合物 第二节《活泼的黄绿色气体-氯气 》
教学目标
知识技能:
(1)掌握氯气与水、碱溶液反应的性质。
(2)了解常见漂白剂的漂白原理。
(3)使学生掌握氯离子的检验方法。
过程与方法:通过演示实验使学生掌握氯水的性质;通过指导学生观察、分析演示实验的现象,培养学生观察和分析问题的能力以及总结归纳能力;加强化学知识与日常生活、生产的联系,让学生学会利用化学知识去解决实际问题。
情感态度与价值观:通过教学活动,培养学生将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题作出合理的判断;对学生进行安全和环保教育,增强学生的安全、环保意识。
教学重点与难点:氯水的成分和性质,氯气与碱的反应,氯离子的检验方法。
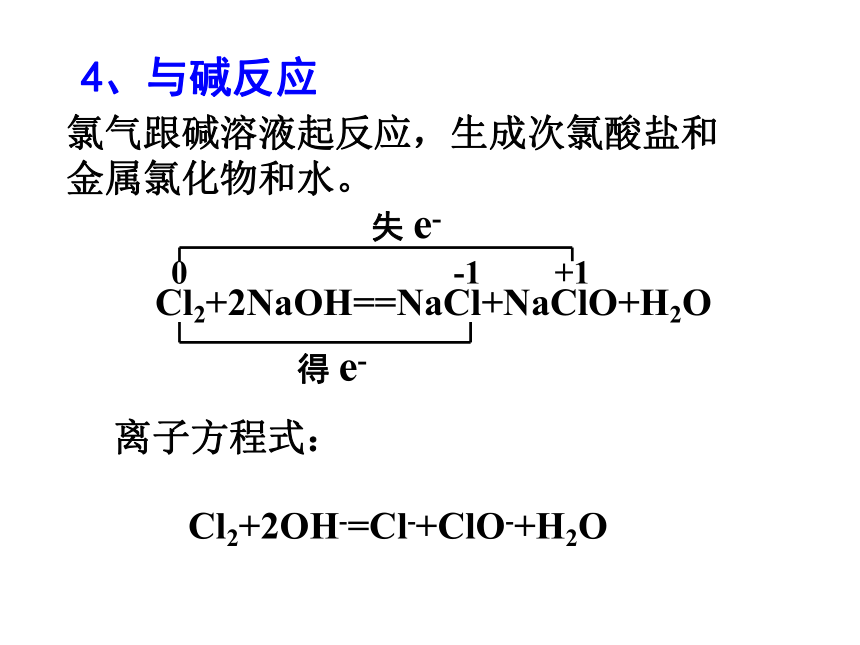
4、与碱反应
Cl2+2NaOH==NaCl+NaClO+H2O
0
-1
+1
失 e-
得 e-
氯气跟碱溶液起反应,生成次氯酸盐和金属氯化物和水。
离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
★漂白粉
● 原理 2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
● 成分: Ca(ClO)2 、CaCl2
● 使用原理:
Ca(ClO)2+CO2+H2O==CaCO3 ↓ + 2HClO ?CO2过量
有效成分 :Ca(ClO)2
通入CO2或加强酸:增大HClO的浓度,增强漂白性
漂白粉要密封保存,防止吸收空气中的CO2而变质
方程式:
Ca(ClO)2 +2HCl== CaCl2 +2HClO
为什么制漂白粉
★、氯气的实验室制法
气体发生
气体净化
气体收集
尾气吸收
装置图形
原理
MnO2 + 4HCl(浓) MnCl2 +Cl2 + 2H2O
离子方程式
MnO2 + 4H+ +2Cl- Mn2+ +Cl2 +2H2O
失2e-
得2e-
MnO2 + 4HCl(浓) MnCl2 +Cl2 + 2H2O
氧化剂:MnO2 还原剂:HCl
使用的盐酸必须是浓的,随着反应的进行,盐酸的浓度降低到一定的程度时,反应自动停止。故,在反应中,浓盐酸中含的HCl不能全部用尽
不能用稀盐酸,稀盐酸与MnO2 不反应 ;
MnO2黑色固体
除杂
所制得的氯气中常含有氯化氢气体和水蒸气,如何除去?
分别用装有饱和氯化钠溶液和浓硫酸的洗气瓶洗气除去
饱和
食盐水
浓
硫酸
收集及验满
向上排空气法或排饱和食盐水法
将湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝,表明已收集满
Cl2+2KI=2KCl+I2
尾气
用氢氧化钠溶液吸收,防止污染空气
Cl2+2NaOH=NaCl+NaClO+H2O
反应原理:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
→
△
反应装置:固+液 气
收集装置:向上排空气法
净化装置:饱和食盐水洗气除去HCl,再用浓硫酸干燥
吸收装置:用强碱液吸收多余的氯气,防止污染空气
浓盐酸
MnO2
饱和食盐水
氢氧化钠溶液
浓硫酸
分液漏斗
圆底烧瓶
关闭分液漏斗的活塞,将导气管插入盛水的水槽中,用酒精灯微热圆底烧瓶,导管口有气泡冒出,停止加热,在导管中形成一段水柱,说明气密性良好
分液漏斗使用时瓶塞上的凹槽
应对准漏斗上的小孔
圆底烧瓶加热时要垫石棉网
下图是实验室制取纯净、干燥氯气的实验装置。
浓盐酸
MnO2
H2O NaOH溶液
请回答:
(1)装置①的烧瓶中发生反应的化学方程式为______________________________。
(2)在③~⑤中,有明显错误的一个装置是_____________(填序号)。
(3)装置③中所盛试剂的名称及其作用是_________________________________。
① ② ③ ④ ⑤
浓盐酸
MnO2
NaOH
溶液
H2O
1、电解饱和食盐水(氯碱工业)
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
氯气的工业制法
2、电解熔融的氯化钠
2NaCl(熔融) 2Na+Cl2↑
实验室快速制氯气
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O
2KMnO4+16HCl(浓) 2KCl+2MnCl2 +5Cl2↑+8H2O
KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
3.其他试剂反应制取氯气
2NaCl +3H2SO4 +MnO2 =2NaHSO4 +MnSO4 +Cl2 +2H2O
★:氯离子的检验
1:试剂:AgNO3溶液,稀HNO3
2:原理:Ag++Cl-=AgCl↓
3:方法:在被测液中先加入HNO3溶液,
再滴加AgNO3溶液,若有白色沉淀出现,则
有Cl-存在。
新课标人教版课件系列
《高中化学》
必修1
4.2.2《氯离子(Cl-)
的检验》
第四章 非金属及其化合物 第二节《活泼的黄绿色气体-氯气 》
教学目标
知识技能:
(1)掌握氯气与水、碱溶液反应的性质。
(2)了解常见漂白剂的漂白原理。
(3)使学生掌握氯离子的检验方法。
过程与方法:通过演示实验使学生掌握氯水的性质;通过指导学生观察、分析演示实验的现象,培养学生观察和分析问题的能力以及总结归纳能力;加强化学知识与日常生活、生产的联系,让学生学会利用化学知识去解决实际问题。
情感态度与价值观:通过教学活动,培养学生将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题作出合理的判断;对学生进行安全和环保教育,增强学生的安全、环保意识。
教学重点与难点:氯水的成分和性质,氯气与碱的反应,氯离子的检验方法。
4、与碱反应
Cl2+2NaOH==NaCl+NaClO+H2O
0
-1
+1
失 e-
得 e-
氯气跟碱溶液起反应,生成次氯酸盐和金属氯化物和水。
离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
★漂白粉
● 原理 2Cl2+2Ca(OH)2==Ca(ClO)2+CaCl2+2H2O
● 成分: Ca(ClO)2 、CaCl2
● 使用原理:
Ca(ClO)2+CO2+H2O==CaCO3 ↓ + 2HClO ?CO2过量
有效成分 :Ca(ClO)2
通入CO2或加强酸:增大HClO的浓度,增强漂白性
漂白粉要密封保存,防止吸收空气中的CO2而变质
方程式:
Ca(ClO)2 +2HCl== CaCl2 +2HClO
为什么制漂白粉
★、氯气的实验室制法
气体发生
气体净化
气体收集
尾气吸收
装置图形
原理
MnO2 + 4HCl(浓) MnCl2 +Cl2 + 2H2O
离子方程式
MnO2 + 4H+ +2Cl- Mn2+ +Cl2 +2H2O
失2e-
得2e-
MnO2 + 4HCl(浓) MnCl2 +Cl2 + 2H2O
氧化剂:MnO2 还原剂:HCl
使用的盐酸必须是浓的,随着反应的进行,盐酸的浓度降低到一定的程度时,反应自动停止。故,在反应中,浓盐酸中含的HCl不能全部用尽
不能用稀盐酸,稀盐酸与MnO2 不反应 ;
MnO2黑色固体
除杂
所制得的氯气中常含有氯化氢气体和水蒸气,如何除去?
分别用装有饱和氯化钠溶液和浓硫酸的洗气瓶洗气除去
饱和
食盐水
浓
硫酸
收集及验满
向上排空气法或排饱和食盐水法
将湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝,表明已收集满
Cl2+2KI=2KCl+I2
尾气
用氢氧化钠溶液吸收,防止污染空气
Cl2+2NaOH=NaCl+NaClO+H2O
反应原理:4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
→
△
反应装置:固+液 气
收集装置:向上排空气法
净化装置:饱和食盐水洗气除去HCl,再用浓硫酸干燥
吸收装置:用强碱液吸收多余的氯气,防止污染空气
浓盐酸
MnO2
饱和食盐水
氢氧化钠溶液
浓硫酸
分液漏斗
圆底烧瓶
关闭分液漏斗的活塞,将导气管插入盛水的水槽中,用酒精灯微热圆底烧瓶,导管口有气泡冒出,停止加热,在导管中形成一段水柱,说明气密性良好
分液漏斗使用时瓶塞上的凹槽
应对准漏斗上的小孔
圆底烧瓶加热时要垫石棉网
下图是实验室制取纯净、干燥氯气的实验装置。
浓盐酸
MnO2
H2O NaOH溶液
请回答:
(1)装置①的烧瓶中发生反应的化学方程式为______________________________。
(2)在③~⑤中,有明显错误的一个装置是_____________(填序号)。
(3)装置③中所盛试剂的名称及其作用是_________________________________。
① ② ③ ④ ⑤
浓盐酸
MnO2
NaOH
溶液
H2O
1、电解饱和食盐水(氯碱工业)
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
氯气的工业制法
2、电解熔融的氯化钠
2NaCl(熔融) 2Na+Cl2↑
实验室快速制氯气
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O
2KMnO4+16HCl(浓) 2KCl+2MnCl2 +5Cl2↑+8H2O
KClO3+6HCl(浓) KCl+3Cl2↑+3H2O
3.其他试剂反应制取氯气
2NaCl +3H2SO4 +MnO2 =2NaHSO4 +MnSO4 +Cl2 +2H2O
★:氯离子的检验
1:试剂:AgNO3溶液,稀HNO3
2:原理:Ag++Cl-=AgCl↓
3:方法:在被测液中先加入HNO3溶液,
再滴加AgNO3溶液,若有白色沉淀出现,则
有Cl-存在。
