4.2《富集在海水中的元素---氯》PPT课件(新人教版-必修1)
文档属性
| 名称 | 4.2《富集在海水中的元素---氯》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 660.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 21:23:40 | ||
图片预览









文档简介
(共60张PPT)
新课标人教版课件系列
《高中化学》
必修1
第四章 非金属及其化合物
第二节
《富集在海水中的
元素---氯 》
教学目标
知识与能力
(1)了解氯气的物理性质:色、味、态、水溶性、毒性 (2)掌握氯气的部分化学性质 (3)掌握氯水中的存在的微粒和性质 (4)掌握次氯酸的不稳定性和强氧化剂,理解它漂白的原理
(5)了解氯气与碱的反应,认识日常使用的漂白粉、漂白剂的主要成分;
(6)了解氯气的实验室制法; 掌握氯离子的检验方法; 简单认识卤素的性质。
〖教学重点〗:
氯气的化学性质
氯气与碱的反应、氯离子的检验方法
〖教学难点〗:
氯气与水的反应
氯气与碱的反应
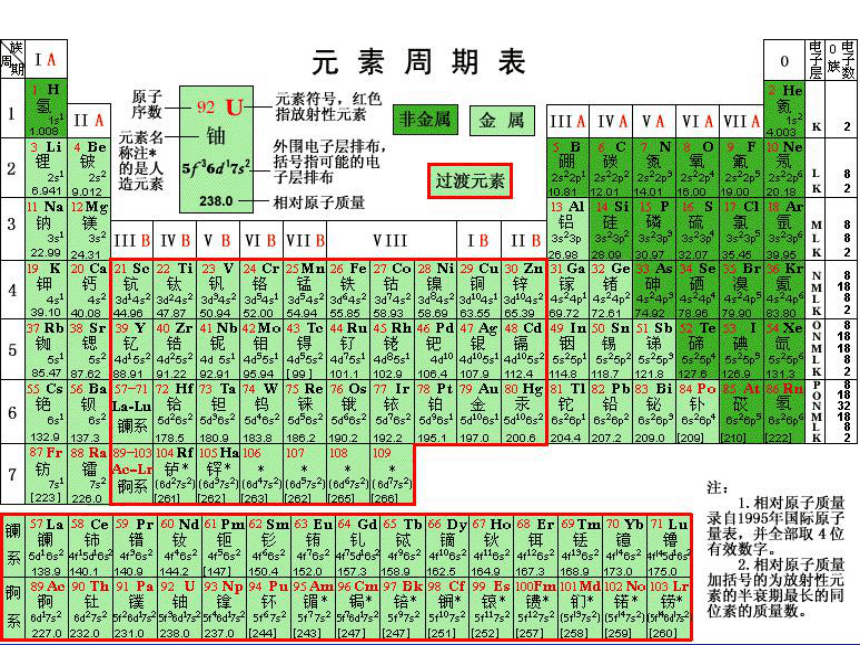
海洋是一个重要的资源宝库,大约有80多种元素蕴藏在湛蓝的海水里。在地壳中氯的含量为0.031%,大部分氯以氯化物的形式存在于表面积为36100万平方公里的海洋里,其总量约为30000万亿吨.
氯是人体所必须的宏量元素之一。人体中氯的含量一般为0.12%,这它主要存在于细胞外液中。缺少了它,人体机能就会失调。我们每天都需要食用食盐(主要成分为氯化钠),原因之一就是要满足人体对氯元素的需要。
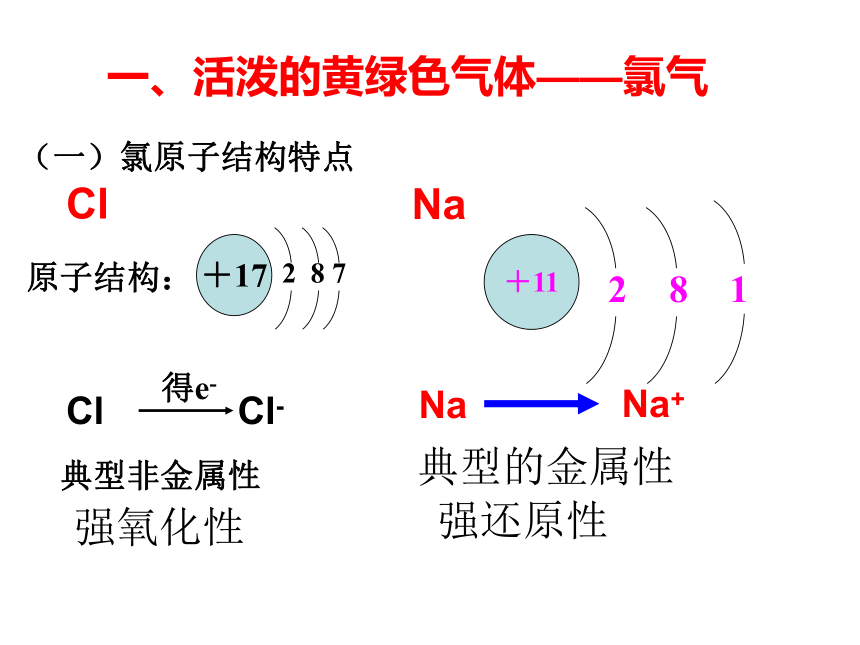
(一)氯原子结构特点
典型非金属性
Cl
得e-
Cl-
一、活泼的黄绿色气体——氯气
原子结构:
+17
2 8 7
强氧化性
+11
1
8
2
Cl
Na
Na
Na+
典型的金属性
强还原性
自然界无游离态的钠
(金属钠——强还原性)
自然界无游离态的氯
(氯气——强氧化性)
在实验室里,氯气可以用浓盐酸与二氧化锰反应来制取
制法原理
氯气的实验室制法
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
请用双线桥法标出电子的转移,
得失以及化合价的升降
1. 是氧化剂, 是还原剂
2.浓盐酸表现出 性和 性
3.氧化剂与还原剂的物质的量之比为
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
请改写成离子方程式
注:
1.MnO2为难溶于水的黑色固体
2.稀盐酸与MnO2不反应
3.反应要加热。
MnO2+4H+ +2Cl- ==Mn2++Cl2↑+2H2O
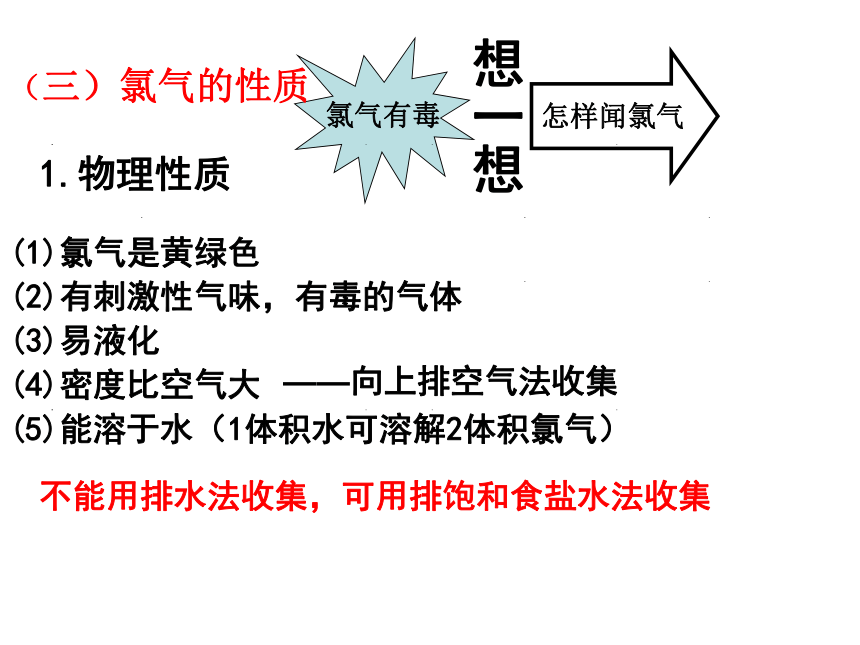
氯气有毒
想一想
怎样闻氯气
(三)氯气的性质
1.物理性质
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)密度比空气大
(5)能溶于水(1体积水可溶解2体积氯气)
——向上排空气法收集
不能用排水法收集,可用排饱和食盐水法收集
闻氯气的方法是:
用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
注意:
这是闻各种气体气味的方法。
若有氯气泄漏,周围的人
往高处走还是往低处走
应顺风走还是逆风走
现象
钠与氯气反应
剧烈燃烧,火焰呈————色,生成————晶体
2Na + Cl2 === 2 NaCl
点燃
白色
黄
(1)氯气与金属反应
2.化学性质
氯气与铜反应
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Cu + Cl2 === CuCl2
点燃
现象
铁与氯气反应
现象
铁丝剧烈燃烧,产生—————色的————
2Fe + 3 Cl2 === 2 FeCl3
点燃
反应规律:生成高价金属的氯化物
棕褐
烟
2.怎样制取FeCl2
1.下列化合物中,不能由氯气和相应的金属直接反应来制取的是
A. FeCl3 B. CaCl2 C. FeCl2 D. KCl
Fe+2HCl FeCl2+H2↑
(C)
H2 + Cl2 === 2HCl
点燃
或光照
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。
实验现象
一定条件(点燃或光照)下氯气能与氢气反应
氢气和氯气的混合气体 光照或点燃后发生爆炸。
(2)氯气与非金属反应
思考与交流
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
燃烧:
燃烧不一定要有氧气参加,
燃烧的本质是氧化还原反应。
任何发光发热的剧烈的化学反应叫做燃烧。
2Na + Cl2
点燃
2Fe + 3Cl2
点燃
Cu + Cl2
点燃
1、氯气与金属反应
复习
2NaCl
2FeCl3
CuCl2
2、氯气与非金属反应
复习
H2 + Cl2 = 2HCl
点燃
思考1:同学们打开自来水时,有没有闻到
一股气味呢 为什么会有这种气味,其中
放了什么呢
什么叫氯水 250C时,一体积水可以溶解
多少体积的氯气 请大家阅读课本84页
自来水厂用氯气杀菌,消毒,闻到的
刺激性气味是余氯的气味
Cl2 + H2O =
HCl + HClO
溶于水中的部分Cl2与水反应
1体积的水能溶解2体积的Cl2
Cl2能溶于水
次氯酸
Cl2 + H2O =
HCl + HClO
做氧化剂, 做还原剂
Cl2既是氧化剂,又是还原剂
Cl2
Cl2
Cl2 + H2O =
HCl + HClO
请将其改写成离子方程式
Cl2 + H2O =2H+ +2Cl- +O2-
Cl2 + H2O =2H+ +Cl- +ClO-
Cl2 + H2O =H+ +Cl- +HClO
次氯酸的性质:
3.强氧化性
漂白作用
1.弱酸性
2.不稳定易分解
光照
2HClO 2HCl+O2↑
可用于自来水的杀菌、消毒,可用做漂白剂。
酸性:H2CO3 >HClO
用于游泳池的消毒
实验探究:
请你设计一个实验验证
具有漂白性的是次氯酸而不是氯气.
结论:1.干燥的氯气没有漂白性
2.湿润的氯气有漂白性,因为氯气
溶于水生成次氯酸.
3.尾气用NaOH溶液吸收
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水
分类
成分
性质
纯净物
混合物
分子:
离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-
分子:H2O
离子:H+,Cl-
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
只有酸性
浓盐酸
MnO2
制氯气的反应装置
除HCl
除H2O
收集Cl2
吸收尾气中
Cl2
随堂练习:
1.自来水可以用氯气消毒,如果实验室
中无蒸馏水,可以用自来水配某些急需
的药品,但有些药品若用自来水配制,则
会明显导致药品变质.下列哪些药品不能
用自来水配制:
A.Na2SO4 B.NaCl
C.AgNO3 D.AlCl3
C
2.下列关于氯水的叙述中正确的是
A.新制氯水中只含有Cl2和H2O分子
B.新制的氯水可使蓝色石蕊试纸先
变红后褪色.
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强.
BD
练习书P104 14
HCl
(起还原作用)
被氧化的HCl
Cl2
化合价升高的Cl
0
-1
HCl
参加反应
Cl2
4
0
-1
A
HCl
2
起还原性
-1
HCl
参加反应
5Cl2
16
0
-1
B
HCl
10
起还原性
-1
HCl
参加反应
Cl2
2
0
-1
D
HCl
2
起还原性
-1
HCl
参加反应
3Cl2
6
0
-1
C
HCl
5
起还原性
-1
KClO3
+5
起氧化性
阅读课本84-85页,氯气与碱的反应
Cl2+ NaOH —
HCl+HClO
NaCl
NaClO
次氯酸钠
-1
(1).氯气与烧碱反应的化学方程式
写出Cl2与烧碱反应的方程式
Cl2+2NaOH = NaCl+NaClO+H2O
标出电子转移的方向和数目
e-
改写成离子方程式
Cl2+2OH- = Cl-+ClO-+H2O
该反应用于制漂白液
有效成分:
NaClO
写出氯气被石灰水吸收的反应方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
有效成分
漂粉精
漂白粉
Cl2+Ca(OH)2 ——
标出电子转移的方向和数目
CaCl2 Ca(ClO)2可溶于水吗?
2e-
漂粉精的漂白原理:
Ca(ClO)2
该反应可证明
H2CO3
—CaCO3↓+2HClO
H2CO3 HClO
酸性:
Ca(ClO)2+CO2+H2O —
练习书P100 左上
漂粉精可用于游泳池的消毒
为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定
怎样保存漂白粉?
密封存放于避光干燥处
练习书P100 左
练习书P100 考题8
[讨论]若你的周围不幸发生氯气泄漏事故,你该怎样处理?
防毒的方法与途径:
用碱液吸收
实验室制Cl2时,尾气中的Cl2应怎样处理
NaOH溶液
Ca(OH)2溶液
2004年4月重庆天原
化工总厂氯气泄漏事故
2004年4月重庆天原化工总厂氯气泄漏事故中消防战士正在调制碱水喷洒液
当周围有大量Cl2逸出时,可用含有某种物质的水溶液的毛巾捂住鼻子,该物质最好是:
A、NaOH B、NaCl
C、Ca(OH)2 D、Na2CO3
D
1、用Cl2消毒的自来水配制下列溶液,不会引起药品变质的是( )
A NaCl B AgNO3 C NaOH D Ca(OH)2
2、下列物质中,不能使有色布条褪色的是 ( )
A NaClO溶液 B Ca(ClO)2 溶液
C 氯水 D CaCl2溶液
A
D
练习:
3.氯气的用途
(3)处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物。
(1)SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗(半导体)和金属钛的重要中间物质;
(2)合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料;
制氯气的反应装置
浓盐酸
MnO2
除HCl
除H2O
收集Cl2
吸收尾气中
Cl2
二、氯离子(Cl-)的检验
实验现象
解释或离子方程式
加入AgNO3溶液后 加入
稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Cl- + Ag+ =AgCl↓
Cl- + Ag+ =AgCl↓
白色沉淀
沉淀不消失
Ag2CO3+2H+=2Ag++CO2↑ + H2O
白色沉淀
无现象
无现象
检验Cl-时,为什么滴加AgNO3
溶液后还要再加稀硝酸呢?
因为 AgNO3溶液除可以与Cl-形成AgCl白色沉淀外,还可以与CO32-形成Ag2CO3白色沉淀,但AgCl不与稀硝酸反应; 而Ag2CO3可与稀硝酸反应,沉淀可溶解。
阅读课本P86 表格下
氯离子检验的一般步骤:
[小结]
②待测液
加稀硝酸
加硝酸银溶液
白色沉淀
①待测液
加稀硝酸
加硝酸银溶液
白色沉淀
阅读课本86页的科学视野
成盐元素-卤素
卤素
氟原子
氯原子
溴原子
碘原子
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,所以统称为卤素(成盐元素之意)。
②都是典型的非金属元素;
卤素单质氧化性的比较:
随元素原子核电荷数的增大,原子半径增大,得电子能力减弱,故氧化性减弱
氧化性:F2 Cl2 Br2 I2
F
Cl
Br
I
碘化银(AgⅠ)被用于人工降雨
作业:课本87页第三题和
88页12题
新课标人教版课件系列
《高中化学》
必修1
第四章 非金属及其化合物
第二节
《富集在海水中的
元素---氯 》
教学目标
知识与能力
(1)了解氯气的物理性质:色、味、态、水溶性、毒性 (2)掌握氯气的部分化学性质 (3)掌握氯水中的存在的微粒和性质 (4)掌握次氯酸的不稳定性和强氧化剂,理解它漂白的原理
(5)了解氯气与碱的反应,认识日常使用的漂白粉、漂白剂的主要成分;
(6)了解氯气的实验室制法; 掌握氯离子的检验方法; 简单认识卤素的性质。
〖教学重点〗:
氯气的化学性质
氯气与碱的反应、氯离子的检验方法
〖教学难点〗:
氯气与水的反应
氯气与碱的反应
海洋是一个重要的资源宝库,大约有80多种元素蕴藏在湛蓝的海水里。在地壳中氯的含量为0.031%,大部分氯以氯化物的形式存在于表面积为36100万平方公里的海洋里,其总量约为30000万亿吨.
氯是人体所必须的宏量元素之一。人体中氯的含量一般为0.12%,这它主要存在于细胞外液中。缺少了它,人体机能就会失调。我们每天都需要食用食盐(主要成分为氯化钠),原因之一就是要满足人体对氯元素的需要。
(一)氯原子结构特点
典型非金属性
Cl
得e-
Cl-
一、活泼的黄绿色气体——氯气
原子结构:
+17
2 8 7
强氧化性
+11
1
8
2
Cl
Na
Na
Na+
典型的金属性
强还原性
自然界无游离态的钠
(金属钠——强还原性)
自然界无游离态的氯
(氯气——强氧化性)
在实验室里,氯气可以用浓盐酸与二氧化锰反应来制取
制法原理
氯气的实验室制法
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
请用双线桥法标出电子的转移,
得失以及化合价的升降
1. 是氧化剂, 是还原剂
2.浓盐酸表现出 性和 性
3.氧化剂与还原剂的物质的量之比为
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
请改写成离子方程式
注:
1.MnO2为难溶于水的黑色固体
2.稀盐酸与MnO2不反应
3.反应要加热。
MnO2+4H+ +2Cl- ==Mn2++Cl2↑+2H2O
氯气有毒
想一想
怎样闻氯气
(三)氯气的性质
1.物理性质
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)密度比空气大
(5)能溶于水(1体积水可溶解2体积氯气)
——向上排空气法收集
不能用排水法收集,可用排饱和食盐水法收集
闻氯气的方法是:
用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。
注意:
这是闻各种气体气味的方法。
若有氯气泄漏,周围的人
往高处走还是往低处走
应顺风走还是逆风走
现象
钠与氯气反应
剧烈燃烧,火焰呈————色,生成————晶体
2Na + Cl2 === 2 NaCl
点燃
白色
黄
(1)氯气与金属反应
2.化学性质
氯气与铜反应
铜丝在氯气里剧烈燃烧,产生棕黄色的烟,产物溶于水后,溶液呈蓝绿色。
Cu + Cl2 === CuCl2
点燃
现象
铁与氯气反应
现象
铁丝剧烈燃烧,产生—————色的————
2Fe + 3 Cl2 === 2 FeCl3
点燃
反应规律:生成高价金属的氯化物
棕褐
烟
2.怎样制取FeCl2
1.下列化合物中,不能由氯气和相应的金属直接反应来制取的是
A. FeCl3 B. CaCl2 C. FeCl2 D. KCl
Fe+2HCl FeCl2+H2↑
(C)
H2 + Cl2 === 2HCl
点燃
或光照
纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。
实验现象
一定条件(点燃或光照)下氯气能与氢气反应
氢气和氯气的混合气体 光照或点燃后发生爆炸。
(2)氯气与非金属反应
思考与交流
通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识
燃烧:
燃烧不一定要有氧气参加,
燃烧的本质是氧化还原反应。
任何发光发热的剧烈的化学反应叫做燃烧。
2Na + Cl2
点燃
2Fe + 3Cl2
点燃
Cu + Cl2
点燃
1、氯气与金属反应
复习
2NaCl
2FeCl3
CuCl2
2、氯气与非金属反应
复习
H2 + Cl2 = 2HCl
点燃
思考1:同学们打开自来水时,有没有闻到
一股气味呢 为什么会有这种气味,其中
放了什么呢
什么叫氯水 250C时,一体积水可以溶解
多少体积的氯气 请大家阅读课本84页
自来水厂用氯气杀菌,消毒,闻到的
刺激性气味是余氯的气味
Cl2 + H2O =
HCl + HClO
溶于水中的部分Cl2与水反应
1体积的水能溶解2体积的Cl2
Cl2能溶于水
次氯酸
Cl2 + H2O =
HCl + HClO
做氧化剂, 做还原剂
Cl2既是氧化剂,又是还原剂
Cl2
Cl2
Cl2 + H2O =
HCl + HClO
请将其改写成离子方程式
Cl2 + H2O =2H+ +2Cl- +O2-
Cl2 + H2O =2H+ +Cl- +ClO-
Cl2 + H2O =H+ +Cl- +HClO
次氯酸的性质:
3.强氧化性
漂白作用
1.弱酸性
2.不稳定易分解
光照
2HClO 2HCl+O2↑
可用于自来水的杀菌、消毒,可用做漂白剂。
酸性:H2CO3 >HClO
用于游泳池的消毒
实验探究:
请你设计一个实验验证
具有漂白性的是次氯酸而不是氯气.
结论:1.干燥的氯气没有漂白性
2.湿润的氯气有漂白性,因为氯气
溶于水生成次氯酸.
3.尾气用NaOH溶液吸收
液氯与氯水的区别?新制氯水与久置氯水的区别?
液氯 氯水
分类
成分
性质
纯净物
混合物
分子:
离子:
Cl2 ,HClO,H2O
H+,Cl-,ClO-
分子:H2O
离子:H+,Cl-
新制
有氧化性,无酸性和漂白性
有酸性,强氧化性,能漂白,消毒,光照时HClO分解
久置
只有Cl2
实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中
只有酸性
浓盐酸
MnO2
制氯气的反应装置
除HCl
除H2O
收集Cl2
吸收尾气中
Cl2
随堂练习:
1.自来水可以用氯气消毒,如果实验室
中无蒸馏水,可以用自来水配某些急需
的药品,但有些药品若用自来水配制,则
会明显导致药品变质.下列哪些药品不能
用自来水配制:
A.Na2SO4 B.NaCl
C.AgNO3 D.AlCl3
C
2.下列关于氯水的叙述中正确的是
A.新制氯水中只含有Cl2和H2O分子
B.新制的氯水可使蓝色石蕊试纸先
变红后褪色.
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性增强.
BD
练习书P104 14
HCl
(起还原作用)
被氧化的HCl
Cl2
化合价升高的Cl
0
-1
HCl
参加反应
Cl2
4
0
-1
A
HCl
2
起还原性
-1
HCl
参加反应
5Cl2
16
0
-1
B
HCl
10
起还原性
-1
HCl
参加反应
Cl2
2
0
-1
D
HCl
2
起还原性
-1
HCl
参加反应
3Cl2
6
0
-1
C
HCl
5
起还原性
-1
KClO3
+5
起氧化性
阅读课本84-85页,氯气与碱的反应
Cl2+ NaOH —
HCl+HClO
NaCl
NaClO
次氯酸钠
-1
(1).氯气与烧碱反应的化学方程式
写出Cl2与烧碱反应的方程式
Cl2+2NaOH = NaCl+NaClO+H2O
标出电子转移的方向和数目
e-
改写成离子方程式
Cl2+2OH- = Cl-+ClO-+H2O
该反应用于制漂白液
有效成分:
NaClO
写出氯气被石灰水吸收的反应方程式
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
有效成分
漂粉精
漂白粉
Cl2+Ca(OH)2 ——
标出电子转移的方向和数目
CaCl2 Ca(ClO)2可溶于水吗?
2e-
漂粉精的漂白原理:
Ca(ClO)2
该反应可证明
H2CO3
—CaCO3↓+2HClO
H2CO3 HClO
酸性:
Ca(ClO)2+CO2+H2O —
练习书P100 左上
漂粉精可用于游泳池的消毒
为什么不直接用次氯酸作漂白剂?
次氯酸不稳定,次氯酸盐较稳定
怎样保存漂白粉?
密封存放于避光干燥处
练习书P100 左
练习书P100 考题8
[讨论]若你的周围不幸发生氯气泄漏事故,你该怎样处理?
防毒的方法与途径:
用碱液吸收
实验室制Cl2时,尾气中的Cl2应怎样处理
NaOH溶液
Ca(OH)2溶液
2004年4月重庆天原
化工总厂氯气泄漏事故
2004年4月重庆天原化工总厂氯气泄漏事故中消防战士正在调制碱水喷洒液
当周围有大量Cl2逸出时,可用含有某种物质的水溶液的毛巾捂住鼻子,该物质最好是:
A、NaOH B、NaCl
C、Ca(OH)2 D、Na2CO3
D
1、用Cl2消毒的自来水配制下列溶液,不会引起药品变质的是( )
A NaCl B AgNO3 C NaOH D Ca(OH)2
2、下列物质中,不能使有色布条褪色的是 ( )
A NaClO溶液 B Ca(ClO)2 溶液
C 氯水 D CaCl2溶液
A
D
练习:
3.氯气的用途
(3)处理工业废水,将具有还原性的有毒物质硫化氢、氰化物等氧化成无毒物。
(1)SiCl4、GeCl4、TiCl4分别是制取高纯硅、锗(半导体)和金属钛的重要中间物质;
(2)合成塑料、橡胶、人造纤维、农药、染料和药品的重要原料;
制氯气的反应装置
浓盐酸
MnO2
除HCl
除H2O
收集Cl2
吸收尾气中
Cl2
二、氯离子(Cl-)的检验
实验现象
解释或离子方程式
加入AgNO3溶液后 加入
稀硝酸后
稀盐酸
NaCl溶液
Na2CO3溶液
自来水
蒸馏水
白色沉淀
白色沉淀
沉淀消失,有气泡生成
沉淀不消失
沉淀不消失
Cl- + Ag+ =AgCl↓
CO32- +2Ag+ =Ag2CO3↓
Cl- + Ag+ =AgCl↓
Cl- + Ag+ =AgCl↓
白色沉淀
沉淀不消失
Ag2CO3+2H+=2Ag++CO2↑ + H2O
白色沉淀
无现象
无现象
检验Cl-时,为什么滴加AgNO3
溶液后还要再加稀硝酸呢?
因为 AgNO3溶液除可以与Cl-形成AgCl白色沉淀外,还可以与CO32-形成Ag2CO3白色沉淀,但AgCl不与稀硝酸反应; 而Ag2CO3可与稀硝酸反应,沉淀可溶解。
阅读课本P86 表格下
氯离子检验的一般步骤:
[小结]
②待测液
加稀硝酸
加硝酸银溶液
白色沉淀
①待测液
加稀硝酸
加硝酸银溶液
白色沉淀
阅读课本86页的科学视野
成盐元素-卤素
卤素
氟原子
氯原子
溴原子
碘原子
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,所以统称为卤素(成盐元素之意)。
②都是典型的非金属元素;
卤素单质氧化性的比较:
随元素原子核电荷数的增大,原子半径增大,得电子能力减弱,故氧化性减弱
氧化性:F2 Cl2 Br2 I2
F
Cl
Br
I
碘化银(AgⅠ)被用于人工降雨
作业:课本87页第三题和
88页12题
