4.3.2《二氧化氮和一氧化氮以及环境保护》PPT课件(新人教版-必修1)
文档属性
| 名称 | 4.3.2《二氧化氮和一氧化氮以及环境保护》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 348.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-05-31 21:26:20 | ||
图片预览






文档简介
(共17张PPT)
新课标人教版课件系列
《高中化学》
必修1
4.3.2
《二氧化氮和一氧化氮
以及环境保护》
第四章 非金属及其化合物 第三节《硫和氮的氧化物 》
教学目标
知识与能力
1、初步掌握一氧化氮和二氧化氮的重要性质。
2、了解酸雨的形成和危害;
3、通过实践活动认识保护环境的重要性,增强环保意识。
4、培养学生观察能力、自学能力及资料、信息处理及科学抽象能力;对学生进行内因与外因辩证统一的教育。
重点、难点:
一氧化氮和二氧化氮的性质;观察能力和自学能力的培养;科学抽象的方法。
二、二氧化氮和一氧化氮
阅读【科学视野】
思考:氮气在通常状况下会变成NOX吗?
1、自然固氮
N2 + O2 = 2NO
放电(或高温)
思考:大气中是否有NO存在呢?
2、NO和NO2的性质
(1)化学性质
2NO+O2=2 NO2
3NO2+H2O=2HNO3+NO
(2)物理性质
NO是无色、不溶于水、密度比空气略大的气体。
NO2是一种红棕色、有刺激性气味的有毒气体,密度比空气的大,易液化,易溶于水。
实验:现在给你设计实验,要求尽可能多地使NO2被水吸收。
1 将一支充满NO2的试管倒立在盛有水的水槽中
2
3
红棕色气体逐渐消失,水位上升,最后充满试管的2/3,无色气体充满试管上部的1/3 3NO2+H2O=2HNO3+NO
2H2O2=2H2O+2O2↑
无色气体变为红棕色气体,又变为无色气体,气体体积减少,液面不断上升 2NO+O2=2 NO2
3NO2+H2O=2HNO3+NO
制取少量的氧气
将氧气慢慢的通入步骤1的试管中
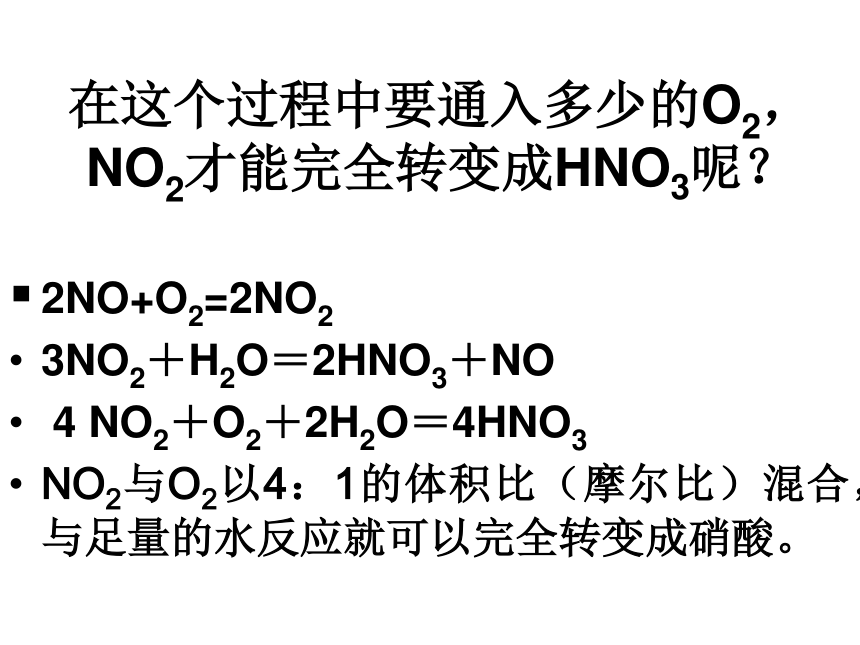
在这个过程中要通入多少的O2, NO2才能完全转变成HNO3呢?
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
4 NO2+O2+2H2O=4HNO3
NO2与O2以4:1的体积比(摩尔比)混合,与足量的水反应就可以完全转变成硝酸。
假如是NO和O2混合呢?当体积比是多少的时候跟足量的水反应才能完全转变成硝酸呢?
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
4NO+3O2+2H2O=4HNO3
【思考和交流】
引起酸雨的罪魁祸首是谁?
硫和氮的氧化物的主要来源是什么呢?
结合P80的图,你是否能够描述出酸雨形成的简单过程吗?
酸雨究竟有什么危害呢?
如何来防止酸雨的影响呢?
首要污染物有二氧化硫、二氧化氮、可吸入颗粒物
三、SO2和NO2对大气的污染
1、硫氧化物主要来自含硫矿物的燃烧,氮氧化物来自汽车尾气。
2、酸雨的形成过程:
3、酸雨的危害P80
4、防治酸雨的方法P81
S
SO2
SO3
H2SO4
硫酸型酸雨:
1、马斯河谷烟雾事件(1930年12月),原因是SOx和MnO微粒作用生成SO2--SO3进入人体。
2、多诺拉烟雾事件(1948年10月),原因是SO2和烟尘作用生成硫酸盐,吸入人体肺部。
3、伦敦烟雾事件(1952年12月),原因是粉尘中Fe2O3使SO2反应生成硫酸铁附在粉尘上,吸入人体肺部。
4、洛衫机光化学烟雾事件(1943年5--9月),原因是石油工业和汽车废气在紫外线作用下生成光化学烟雾。
新课标人教版课件系列
《高中化学》
必修1
4.3.2
《二氧化氮和一氧化氮
以及环境保护》
第四章 非金属及其化合物 第三节《硫和氮的氧化物 》
教学目标
知识与能力
1、初步掌握一氧化氮和二氧化氮的重要性质。
2、了解酸雨的形成和危害;
3、通过实践活动认识保护环境的重要性,增强环保意识。
4、培养学生观察能力、自学能力及资料、信息处理及科学抽象能力;对学生进行内因与外因辩证统一的教育。
重点、难点:
一氧化氮和二氧化氮的性质;观察能力和自学能力的培养;科学抽象的方法。
二、二氧化氮和一氧化氮
阅读【科学视野】
思考:氮气在通常状况下会变成NOX吗?
1、自然固氮
N2 + O2 = 2NO
放电(或高温)
思考:大气中是否有NO存在呢?
2、NO和NO2的性质
(1)化学性质
2NO+O2=2 NO2
3NO2+H2O=2HNO3+NO
(2)物理性质
NO是无色、不溶于水、密度比空气略大的气体。
NO2是一种红棕色、有刺激性气味的有毒气体,密度比空气的大,易液化,易溶于水。
实验:现在给你设计实验,要求尽可能多地使NO2被水吸收。
1 将一支充满NO2的试管倒立在盛有水的水槽中
2
3
红棕色气体逐渐消失,水位上升,最后充满试管的2/3,无色气体充满试管上部的1/3 3NO2+H2O=2HNO3+NO
2H2O2=2H2O+2O2↑
无色气体变为红棕色气体,又变为无色气体,气体体积减少,液面不断上升 2NO+O2=2 NO2
3NO2+H2O=2HNO3+NO
制取少量的氧气
将氧气慢慢的通入步骤1的试管中
在这个过程中要通入多少的O2, NO2才能完全转变成HNO3呢?
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
4 NO2+O2+2H2O=4HNO3
NO2与O2以4:1的体积比(摩尔比)混合,与足量的水反应就可以完全转变成硝酸。
假如是NO和O2混合呢?当体积比是多少的时候跟足量的水反应才能完全转变成硝酸呢?
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
4NO+3O2+2H2O=4HNO3
【思考和交流】
引起酸雨的罪魁祸首是谁?
硫和氮的氧化物的主要来源是什么呢?
结合P80的图,你是否能够描述出酸雨形成的简单过程吗?
酸雨究竟有什么危害呢?
如何来防止酸雨的影响呢?
首要污染物有二氧化硫、二氧化氮、可吸入颗粒物
三、SO2和NO2对大气的污染
1、硫氧化物主要来自含硫矿物的燃烧,氮氧化物来自汽车尾气。
2、酸雨的形成过程:
3、酸雨的危害P80
4、防治酸雨的方法P81
S
SO2
SO3
H2SO4
硫酸型酸雨:
1、马斯河谷烟雾事件(1930年12月),原因是SOx和MnO微粒作用生成SO2--SO3进入人体。
2、多诺拉烟雾事件(1948年10月),原因是SO2和烟尘作用生成硫酸盐,吸入人体肺部。
3、伦敦烟雾事件(1952年12月),原因是粉尘中Fe2O3使SO2反应生成硫酸铁附在粉尘上,吸入人体肺部。
4、洛衫机光化学烟雾事件(1943年5--9月),原因是石油工业和汽车废气在紫外线作用下生成光化学烟雾。
