专题3 第二单元 金属钠及钠的化合物 第4课时 离子反应的应用
文档属性
| 名称 | 专题3 第二单元 金属钠及钠的化合物 第4课时 离子反应的应用 |

|
|
| 格式 | docx | ||
| 文件大小 | 468.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-11 20:43:04 | ||
图片预览




文档简介
第4课时 离子反应的应用
[核心素养发展目标]
1.掌握常见离子(Cl-、SO、CO)的检验方法。
2.能正确判断离子共存。
3.能用离子反应理解Na2CO3、NaHCO3与酸反应的定量关系。
一、常见离子的检验
待检离子
使用试剂
反应现象
反应的离子方程式
Cl-
AgNO3溶液、稀硝酸
加入AgNO3溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解
Cl-+Ag+===AgCl↓
SO
BaCl2溶液、稀盐酸
加足量稀盐酸无现象,再加BaCl2溶液产生白色沉淀
Ba2++SO===BaSO4↓
CO
CaCl2溶液、稀盐酸
加入CaCl2溶液产生白色沉淀,再加入稀盐酸沉淀溶解,产生能使澄清石灰水变浑浊的无色无味气体
Ca2++CO===CaCO3↓
CaCO3+2H+===Ca2++CO2↑+H2O
(1)检测溶液中的Cl-时,可先加盐酸,再加AgNO3溶液( )
(2)某溶液加入BaCl2溶液,产生白色沉淀,说明溶液中一定含有SO( )
(3)加入稀盐酸,产生无色无味的气泡,溶液中可能存在CO,也可能存在HCO( )
(4)溶液中加入Na2CO3产生白色沉淀,再加稀盐酸,沉淀消失,一定存在Ba2+( )
答案 (1)× (2)× (3)√ (4)×
1.检验Cl-时,加入稀HNO3目的是什么?
提示 加入稀HNO3的目的为排除CO等离子干扰。
2.为什么在检验SO时,先加足量稀盐酸,后加BaCl2溶液,顺序能颠倒吗?
提示 加入足量的稀盐酸,是防止Ag+、CO等干扰,若先加BaCl2,如有Ag+,会生成AgCl白色沉淀,干扰SO检验,不能颠倒顺序。
3.某混合溶液中含有Cl-和SO,请设计实验证实,并写出相应的离子方程式。
提示 取待测液少许于试管中,加入足量稀HNO3酸化,再加入足量的Ba(NO3)2溶液,若产生白色沉淀,则溶液中含有SO,再取上层清液于试管中,加入AgNO3溶液,若产生白色沉淀,则证明溶液中含有Cl-。离子方程式:Ba2++SO===BaSO4↓,Ag++Cl-===AgCl↓。
(1)CO与Ag+结合也能生成白色沉淀,干扰Cl-的检验,加稀硝酸可排除CO的干扰。
(2)与BaCl2反应产生白色沉淀而干扰SO检验的离子有Ag+、CO、SO等,所以先加稀盐酸排除干扰离子,若有Ag+则生成沉淀,若含CO、SO则生成气体。
(3)为了防止其他离子的干扰,一定要注意滴加试剂的先后顺序。
相关链接 离子检验试题答题模板
(1)取样:(若为固体样品)取某固体样品少许,溶于水配成溶液,取溶液少许于试管中。
(若为液体样品)取溶液少许于试管中。
(2)操作:加入××××溶液(或物质)。
(3)现象:看到有××色气体生成(或××色沉淀产生)等。
(4)结论:证明有(或无)××离子存在。
二、离子共存的判断
1.离子共存判断的“一个原则”
离子共存判断实际是看离子之间能否反应,若反应,则不共存,若不反应,则能共存。
2.离子共存判断的“三种类型”
(1)离子之间反应生成沉淀:如图连线的两离子之间。
(2)离子之间反应生成气体:如图连线的两离子之间。
(3)离子之间反应生成水或其他难电离的物质:如图连线的两离子之间。
3.离子共存判断的“两个隐含条件”
(1)“无色透明”溶液不存在有色离子。
Cu2+ Fe3+ Fe2+ MnO
│ │ │ │
蓝色 棕黄色 浅绿色 紫红色
(2)溶液的酸碱性
(1)在强酸性溶液中,CH3COO-可以大量存在( )
(2)含大量Ca2+的溶液中,SO可以大量存在( )
(3)在溶液中与Ag+能共存的常见阴离子只有NO( )
(4)无色透明溶液中,一定不存在Cu2+、Fe3+、MnO等( )
(5)强酸性溶液中,一定不能大量存在CO、HCO、S2-、OH-等( )
(6)滴入酚酞溶液显红色的溶液中,K+、Na+、Cu2+、SO不能大量共存( )
答案 (1)× (2)× (3)√ (4)√ (5)√ (6)√
离子大量共存判断“三注意”
(1)在判断离子共存时,应特别注意题中的隐含条件,如“酸性环境”“碱性环境”“无色”“指示剂变色”等。
(2)“一定”即在任何条件下都可以,如酸性、碱性条件下都能符合题意。
(3)“可能”即有一个条件下共存即可,如酸性或碱性一个条件下共存即符合题意。
(2019·湖北仙桃中学期末)某河道两旁有甲、乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-、NO六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、________。
(2)乙厂的废水中含有另外三种离子,如果向其中加入一定量的________(填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属________(填元素符号)。
(3)若将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________转化为沉淀,过滤后的废水主要含有________(填化学式),可用来浇灌农田。
答案 (1)OH- Cl- K+ (2)铁粉 Ag
(3)Ag+、Fe3+、Cl-、OH- KNO3
解析 甲厂的废水呈碱性,一定含有OH-,与OH-可以共存的离子有K+、Cl-、NO,由于Ag+与Cl-不能大量共存,所以甲厂废水中含有OH-、K+和Cl-,则乙厂废水中含有Ag+、Fe3+、NO,在乙厂的废水中加入一定量的铁粉可得到Ag。将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,生成沉淀的离子有Ag+、Fe3+、Cl-、OH-,过滤后的废水中主要含有KNO3。
三、碳酸盐、碳酸氢盐的离子反应
1.碳酸钠与盐酸的反应
(1)在Na2CO3溶液中逐滴加入稀盐酸的现象为开始无气泡,一段时间后产生气泡。
写出过程中的离子方程式:CO+H+===HCO、HCO+H+===CO2↑+H2O。
(2)在盐酸中滴入Na2CO3溶液,现象为立即产生气泡。
离子方程式:CO+2H+===CO2↑+H2O。
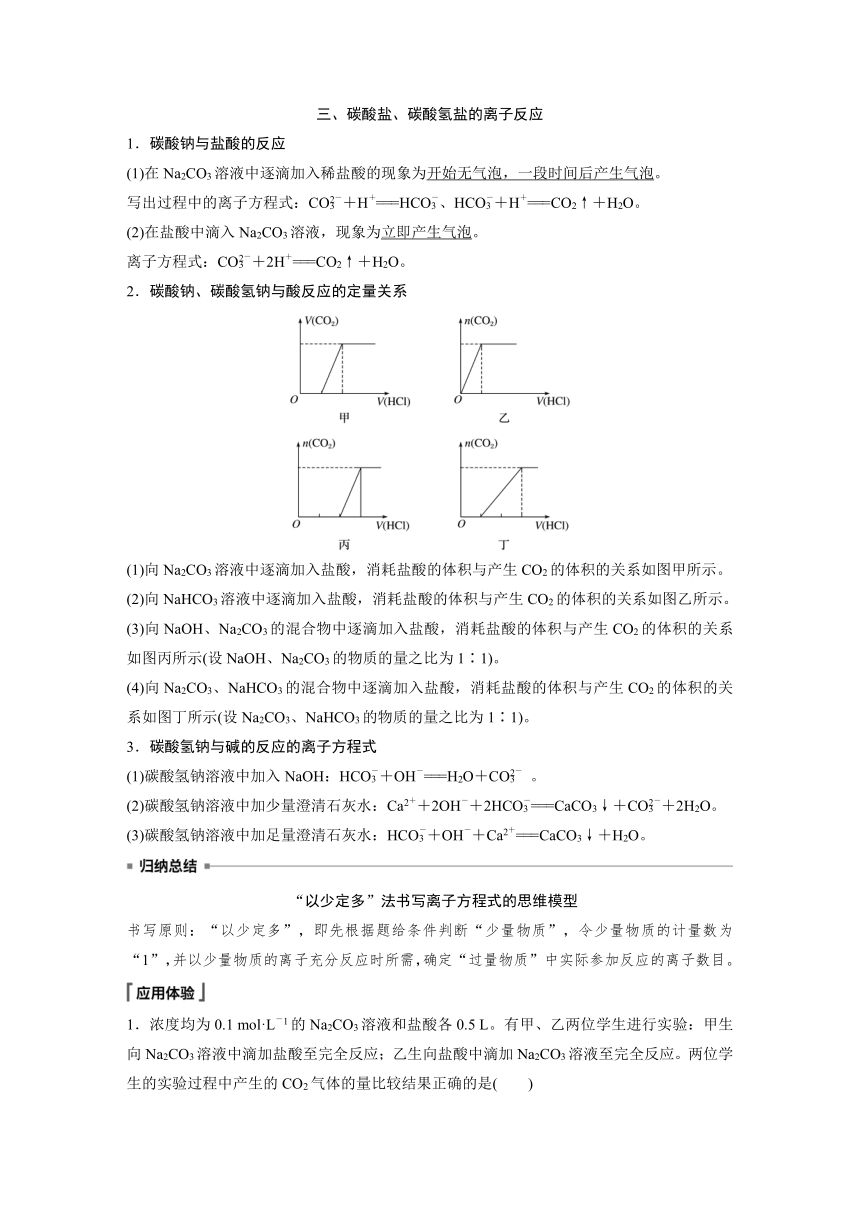
2.碳酸钠、碳酸氢钠与酸反应的定量关系
(1)向Na2CO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图甲所示。
(2)向NaHCO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图乙所示。
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图丙所示(设NaOH、Na2CO3的物质的量之比为1∶1)。
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图丁所示(设Na2CO3、NaHCO3的物质的量之比为1∶1)。
3.碳酸氢钠与碱的反应的离子方程式
(1)碳酸氢钠溶液中加入NaOH:HCO+OH-===H2O+CO 。
(2)碳酸氢钠溶液中加少量澄清石灰水:Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O。
(3)碳酸氢钠溶液中加足量澄清石灰水:HCO+OH-+Ca2+===CaCO3↓+H2O。
“以少定多”法书写离子方程式的思维模型
书写原则:“以少定多”,即先根据题给条件判断“少量物质”,令少量物质的计量数为“1”,并以少量物质的离子充分反应时所需,确定“过量物质”中实际参加反应的离子数目。
1.浓度均为0.1 mol·L-1的Na2CO3溶液和盐酸各0.5 L。有甲、乙两位学生进行实验:甲生向Na2CO3溶液中滴加盐酸至完全反应;乙生向盐酸中滴加Na2CO3溶液至完全反应。两位学生的实验过程中产生的CO2气体的量比较结果正确的是( )
A.甲>乙 B.甲<乙
C.甲=乙 D.无法确定
答案 B
解析 Na2CO3与HCl反应分两步进行:Na2CO3+HCl===NaCl+NaHCO3;NaHCO3+HCl ===NaCl+CO2↑+H2O。甲生操作结果几乎得不到CO2,乙生操作中由于开始时盐酸过量可产生部分CO2。
2.(2019·广东仲元中学高一期中)下列离子方程式书写正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:
HCO+Ca2++OH-===CaCO3↓+H2O
B.Cu粉溶于FeCl3溶液:Fe3++Cu===Fe2++Cu2+
C.氧化钙与稀盐酸反应:2H++O2-===H2O
D.用稀盐酸除去水垢中的氢氧化镁:
Mg(OH)2+2H+===Mg2++2H2O
答案 D
解析 石灰水与过量碳酸氢钠溶液反应,氢氧化钙不足,Ca2+与OH-按照1∶2的组成比反应,正确的离子方程式为2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O,故A错误;铜粉溶于FeCl3溶液,离子方程式为Cu+2Fe3+===Cu2++2Fe2+,故B错误;氧化钙与稀盐酸反应的离子方程式中,氧化钙应写化学式,故C错误;盐酸与水垢中的氢氧化镁反应生成氯化镁和水,该反应的离子方程式为Mg(OH)2+2H+===Mg2++2H2O,故D正确。
考点 离子方程式
题点 离子方程式正误判断
1.(2019·哈尔滨校级期中)下列物质的检验所选用的试剂正确的是( )
A.CO—NaOH溶液
B.Cl-—硝酸酸化的AgNO3溶液
C.SO—BaCl2溶液
D.H+—酚酞溶液
答案 B
解析 CO与NaOH不反应,A项错误;Cl-与Ag+反应生成不溶于硝酸的AgCl沉淀,B项正确;检验SO时,只加入BaCl2溶液不能排除CO等离子的干扰,先加入稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀,证明含有SO,C项错误;酸溶液中加入酚酞溶液无现象,应加入紫色石蕊溶液鉴别,D项错误。
考点 离子反应的应用
题点 离子检验试剂选择
2.(2019·河南实验中学月考)对于溶液中某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
答案 C
解析 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,溶液中可能含有HCO、CO、SO、HSO等离子,故A错误;加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,生成的沉淀也可能是AgCl,溶液中可能含有Cl-或SO,故B错误;加入足量稀盐酸无现象,可排除Ag+的干扰,再加入氯化钡溶液后有白色沉淀产生,说明含有SO,故C正确;加入碳酸钠溶液产生白色沉淀,再加入盐酸沉淀消失,溶液中可能含有Ca2+或Ba2+,故D错误。
考点 离子反应的应用
题点 常见离子的检验
3.(2019·西安高新一中期末)在溶液中能大量共存,加入OH-后有沉淀析出的一组离子是( )
A.Na+、H+、NO、Cl-
B.K+、H+、Cl-、SO
C.Cu2+、NO、SO、Cl-
D.Ca2+、NH、CO、Cl-
答案 C
解析 A、B项,加入OH-不会产生沉淀;D项,Ca2+与CO不能大量共存;C项,四种离子可以共存,加入OH-后发生反应Cu2++2OH-===Cu(OH)2↓。
考点 离子反应的应用
题点 题干限制条件的离子共存判断
4.(2020·济南一中调研)下列离子组在指定溶液中一定能大量共存的是( )
A.使pH试纸呈蓝色的溶液中:I-、Cl-、NO、Cu2+
B.使酚酞呈深红色的溶液中:Na+、Cl-、H+、NO
C.含大量Ag+的溶液中:K+、Na+、NO、SO
D.含大量OH-的溶液中:CO、Cl-、F-、K+
答案 D
解析 使pH试纸呈蓝色的溶液为碱性溶液,铜离子不能大量存在;使酚酞呈深红色的溶液为碱性溶液,氢离子不能大量存在;含大量Ag+的溶液中不能大量存在硫酸根离子。
考点 离子反应的应用
题点 选项限制条件的离子共存判断
5.下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2的过程。
(1)写出a点以前发生反应的化学方程式:_________________________________________。
(2)写出a到b点发生反应的化学方程式:__________________________________________。
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于________mol(用含字母m的代数式表示)。
答案 (1)Na2CO3+HCl===NaHCO3+NaCl (2)NaHCO3+HCl===NaCl+CO2↑+H2O (3)
解析 (1)a点前无CO2产生,说明盐酸只把Na2CO3转化成NaHCO3;化学方程式为Na2CO3+HCl===NaHCO3+NaCl。(2)b点开始,再加入盐酸也不会产生CO2气体,说明NaHCO3已全部转化成NaCl、CO2和H2O,化学方程式为NaHCO3+HCl===NaCl+CO2↑+H2O。(3)由条件说明部分NaHCO3转化为NaCl、CO2和H2O。假设第二步反应消耗的HCl的物质的量为n mol,则:
Na2CO3+HCl===NaCl+NaHCO3
m m m m
NaHCO3+HCl===NaCl+CO2↑+H2O
n n n
这时,溶液中的HCO的物质的量为(m-n) mol,Cl-的物质的量为(m+n) mol。由题意得:(m+n)∶(m-n)=2∶1,解得n= mol。则n(HCl)=n(Cl-)=(m+n) mol=(m+) mol= mol。
A组 基础对点练
题组一 离子共存的判断
1.(2019·辽宁省实验中学高一期中)下列各组溶液中离子,能在溶液中大量共存的是( )
A.OH-、Ca2+、NO、SO
B.Ca2+、HCO、Cl-、K+
C.NH、Ag+、NO、I-
D.K+、OH-、Cl-、HCO
答案 B
解析 Ca2+、SO发生反应,生成难溶于水的CaSO3,所以不能大量共存,A错误;Ca2+、HCO、Cl-、K+之间不发生反应,所以可以大量共存,B正确;Ag+、I-发生反应,生成难溶于水的AgI,所以不能大量共存,C错误;OH-、HCO反应生成水和碳酸根离子,所以不能大量共存,D错误。
考点 离子反应应用
题点 无限制条件的离子共存判断
2.(2019·云南玉溪一中期中)下列各组离子能大量共存且加入稀硫酸有气体产生的是( )
A.Na+、Ag+、CO、Cl-
B.K+、Ba2+、SO、Cl-
C.Na+、K+、CO、Cl-
D.Na+、K+、Cl-、SO
答案 C
解析 A项,Ag+与CO、Cl-不能大量共存;B项,Ba2+与SO不能大量共存;D项,四种离子能大量共存,但加入稀硫酸时无气体生成。
考点 离子反应应用
题点 题干有限制条件的离子共存判断
3.(2019·江西临川一中期末)实验室中有一瓶失去标签的试剂,已知该试剂中只含四种离子,且试剂中四种离子的浓度均为0.1 mol·L-1,则该试剂中含有的四种离子可能是( )
A.Fe2+、Na+、NO、Cl-
B.Mg2+、NH、SO、NO
C.H+、K+、Cl-、CO
D.K+、Ca2+、CO、OH-
答案 B
解析 A项,溶液中的正、负电荷不能相互抵消,即溶液不呈电中性;C项,H+与CO不能大量共存;D项,Ca2+与CO、OH-不能大量共存。
考点 离子反应应用
题点 题干有限制条件的离子共存判断
4.加入NaOH溶液后,下列溶液中的离子数目不会减少的是( )
A.Cu2+ B.Fe3+ C.SO D.H+
答案 C
解析 凡是能与OH-反应的离子,其数目均要减少,Cu2+、Fe3+、H+均可以与OH-反应;而SO不与OH-反应,离子数目不会减少。
5.(2019·重庆石宝中学月考)在给定条件的水溶液中能大量共存的离子组是( )
A.透明的溶液:Fe3+、K+、NO、Cl-
B.含有NaHCO3的溶液:SO、OH-、K+、CO
C.使酚酞溶液呈红色的溶液:Mg2+、Ba2+、NO、K+
D.c(H+)=1 mol·L-1的溶液:K+、Na+、Cl-、OH-
答案 A
解析 Fe3+、K+、NO、Cl-相互之间不反应,能大量共存,故A正确;HCO与OH-不能大量共存,故B错误;使酚酞溶液呈红色的溶液呈碱性,Mg2+和OH-不能大量共存,故C错误;c(H+)=1 mol·L-1的溶液呈酸性,OH-不能大量存在,故D错误。
考点 离子反应应用
题点 选项有限制条件的离子共存判断
题组二 离子的检验与推断
6.有4瓶常用溶液:①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
A.①④③② B.①④②③
C.①③④② D.④①②③
答案 D
解析 解此类问题的一般方法是先根据待鉴别的溶液颜色确定出一种溶液,由已确定的溶液作试剂,再去进一步鉴别其他物质。由于④CuSO4溶液呈蓝色,故可最先通过观察得出,用CuSO4溶液作试剂,分别加到其他三种溶液中,只有BaCl2生成白色沉淀,故第二个鉴别出来的是①BaCl2溶液,然后再用BaCl2溶液作试剂,可鉴别出③Na2SO4溶液和②NaCl溶液,故其检出顺序为④①③②或④①②③。
7.实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂一次就把它们区别开了,这种试剂是( )
A.盐酸 B.氢氧化钠溶液
C.硝酸钡溶液 D.硝酸
答案 A
解析 稀盐酸与Na2CO3溶液反应放出CO2气体,与NaCl溶液不反应,与AgNO3溶液反应生成AgCl白色沉淀。
8.(2019·宁波高一期末)某溶液X中可能含有下列离子中的若干种Cl-、SO、CO、Na+、Mg2+、Cu2+。为了确定该溶液的组成,取一定体积的上述溶液,进行了如下实验。下列说法正确的是( )
A.白色沉淀1一定是硫酸钡
B.溶液X中存在Na+、SO、CO
C.溶液X中可能存在Mg2+,一定不存在Cu2+
D.向溶液2中滴入硝酸银溶液,若生成白色沉淀,说明溶液X中含有Cl-
答案 B
解析 白色沉淀1为碳酸钡、硫酸钡混合物,A错误;根据实验分析可知溶液X中存在Na+、SO、CO,B正确;含有碳酸根离子,则一定不含Mg2+,二者不能共存,C错误;因加入盐酸,引入氯离子,不能确定溶液X中是否含有氯离子,D错误。
考点 离子反应应用
题点 离子及物质推断
题组三 有关碳酸盐的离子反应
9.相同条件下,等物质的量Na2CO3和NaHCO3固体分别与相同浓度的过量稀盐酸反应,下列叙述正确的是( )
A.两者放出的CO2一样多
B.Na2CO3放出的CO2多
C.NaHCO3消耗的盐酸多
D.Na2CO3反应剧烈
答案 A
解析 根据碳元素守恒,等物质的量Na2CO3和NaHCO3放出二氧化碳的物质的量相等,故A正确;根据A选项分析,两者放出的二氧化碳一样多,故B错误;由化学方程式:Na2CO3+2HCl===2NaCl+H2O+CO2↑,NaHCO3+HCl===NaCl+H2O+CO2↑,碳酸钠消耗的盐酸多,故C错误;碳酸氢钠与盐酸反应比碳酸钠与盐酸反应剧烈,故D错误。
10.将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴滴加稀盐酸,下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
答案 C
解析 假设氢氧化钠和碳酸钠的物质的量都为1 mol,将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴加入盐酸,1 mol氢氧化钠消耗1 mol盐酸反应生成氯化钠和水,没有现象,然后1 mol碳酸钠和1 mol盐酸反应生成1 mol碳酸氢钠和氯化钠,1 mol碳酸氢钠再和1 mol盐酸反应生成氯化钠、水和1 mol二氧化碳。
B组 综合强化练
1~4题是单项选择题,5~6题是不定项选择题
1.向等物质的量NaOH、Na2CO3的混合溶液中,逐滴加稀盐酸至过量。不可能发生的离子方程式是( )
A.OH-+H+===H2O
B.CO+2H+===CO2↑+H2O
C.OH-+CO+2H+===HCO+H2O
D.OH-+CO+3H+===CO2↑+2H2O
答案 B
解析 向等物质的量NaOH、Na2CO3的混合溶液中,逐滴加入盐酸至过量,依次发生反应NaOH+HCl===NaCl+H2O、Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+CO2↑+H2O,所以不可能发生的反应是CO+2H+===CO2↑+H2O,故选B。
2.已知某溶液中含有Mg2+、Ba2+、Ag+和NO,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中的三种阳离子逐一完全沉淀分离,其流程如图所示。下列说法正确的是( )
A.试剂A可能为NaOH溶液
B.沉淀2只能是BaCO3,不可能是Mg(OH)2
C.每加一种试剂需过量但不需要过滤即可进行下一步
D.生成沉淀1的离子方程式只能是Ag++Cl-===AgCl↓
答案 D
解析 由流程图可知,溶液中含有Ba2+、Mg2+、Ag+,应先加入NaCl溶液除去Ag+,生成的沉淀1为AgCl,过滤后溶液1中加入的试剂B为NaOH溶液,得到的沉淀2为Mg(OH)2,溶液2中加入的试剂C为Na2CO3溶液,得到的沉淀3为BaCO3。试剂A不可能为NaOH溶液,Ag+和Mg2+均与OH-反应产生沉淀,故A项错误;沉淀2是Mg(OH)2,故B项错误;除杂时,为了除尽杂质离子,所加除杂试剂必须过量,由于实验目的是将三种阳离子逐一沉淀分离,所以每步均需过滤后再进行下一步操作,故C项错误;生成沉淀1的离子方程式只能是Ag++Cl-===AgCl↓,故D项正确。
3.(2019·云南玉溪一中高一期中)下列各组离子一定能大量共存的是( )
A.在无色溶液中:Na+、Fe3+、Cl-、SO
B.在含大量Fe3+的溶液中:NH、K+、NO、OH-
C.在强碱溶液中:Na+、K+、NO、CO
D.滴加紫色石蕊溶液显红色的溶液中:K+、Fe2+、Cl-、CO
答案 C
考点 离子反应应用
题点 选项有限制条件的离子共存判断
4.某混合溶液中所含离子的浓度如表所示,则M可能为( )
离子
NO
SO
H+
M
浓度/mol·L-1
2
1
2
1
A.Cl- B.Ba2+ C.Na+ D.Mg2+
答案 D
解析 设M所带电荷数为x,根据溶液呈电中性可得2×1+1×2=2×1+x×1,得x=2,因此M应该带2个单位的正电荷。由于SO与Ba2+能够反应生成沉淀,即不能大量共存,所以M可能为Mg2+。
【考点】 离子共存
【题点】 离子共存的相关综合
5.(2019·广东佛山一中高一段考)在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中共存的是( )
A.含有大量SO的溶液:加入Mg2+、Cu2+、Cl-、NO
B.滴加酚酞变红的溶液:加入SO、Cu2+、K+、Cl-
C.所含溶质为NaHSO4的溶液:加入K+、Cl-、NO、Na+
D.常温下,加入铁粉能生成H2的溶液:加入Na+、Ca2+、Cl-、HCO
答案 AC
解析 含有大量SO的溶液中,SO、Mg2+、Cu2+、Cl-、NO各离子之间不反应,能大量共存,A正确;滴加酚酞变红的溶液呈碱性,碱性条件下Cu2+不能大量存在,B错误;常温下,加入铁粉能生成H2的溶液呈酸性,酸性条件下HCO不能大量存在,D错误。
考点 离子反应应用
题点 离子及物质推断
6.(2019·天津和平区联考)某100 mL溶液可能含有Na+、NH、Fe3+、CO、SO、Cl-中的若干种,取该溶液进行连续实验,实验过程如下所示(所加试剂均过量,气体全部逸出)。下列说法不正确的是( )
A.原溶液一定存在CO和SO,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1 mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1 mol·L-1
答案 D
解析 加入氯化钡溶液,生成沉淀,则溶液中可能含有碳酸根离子或硫酸根离子,沉淀可能为BaSO4或BaCO3,沉淀部分溶解于盐酸,所以沉淀一定是BaSO4、BaCO3的混合物,原溶液中一定存在CO、SO,硫酸钡沉淀是2.33 g,物质的量是2.33 g÷233 g·mol-1=0.01 mol,碳酸根离子的物质的量是(4.30 g-2.33 g)÷197 g·mol-1=0.01 mol,碳酸根和铁离子不共存,一定不存在Fe3+, 所得到的滤液中加入氢氧化钠,产生气体,为氨气,原溶液中一定含有铵根离子,根据元素守恒,铵根离子的物质的量是1.12 L÷22.4 L·mol-1=0.05 mol。阳离子所带正电荷的物质的量之和为0.05 mol,阴离子所带负电荷的物质的量之和为0.01 mol×2+0.01 mol×2=0.04 mol,所以根据电荷守恒,一定存在氯离子。钠离子不能确定,则n(Cl-)
≥0.01 mol,所以c(Cl-)≥0.1 mol·L-1。原溶液一定存在NH、CO、SO和Cl-,一定不存在Fe3+,A项正确;原溶液一定存在Cl-,可能存在Na+,B项正确;原溶液中c(Cl-)≥
0.1 mol·L-1,C项正确;若原溶液中不存在Na+,则c(Cl-)=0.1 mol·L-1,D项错误。
考点 离子反应应用
题点 电荷守恒在离子检验中的应用
7.(2020·开封质检)某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是__________________。
(3)取(2)中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有____________,有关的离子方程式为_______________________________________________。
(4)原溶液可能大量共存的阴离子是________(填字母)。
A.Cl- B.NO C.CO D.OH-
答案 (1)Cu2+、Fe3+ (2)Ag+
(3)Mg2+ Mg2++2OH-===Mg(OH)2↓ (4)B
解析 (1)无色透明溶液中不可能含有Cu2+、Fe3+等有色离子。(2)加盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+。(3)溶液中加氢氧化钠溶液有白色沉淀出现,肯定含有Mg2+。(4)原溶液中由于含有Ag+和Mg2+,阴离子中不可能含有Cl-、CO、OH-,可能含NO。
[核心素养发展目标]
1.掌握常见离子(Cl-、SO、CO)的检验方法。
2.能正确判断离子共存。
3.能用离子反应理解Na2CO3、NaHCO3与酸反应的定量关系。
一、常见离子的检验
待检离子
使用试剂
反应现象
反应的离子方程式
Cl-
AgNO3溶液、稀硝酸
加入AgNO3溶液,产生白色沉淀,再加稀硝酸,沉淀不溶解
Cl-+Ag+===AgCl↓
SO
BaCl2溶液、稀盐酸
加足量稀盐酸无现象,再加BaCl2溶液产生白色沉淀
Ba2++SO===BaSO4↓
CO
CaCl2溶液、稀盐酸
加入CaCl2溶液产生白色沉淀,再加入稀盐酸沉淀溶解,产生能使澄清石灰水变浑浊的无色无味气体
Ca2++CO===CaCO3↓
CaCO3+2H+===Ca2++CO2↑+H2O
(1)检测溶液中的Cl-时,可先加盐酸,再加AgNO3溶液( )
(2)某溶液加入BaCl2溶液,产生白色沉淀,说明溶液中一定含有SO( )
(3)加入稀盐酸,产生无色无味的气泡,溶液中可能存在CO,也可能存在HCO( )
(4)溶液中加入Na2CO3产生白色沉淀,再加稀盐酸,沉淀消失,一定存在Ba2+( )
答案 (1)× (2)× (3)√ (4)×
1.检验Cl-时,加入稀HNO3目的是什么?
提示 加入稀HNO3的目的为排除CO等离子干扰。
2.为什么在检验SO时,先加足量稀盐酸,后加BaCl2溶液,顺序能颠倒吗?
提示 加入足量的稀盐酸,是防止Ag+、CO等干扰,若先加BaCl2,如有Ag+,会生成AgCl白色沉淀,干扰SO检验,不能颠倒顺序。
3.某混合溶液中含有Cl-和SO,请设计实验证实,并写出相应的离子方程式。
提示 取待测液少许于试管中,加入足量稀HNO3酸化,再加入足量的Ba(NO3)2溶液,若产生白色沉淀,则溶液中含有SO,再取上层清液于试管中,加入AgNO3溶液,若产生白色沉淀,则证明溶液中含有Cl-。离子方程式:Ba2++SO===BaSO4↓,Ag++Cl-===AgCl↓。
(1)CO与Ag+结合也能生成白色沉淀,干扰Cl-的检验,加稀硝酸可排除CO的干扰。
(2)与BaCl2反应产生白色沉淀而干扰SO检验的离子有Ag+、CO、SO等,所以先加稀盐酸排除干扰离子,若有Ag+则生成沉淀,若含CO、SO则生成气体。
(3)为了防止其他离子的干扰,一定要注意滴加试剂的先后顺序。
相关链接 离子检验试题答题模板
(1)取样:(若为固体样品)取某固体样品少许,溶于水配成溶液,取溶液少许于试管中。
(若为液体样品)取溶液少许于试管中。
(2)操作:加入××××溶液(或物质)。
(3)现象:看到有××色气体生成(或××色沉淀产生)等。
(4)结论:证明有(或无)××离子存在。
二、离子共存的判断
1.离子共存判断的“一个原则”
离子共存判断实际是看离子之间能否反应,若反应,则不共存,若不反应,则能共存。
2.离子共存判断的“三种类型”
(1)离子之间反应生成沉淀:如图连线的两离子之间。
(2)离子之间反应生成气体:如图连线的两离子之间。
(3)离子之间反应生成水或其他难电离的物质:如图连线的两离子之间。
3.离子共存判断的“两个隐含条件”
(1)“无色透明”溶液不存在有色离子。
Cu2+ Fe3+ Fe2+ MnO
│ │ │ │
蓝色 棕黄色 浅绿色 紫红色
(2)溶液的酸碱性
(1)在强酸性溶液中,CH3COO-可以大量存在( )
(2)含大量Ca2+的溶液中,SO可以大量存在( )
(3)在溶液中与Ag+能共存的常见阴离子只有NO( )
(4)无色透明溶液中,一定不存在Cu2+、Fe3+、MnO等( )
(5)强酸性溶液中,一定不能大量存在CO、HCO、S2-、OH-等( )
(6)滴入酚酞溶液显红色的溶液中,K+、Na+、Cu2+、SO不能大量共存( )
答案 (1)× (2)× (3)√ (4)√ (5)√ (6)√
离子大量共存判断“三注意”
(1)在判断离子共存时,应特别注意题中的隐含条件,如“酸性环境”“碱性环境”“无色”“指示剂变色”等。
(2)“一定”即在任何条件下都可以,如酸性、碱性条件下都能符合题意。
(3)“可能”即有一个条件下共存即可,如酸性或碱性一个条件下共存即符合题意。
(2019·湖北仙桃中学期末)某河道两旁有甲、乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl-、OH-、NO六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、________。
(2)乙厂的废水中含有另外三种离子,如果向其中加入一定量的________(填“活性炭”“硫酸亚铁”或“铁粉”),可以回收其中的金属________(填元素符号)。
(3)若将甲厂和乙厂的废水按适当的比例混合,可以使废水中的__________转化为沉淀,过滤后的废水主要含有________(填化学式),可用来浇灌农田。
答案 (1)OH- Cl- K+ (2)铁粉 Ag
(3)Ag+、Fe3+、Cl-、OH- KNO3
解析 甲厂的废水呈碱性,一定含有OH-,与OH-可以共存的离子有K+、Cl-、NO,由于Ag+与Cl-不能大量共存,所以甲厂废水中含有OH-、K+和Cl-,则乙厂废水中含有Ag+、Fe3+、NO,在乙厂的废水中加入一定量的铁粉可得到Ag。将甲厂和乙厂的废水按适当的比例混合,可生成AgCl、Fe(OH)3沉淀,生成沉淀的离子有Ag+、Fe3+、Cl-、OH-,过滤后的废水中主要含有KNO3。
三、碳酸盐、碳酸氢盐的离子反应
1.碳酸钠与盐酸的反应
(1)在Na2CO3溶液中逐滴加入稀盐酸的现象为开始无气泡,一段时间后产生气泡。
写出过程中的离子方程式:CO+H+===HCO、HCO+H+===CO2↑+H2O。
(2)在盐酸中滴入Na2CO3溶液,现象为立即产生气泡。
离子方程式:CO+2H+===CO2↑+H2O。
2.碳酸钠、碳酸氢钠与酸反应的定量关系
(1)向Na2CO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图甲所示。
(2)向NaHCO3溶液中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图乙所示。
(3)向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图丙所示(设NaOH、Na2CO3的物质的量之比为1∶1)。
(4)向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗盐酸的体积与产生CO2的体积的关系如图丁所示(设Na2CO3、NaHCO3的物质的量之比为1∶1)。
3.碳酸氢钠与碱的反应的离子方程式
(1)碳酸氢钠溶液中加入NaOH:HCO+OH-===H2O+CO 。
(2)碳酸氢钠溶液中加少量澄清石灰水:Ca2++2OH-+2HCO===CaCO3↓+CO+2H2O。
(3)碳酸氢钠溶液中加足量澄清石灰水:HCO+OH-+Ca2+===CaCO3↓+H2O。
“以少定多”法书写离子方程式的思维模型
书写原则:“以少定多”,即先根据题给条件判断“少量物质”,令少量物质的计量数为“1”,并以少量物质的离子充分反应时所需,确定“过量物质”中实际参加反应的离子数目。
1.浓度均为0.1 mol·L-1的Na2CO3溶液和盐酸各0.5 L。有甲、乙两位学生进行实验:甲生向Na2CO3溶液中滴加盐酸至完全反应;乙生向盐酸中滴加Na2CO3溶液至完全反应。两位学生的实验过程中产生的CO2气体的量比较结果正确的是( )
A.甲>乙 B.甲<乙
C.甲=乙 D.无法确定
答案 B
解析 Na2CO3与HCl反应分两步进行:Na2CO3+HCl===NaCl+NaHCO3;NaHCO3+HCl ===NaCl+CO2↑+H2O。甲生操作结果几乎得不到CO2,乙生操作中由于开始时盐酸过量可产生部分CO2。
2.(2019·广东仲元中学高一期中)下列离子方程式书写正确的是( )
A.澄清石灰水与过量碳酸氢钠溶液反应:
HCO+Ca2++OH-===CaCO3↓+H2O
B.Cu粉溶于FeCl3溶液:Fe3++Cu===Fe2++Cu2+
C.氧化钙与稀盐酸反应:2H++O2-===H2O
D.用稀盐酸除去水垢中的氢氧化镁:
Mg(OH)2+2H+===Mg2++2H2O
答案 D
解析 石灰水与过量碳酸氢钠溶液反应,氢氧化钙不足,Ca2+与OH-按照1∶2的组成比反应,正确的离子方程式为2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O,故A错误;铜粉溶于FeCl3溶液,离子方程式为Cu+2Fe3+===Cu2++2Fe2+,故B错误;氧化钙与稀盐酸反应的离子方程式中,氧化钙应写化学式,故C错误;盐酸与水垢中的氢氧化镁反应生成氯化镁和水,该反应的离子方程式为Mg(OH)2+2H+===Mg2++2H2O,故D正确。
考点 离子方程式
题点 离子方程式正误判断
1.(2019·哈尔滨校级期中)下列物质的检验所选用的试剂正确的是( )
A.CO—NaOH溶液
B.Cl-—硝酸酸化的AgNO3溶液
C.SO—BaCl2溶液
D.H+—酚酞溶液
答案 B
解析 CO与NaOH不反应,A项错误;Cl-与Ag+反应生成不溶于硝酸的AgCl沉淀,B项正确;检验SO时,只加入BaCl2溶液不能排除CO等离子的干扰,先加入稀盐酸,无明显现象,再滴加BaCl2溶液,产生白色沉淀,证明含有SO,C项错误;酸溶液中加入酚酞溶液无现象,应加入紫色石蕊溶液鉴别,D项错误。
考点 离子反应的应用
题点 离子检验试剂选择
2.(2019·河南实验中学月考)对于溶液中某些离子的检验及结论一定正确的是( )
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO
C.加入足量稀盐酸,再加入氯化钡溶液后有白色沉淀产生,一定有SO
D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+
答案 C
解析 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,溶液中可能含有HCO、CO、SO、HSO等离子,故A错误;加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,生成的沉淀也可能是AgCl,溶液中可能含有Cl-或SO,故B错误;加入足量稀盐酸无现象,可排除Ag+的干扰,再加入氯化钡溶液后有白色沉淀产生,说明含有SO,故C正确;加入碳酸钠溶液产生白色沉淀,再加入盐酸沉淀消失,溶液中可能含有Ca2+或Ba2+,故D错误。
考点 离子反应的应用
题点 常见离子的检验
3.(2019·西安高新一中期末)在溶液中能大量共存,加入OH-后有沉淀析出的一组离子是( )
A.Na+、H+、NO、Cl-
B.K+、H+、Cl-、SO
C.Cu2+、NO、SO、Cl-
D.Ca2+、NH、CO、Cl-
答案 C
解析 A、B项,加入OH-不会产生沉淀;D项,Ca2+与CO不能大量共存;C项,四种离子可以共存,加入OH-后发生反应Cu2++2OH-===Cu(OH)2↓。
考点 离子反应的应用
题点 题干限制条件的离子共存判断
4.(2020·济南一中调研)下列离子组在指定溶液中一定能大量共存的是( )
A.使pH试纸呈蓝色的溶液中:I-、Cl-、NO、Cu2+
B.使酚酞呈深红色的溶液中:Na+、Cl-、H+、NO
C.含大量Ag+的溶液中:K+、Na+、NO、SO
D.含大量OH-的溶液中:CO、Cl-、F-、K+
答案 D
解析 使pH试纸呈蓝色的溶液为碱性溶液,铜离子不能大量存在;使酚酞呈深红色的溶液为碱性溶液,氢离子不能大量存在;含大量Ag+的溶液中不能大量存在硫酸根离子。
考点 离子反应的应用
题点 选项限制条件的离子共存判断
5.下图表示的是向Na2CO3溶液中滴入稀盐酸时产生CO2的过程。
(1)写出a点以前发生反应的化学方程式:_________________________________________。
(2)写出a到b点发生反应的化学方程式:__________________________________________。
(3)若某Na2CO3溶液中含m mol Na2CO3,向其中滴入一定量的稀盐酸,恰好使溶液中Cl-和HCO的物质的量浓度之比为2∶1,则滴入的稀盐酸中的HCl的物质的量等于________mol(用含字母m的代数式表示)。
答案 (1)Na2CO3+HCl===NaHCO3+NaCl (2)NaHCO3+HCl===NaCl+CO2↑+H2O (3)
解析 (1)a点前无CO2产生,说明盐酸只把Na2CO3转化成NaHCO3;化学方程式为Na2CO3+HCl===NaHCO3+NaCl。(2)b点开始,再加入盐酸也不会产生CO2气体,说明NaHCO3已全部转化成NaCl、CO2和H2O,化学方程式为NaHCO3+HCl===NaCl+CO2↑+H2O。(3)由条件说明部分NaHCO3转化为NaCl、CO2和H2O。假设第二步反应消耗的HCl的物质的量为n mol,则:
Na2CO3+HCl===NaCl+NaHCO3
m m m m
NaHCO3+HCl===NaCl+CO2↑+H2O
n n n
这时,溶液中的HCO的物质的量为(m-n) mol,Cl-的物质的量为(m+n) mol。由题意得:(m+n)∶(m-n)=2∶1,解得n= mol。则n(HCl)=n(Cl-)=(m+n) mol=(m+) mol= mol。
A组 基础对点练
题组一 离子共存的判断
1.(2019·辽宁省实验中学高一期中)下列各组溶液中离子,能在溶液中大量共存的是( )
A.OH-、Ca2+、NO、SO
B.Ca2+、HCO、Cl-、K+
C.NH、Ag+、NO、I-
D.K+、OH-、Cl-、HCO
答案 B
解析 Ca2+、SO发生反应,生成难溶于水的CaSO3,所以不能大量共存,A错误;Ca2+、HCO、Cl-、K+之间不发生反应,所以可以大量共存,B正确;Ag+、I-发生反应,生成难溶于水的AgI,所以不能大量共存,C错误;OH-、HCO反应生成水和碳酸根离子,所以不能大量共存,D错误。
考点 离子反应应用
题点 无限制条件的离子共存判断
2.(2019·云南玉溪一中期中)下列各组离子能大量共存且加入稀硫酸有气体产生的是( )
A.Na+、Ag+、CO、Cl-
B.K+、Ba2+、SO、Cl-
C.Na+、K+、CO、Cl-
D.Na+、K+、Cl-、SO
答案 C
解析 A项,Ag+与CO、Cl-不能大量共存;B项,Ba2+与SO不能大量共存;D项,四种离子能大量共存,但加入稀硫酸时无气体生成。
考点 离子反应应用
题点 题干有限制条件的离子共存判断
3.(2019·江西临川一中期末)实验室中有一瓶失去标签的试剂,已知该试剂中只含四种离子,且试剂中四种离子的浓度均为0.1 mol·L-1,则该试剂中含有的四种离子可能是( )
A.Fe2+、Na+、NO、Cl-
B.Mg2+、NH、SO、NO
C.H+、K+、Cl-、CO
D.K+、Ca2+、CO、OH-
答案 B
解析 A项,溶液中的正、负电荷不能相互抵消,即溶液不呈电中性;C项,H+与CO不能大量共存;D项,Ca2+与CO、OH-不能大量共存。
考点 离子反应应用
题点 题干有限制条件的离子共存判断
4.加入NaOH溶液后,下列溶液中的离子数目不会减少的是( )
A.Cu2+ B.Fe3+ C.SO D.H+
答案 C
解析 凡是能与OH-反应的离子,其数目均要减少,Cu2+、Fe3+、H+均可以与OH-反应;而SO不与OH-反应,离子数目不会减少。
5.(2019·重庆石宝中学月考)在给定条件的水溶液中能大量共存的离子组是( )
A.透明的溶液:Fe3+、K+、NO、Cl-
B.含有NaHCO3的溶液:SO、OH-、K+、CO
C.使酚酞溶液呈红色的溶液:Mg2+、Ba2+、NO、K+
D.c(H+)=1 mol·L-1的溶液:K+、Na+、Cl-、OH-
答案 A
解析 Fe3+、K+、NO、Cl-相互之间不反应,能大量共存,故A正确;HCO与OH-不能大量共存,故B错误;使酚酞溶液呈红色的溶液呈碱性,Mg2+和OH-不能大量共存,故C错误;c(H+)=1 mol·L-1的溶液呈酸性,OH-不能大量存在,故D错误。
考点 离子反应应用
题点 选项有限制条件的离子共存判断
题组二 离子的检验与推断
6.有4瓶常用溶液:①BaCl2溶液 ②NaCl溶液 ③Na2SO4溶液 ④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
A.①④③② B.①④②③
C.①③④② D.④①②③
答案 D
解析 解此类问题的一般方法是先根据待鉴别的溶液颜色确定出一种溶液,由已确定的溶液作试剂,再去进一步鉴别其他物质。由于④CuSO4溶液呈蓝色,故可最先通过观察得出,用CuSO4溶液作试剂,分别加到其他三种溶液中,只有BaCl2生成白色沉淀,故第二个鉴别出来的是①BaCl2溶液,然后再用BaCl2溶液作试剂,可鉴别出③Na2SO4溶液和②NaCl溶液,故其检出顺序为④①③②或④①②③。
7.实验室有三瓶失去标签的试剂,分别是Na2CO3、NaCl、AgNO3。实验员选择了一种试剂一次就把它们区别开了,这种试剂是( )
A.盐酸 B.氢氧化钠溶液
C.硝酸钡溶液 D.硝酸
答案 A
解析 稀盐酸与Na2CO3溶液反应放出CO2气体,与NaCl溶液不反应,与AgNO3溶液反应生成AgCl白色沉淀。
8.(2019·宁波高一期末)某溶液X中可能含有下列离子中的若干种Cl-、SO、CO、Na+、Mg2+、Cu2+。为了确定该溶液的组成,取一定体积的上述溶液,进行了如下实验。下列说法正确的是( )
A.白色沉淀1一定是硫酸钡
B.溶液X中存在Na+、SO、CO
C.溶液X中可能存在Mg2+,一定不存在Cu2+
D.向溶液2中滴入硝酸银溶液,若生成白色沉淀,说明溶液X中含有Cl-
答案 B
解析 白色沉淀1为碳酸钡、硫酸钡混合物,A错误;根据实验分析可知溶液X中存在Na+、SO、CO,B正确;含有碳酸根离子,则一定不含Mg2+,二者不能共存,C错误;因加入盐酸,引入氯离子,不能确定溶液X中是否含有氯离子,D错误。
考点 离子反应应用
题点 离子及物质推断
题组三 有关碳酸盐的离子反应
9.相同条件下,等物质的量Na2CO3和NaHCO3固体分别与相同浓度的过量稀盐酸反应,下列叙述正确的是( )
A.两者放出的CO2一样多
B.Na2CO3放出的CO2多
C.NaHCO3消耗的盐酸多
D.Na2CO3反应剧烈
答案 A
解析 根据碳元素守恒,等物质的量Na2CO3和NaHCO3放出二氧化碳的物质的量相等,故A正确;根据A选项分析,两者放出的二氧化碳一样多,故B错误;由化学方程式:Na2CO3+2HCl===2NaCl+H2O+CO2↑,NaHCO3+HCl===NaCl+H2O+CO2↑,碳酸钠消耗的盐酸多,故C错误;碳酸氢钠与盐酸反应比碳酸钠与盐酸反应剧烈,故D错误。
10.将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴滴加稀盐酸,下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
答案 C
解析 假设氢氧化钠和碳酸钠的物质的量都为1 mol,将等物质的量的NaOH和Na2CO3混合并配成溶液,向溶液中逐滴加入盐酸,1 mol氢氧化钠消耗1 mol盐酸反应生成氯化钠和水,没有现象,然后1 mol碳酸钠和1 mol盐酸反应生成1 mol碳酸氢钠和氯化钠,1 mol碳酸氢钠再和1 mol盐酸反应生成氯化钠、水和1 mol二氧化碳。
B组 综合强化练
1~4题是单项选择题,5~6题是不定项选择题
1.向等物质的量NaOH、Na2CO3的混合溶液中,逐滴加稀盐酸至过量。不可能发生的离子方程式是( )
A.OH-+H+===H2O
B.CO+2H+===CO2↑+H2O
C.OH-+CO+2H+===HCO+H2O
D.OH-+CO+3H+===CO2↑+2H2O
答案 B
解析 向等物质的量NaOH、Na2CO3的混合溶液中,逐滴加入盐酸至过量,依次发生反应NaOH+HCl===NaCl+H2O、Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+CO2↑+H2O,所以不可能发生的反应是CO+2H+===CO2↑+H2O,故选B。
2.已知某溶液中含有Mg2+、Ba2+、Ag+和NO,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中的三种阳离子逐一完全沉淀分离,其流程如图所示。下列说法正确的是( )
A.试剂A可能为NaOH溶液
B.沉淀2只能是BaCO3,不可能是Mg(OH)2
C.每加一种试剂需过量但不需要过滤即可进行下一步
D.生成沉淀1的离子方程式只能是Ag++Cl-===AgCl↓
答案 D
解析 由流程图可知,溶液中含有Ba2+、Mg2+、Ag+,应先加入NaCl溶液除去Ag+,生成的沉淀1为AgCl,过滤后溶液1中加入的试剂B为NaOH溶液,得到的沉淀2为Mg(OH)2,溶液2中加入的试剂C为Na2CO3溶液,得到的沉淀3为BaCO3。试剂A不可能为NaOH溶液,Ag+和Mg2+均与OH-反应产生沉淀,故A项错误;沉淀2是Mg(OH)2,故B项错误;除杂时,为了除尽杂质离子,所加除杂试剂必须过量,由于实验目的是将三种阳离子逐一沉淀分离,所以每步均需过滤后再进行下一步操作,故C项错误;生成沉淀1的离子方程式只能是Ag++Cl-===AgCl↓,故D项正确。
3.(2019·云南玉溪一中高一期中)下列各组离子一定能大量共存的是( )
A.在无色溶液中:Na+、Fe3+、Cl-、SO
B.在含大量Fe3+的溶液中:NH、K+、NO、OH-
C.在强碱溶液中:Na+、K+、NO、CO
D.滴加紫色石蕊溶液显红色的溶液中:K+、Fe2+、Cl-、CO
答案 C
考点 离子反应应用
题点 选项有限制条件的离子共存判断
4.某混合溶液中所含离子的浓度如表所示,则M可能为( )
离子
NO
SO
H+
M
浓度/mol·L-1
2
1
2
1
A.Cl- B.Ba2+ C.Na+ D.Mg2+
答案 D
解析 设M所带电荷数为x,根据溶液呈电中性可得2×1+1×2=2×1+x×1,得x=2,因此M应该带2个单位的正电荷。由于SO与Ba2+能够反应生成沉淀,即不能大量共存,所以M可能为Mg2+。
【考点】 离子共存
【题点】 离子共存的相关综合
5.(2019·广东佛山一中高一段考)在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中共存的是( )
A.含有大量SO的溶液:加入Mg2+、Cu2+、Cl-、NO
B.滴加酚酞变红的溶液:加入SO、Cu2+、K+、Cl-
C.所含溶质为NaHSO4的溶液:加入K+、Cl-、NO、Na+
D.常温下,加入铁粉能生成H2的溶液:加入Na+、Ca2+、Cl-、HCO
答案 AC
解析 含有大量SO的溶液中,SO、Mg2+、Cu2+、Cl-、NO各离子之间不反应,能大量共存,A正确;滴加酚酞变红的溶液呈碱性,碱性条件下Cu2+不能大量存在,B错误;常温下,加入铁粉能生成H2的溶液呈酸性,酸性条件下HCO不能大量存在,D错误。
考点 离子反应应用
题点 离子及物质推断
6.(2019·天津和平区联考)某100 mL溶液可能含有Na+、NH、Fe3+、CO、SO、Cl-中的若干种,取该溶液进行连续实验,实验过程如下所示(所加试剂均过量,气体全部逸出)。下列说法不正确的是( )
A.原溶液一定存在CO和SO,一定不存在Fe3+
B.原溶液一定存在Cl-,可能存在Na+
C.原溶液中c(Cl-)≥0.1 mol·L-1
D.若原溶液中不存在Na+,则c(Cl-)<0.1 mol·L-1
答案 D
解析 加入氯化钡溶液,生成沉淀,则溶液中可能含有碳酸根离子或硫酸根离子,沉淀可能为BaSO4或BaCO3,沉淀部分溶解于盐酸,所以沉淀一定是BaSO4、BaCO3的混合物,原溶液中一定存在CO、SO,硫酸钡沉淀是2.33 g,物质的量是2.33 g÷233 g·mol-1=0.01 mol,碳酸根离子的物质的量是(4.30 g-2.33 g)÷197 g·mol-1=0.01 mol,碳酸根和铁离子不共存,一定不存在Fe3+, 所得到的滤液中加入氢氧化钠,产生气体,为氨气,原溶液中一定含有铵根离子,根据元素守恒,铵根离子的物质的量是1.12 L÷22.4 L·mol-1=0.05 mol。阳离子所带正电荷的物质的量之和为0.05 mol,阴离子所带负电荷的物质的量之和为0.01 mol×2+0.01 mol×2=0.04 mol,所以根据电荷守恒,一定存在氯离子。钠离子不能确定,则n(Cl-)
≥0.01 mol,所以c(Cl-)≥0.1 mol·L-1。原溶液一定存在NH、CO、SO和Cl-,一定不存在Fe3+,A项正确;原溶液一定存在Cl-,可能存在Na+,B项正确;原溶液中c(Cl-)≥
0.1 mol·L-1,C项正确;若原溶液中不存在Na+,则c(Cl-)=0.1 mol·L-1,D项错误。
考点 离子反应应用
题点 电荷守恒在离子检验中的应用
7.(2020·开封质检)某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是__________。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是__________________。
(3)取(2)中的滤液,加入过量的氢氧化钠溶液,出现白色沉淀,说明原溶液中肯定有____________,有关的离子方程式为_______________________________________________。
(4)原溶液可能大量共存的阴离子是________(填字母)。
A.Cl- B.NO C.CO D.OH-
答案 (1)Cu2+、Fe3+ (2)Ag+
(3)Mg2+ Mg2++2OH-===Mg(OH)2↓ (4)B
解析 (1)无色透明溶液中不可能含有Cu2+、Fe3+等有色离子。(2)加盐酸有不溶于稀硝酸的白色沉淀生成,则肯定存在Ag+。(3)溶液中加氢氧化钠溶液有白色沉淀出现,肯定含有Mg2+。(4)原溶液中由于含有Ag+和Mg2+,阴离子中不可能含有Cl-、CO、OH-,可能含NO。
