3.0《金属及其化合物》PPT课件(新人教版-必修1)
文档属性
| 名称 | 3.0《金属及其化合物》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 12:40:09 | ||
图片预览










文档简介
(共81张PPT)
新课标人教版课件系列
《高中化学》
必修1
第三章
《金属及其化合物》
教学目标
1、金属的化学性质,金属与非金属的反应 ,金属与酸和水的反应 ,铝与氢氧化钠溶液的反应 ,物质的量在化学方程式计算中的应用 。
2、几种重要的金属化合物 ,钠的重要化合物 ,铝的重要化合物 ,铁的重要化合物 。
3、用途广泛的金属材料 ,常见合金的重要应用 ,正确选用金属材料 。
第一节
《金属的化学性质》
第三章 金属及其化合物
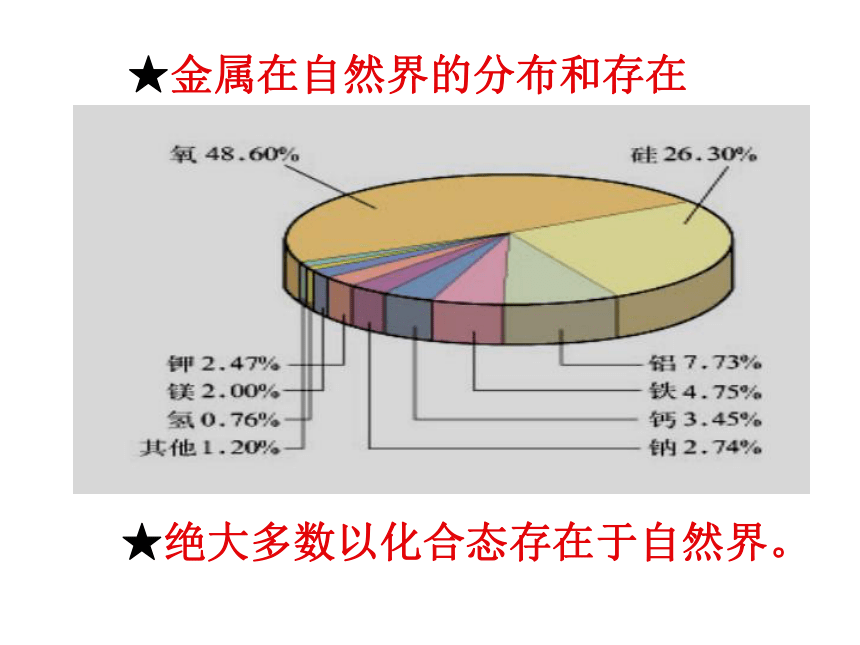
★金属在自然界的分布和存在
★绝大多数以化合态存在于自然界。
思考和交流
★金属有哪些共同的化学性质?
①金属能与酸反应
②与盐发生相互置换反应
★你能举例说明吗?
③与非金属单质的反应
(是不是所有的金属都能)
2Mg+O2=2MgO
2Al+3CuSO4=Al2(SO4)3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2
(一).金属与氧气的反应
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
实验3-1
从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
一、金属的性质
常温
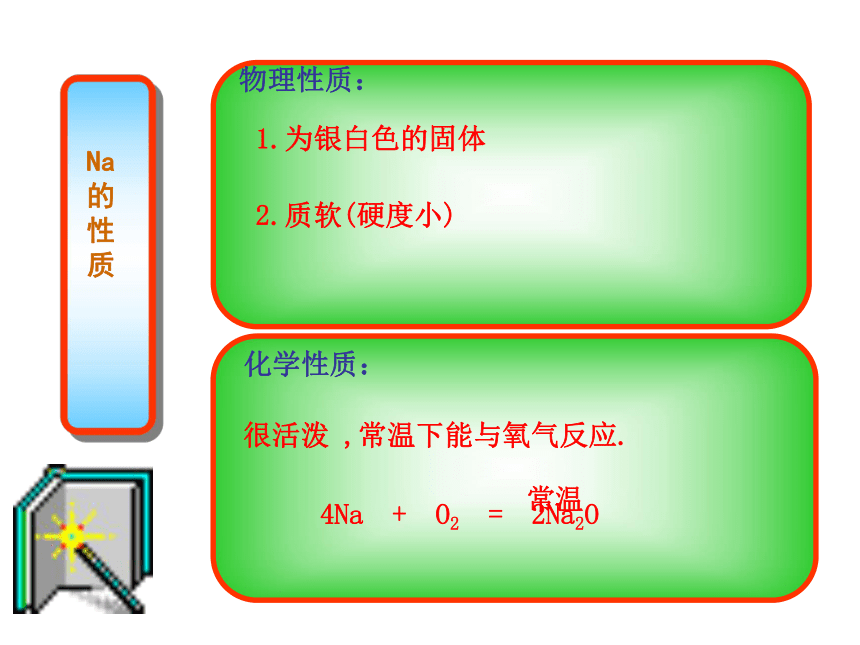
物理性质:
1.为银白色的固体
2.质软(硬度小)
化学性质:
很活泼 ,常温下能与氧气反应.
4Na + O2 = 2Na2O
常温
Na的性质
实验3-2
把一小块金属钠放在坩埚上,加热,有何现象发生?
现象:可观察到钠先熔化后燃烧,燃烧时火焰呈黄色,生成淡黄色的固体。
2Na + O2 === Na2O2
* 反应条件不同,产物不同
科学视野
Na2O2 + 2H2O = 2NaOH + H2O2 ①
①×2 + ② 得
-1
-1
-2
-2
-1
-2
0
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 2H2O = 4NaOH + O2
Na2O2的用途:在呼吸面具、潜艇紧急情况时作供 氧剂,作秸杆、织物的漂白剂。
2H2O2 = 2H2O + O2 ②
练习:写出过氧化钠与盐酸反应的化学方程式:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2
Na2O2 + 2HCl = 2NaCl + H2O2 ①
2H2O2 = 2H2O + O2 ②
Na2O2不是碱性氧化物
现 象:铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
因为铝表面有一层氧化膜保护了铝。构成膜的氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
科学探究
加热铝箔
为什么?
铝和铁谁更活泼,将一根铝线和一根铁线放在野外哪个更容易生锈.
请思考:
科学探究
用砂纸打磨铝箔,除去氧化膜后,再加热至熔化。
现象:铝箔熔化,失去光泽,
熔化的铝仍然不滴落。
结论:铝很活泼,常温下能
与空气中的氧气反应,生成
一层致密的氧化膜,起保护
的作用。
原因:铝很活泼,除去原来
的氧化膜后,在空气中很快
生成一层新的氧化膜。
4Al + 3 O2 ==== 2Al2O3
常温或加热
思考:写出钠与硫酸铜的反应方程式
2Na+CuSO4+2H2O=Cu(OH)2 +Na2SO4+H2
(二).金属与水的反应
1.金属钠和水的反应
实验3-3
将一小块金属钠投入滴有酚酞的水中。
现 象 解 释
浮
游
熔
嘶
红
金属钠的密度小于水
产生的气体推动金属钠来回游动
反应放热,钠的熔点较低
剧烈反应,产生气体并燃烧
有碱性物质生成
2Na + 2H2O == 2NaOH + H2
物理性质:为银白色的固体,质软,密度比水还小(0.97g/cm3),熔点较低(97.87℃)
化学性质: 化学性质很活泼
1、与氧气反应
常温
4Na + O2 === 2Na2O
2Na + O2 === Na2O2
点燃
2、与水反应
2Na + 2H2O == 2NaOH + H2
3、与其它非金属单质的反应 2Na+Cl2 == 2NaCl
4、与酸的反应 2Na+2HCl == 2NaCl+H2
小结:钠的物理性质和化学性质
小结:钠的物理性质和化学性质
2、与酸的反应 2Na+2HCl == 2NaCl+H2
1、与水反应
2Na + 2H2O == 2NaOH + H2
注意:钠与水、酸反应的实质是与H+的反应,酸里面的H+浓度大,所以钠与酸反应更快。
铁与水如何反应?
1.铁与水蒸气的反应
铁不能与冷、热水反应,(可以在水,氧气的条件下被腐蚀生锈,主要成分是三氧化二铁)但能否与水蒸气反应
请设计一个简单的实验装置,使还原铁粉与水蒸气反应
1.水蒸气的发生装置
2.水蒸气与铁粉反应装置
3.产物的检验(收集)装置
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
方案1:
方案2:
3Fe+4H2O(g) Fe3O4+4H2
方案3:
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
离子方程式为:
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O==2NaAlO2+3H2
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
2Al+6H+==2Al3+ +3H2
2Al + 6HCl == 2AlCl3 + 3H2
2Al+2OH-+2H2O==2AlO2- + 3H2
(可看作分两步进行)
Al(OH)3:
两性氢氧化物
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。
在这些变化中,金属表现了强的还原性,做还原剂
在自然界中金属多以化合态存在,只有极少数不活泼的金属如金以游离态存在。
四、物质的量在化学中的应用:
1、化学方程式的计量数之比等于物质的量之比
2、同一物质下面对应的物理量(包括单位)一 致即可
【题1】在STP下,4.4gCO2气体通过足量的Na2O2,放出氧气的物质的量为多少,体积为多少,气体质量增加多少充分反应后固体质量增加多少。
【作业】:P45习题1,2,3,4,5,6
姓名:
过氧化钠
国籍:
过氧化物共和国
淡黄
肤色:
体重:
78公斤
性格:
活泼好动,团结合群。爱憎分明,一见到二氧化碳,脸色立变,一落水就非常生气。
简历:
中学毕业后参军,在4632部队防化连当战士,后调海军某潜艇当班长,复员后在立白化工厂当工人,曾与氯气、二氧化硫等
一起,光荣出席全国漂白积极分子群英会。
多次获得反黑扫毒模范称号。
愿望:
有一所坚固密实的房子保养身体,
为人民再立新功。
秘密档案
第二节
《几种重要的金属
化合物》
第三章 金属及其化合物
一.氧化物
1.金属氧化物的性质
(1)与水作用
①多数不溶于水,不跟水反应
如:Fe2O3 、CuO、 Al2O3等
②只有少数溶于水,能与水起反应生成可溶或微溶的碱
如:Na2O、K2O 、CaO等
CaO+H2O==Ca(OH)2
Na2O+H2O=2NaOH
K2O+H2O=2KOH
③过氧化钠溶于水,反应生成氢氧化钠和氧气
2Na2O2+2H2O==4NaOH+O2↑
金属氧化物有怎样的性质
(2)与酸反应
实验3-5
MgO、 Fe2O3 、 CuO 分别与盐酸反应
反应后溶液颜色
无色
黄色
蓝色
氧化物 固体颜色 与水反应 与盐酸反应
Na2O
MgO
Fe2O3
CuO
金属氧化物的性质
(溶液无色)
(溶液无色)
白色
白色
红棕色
黑色
MgO+2HCl=MgCl2+H2O
Na2O+2HCl=2NaCl+H2O
Fe2O3+6HCl=2FeCl3+3H2O
(溶液黄色)
CuO+2HCl=CuCl2+H2O
(溶液蓝色)
以上金属氧化物能与酸起反应,只生成盐和水,这类氧化物称为碱性氧化物
Na2O+H2O=2NaOH
MgO+H2O=Mg(OH)2
不溶,不反应
不溶,不反应
2、氧化铝的特殊性
Al2O3+6HCl==2AlCl3+3H2O
Al2O3+2NaOH==2NaAlO2+H2O
像氧化铝这样,既能与酸反应生成盐和水,也能与强碱溶液反应生成盐和水这类氧化物叫做两性氧化物
既能跟强酸(HCl),又能跟强碱(NaOH)反应
(偏铝酸钠)
3. 金属氧化物的用途
Ⅰ.作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2
Ⅱ.氧化铁(Fe2O3)是一种红棕色的粉未(俗称铁红),常用于制造红色油漆和涂料
Ⅲ.氧化铝(Al2O3)是一种白色难熔的物质,是一种较好的耐火材料,制坩埚和耐火管。
Ⅳ.氧化亚铜(Cu2O)呈红色,可以制造玻璃、搪瓷的红色颜料
氧化铁作外墙涂料
含氧化亚铜
学与问
钠表面的氧化物与铝的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗?
二.氢氧化物
思考和交流
氢氧化物可由 与 反应制得,氢氧化物具有哪些性质?(从颜色状态、水溶性和化学性质进行讨论)
2、与酸发生中和反应,
4、与盐发生复分解反应,
盐
碱
1、与酸碱指示剂作用,
3、与酸式盐发生中和反应,
6、不溶性碱受热分解。
共性:
5、与非金属氧化物反应,
1.铁的氢氧化物
思考:制备Fe(OH)3 、Fe(OH)2选用什么试剂?
FeCl3 FeSO4
加入NaOH溶液产生的现象
离子方程式
产生红褐色的沉淀
先有灰白色的沉淀,迅速变成灰绿色,最后变成红褐色
Fe3++3OH-=Fe(OH)3 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3
Fe(OH)2
实验3-6:在FeCl3、FeSO4分别加入NaOH溶液
Fe2++2OH-=Fe(OH)2 ↓
可溶性铁盐+可溶性碱
可溶性亚铁盐+可溶性碱
想一想:1、要制得Fe(OH)2 ,可采取什么措施?
用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)除去蒸馏水中溶解的O2常采用煮沸的方法
(2)生成白色Fe(OH)2沉淀的操作可采用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。
(3)用植物油将反应体系与空气隔离.
2、Fe(OH)2 在空气中加热生成FeO吗?
Fe2O3
学与问
你能归纳出Fe(OH)2和Fe(OH)3的化学性质吗?
(1)氢氧化铁的性质
①与酸反应
②受热可分解
Fe(OH)3+3HCl=FeCl3+3H2O
2Fe(OH)3===Fe2O3+3H2O
(2)氢氧化亚铁的性质
①与酸反应
② 有还原性,易被空气中的氧气氧化
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2.氢氧化铝
(1)氢氧化铝的制备
实验I: 向0.5mol/L的Al2(SO4)3溶液滴加NaOH溶液
现象: 产生白色胶状沉淀,后消失
想一想:制备Al(OH)3 ,可选用什么试剂?
实验II: 向0.5mol/L的Al2(SO4)3溶液滴加氨水
现象: 产生白色胶状沉淀
思考:
1、为什么在实验I得到的沉淀会消失?
2、制备Al(OH)3 ,最好选用什么试剂?
实验III: 在Al(OH)3沉淀中加入盐酸溶液
现象: 白色沉淀溶解
3、Al(OH)3 ,具有怎样的化学性质?
(2)氢氧化铝的性质
像氢氧化铝这样,既能与强酸反应也能与强碱反应的氢氧化物,叫两性氢氧化物
写出氢氧化铝与盐酸、氢氧化钠溶液反应的离子方程式
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
①与强酸反应
②与强碱反应
③受热分解
Al(OH)3==Al2O3+H2O
(1)氢氧化铝的制备
Al2(SO4)3+6NH3 H2O=2Al(OH)3 +3(NH4)2SO4
请大家归纳一下,本节课我们主要学习了什么知识?
1、碱的通性
与酸发生中和反应,
与盐发生复分解反应,
与酸碱指示剂作用,
与酸式盐发生中和反应,
不溶性碱受热分解。
与非金属氧化物反应,
2、 Fe(OH)2的还原性
易被空气中的氧气氧化
3、 Al(OH)3的两性
既能与强酸反应也能与强碱反应
1.在MgCl2溶液中滴加少量的NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为______________。在AlCl3溶液中滴加少量NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为___________.反应的化学方程式为 离子方程式为 。
产生白色沉淀
产生白色沉淀
白色沉淀不溶解
白色沉淀溶解
2.下列物质,既能与盐酸又能与氢氧化钠溶液反应的是: A. FeCl3 B. Fe2O3 C.Al D.Al(OH)3 E. Na2CO3 F.NaHCO3 G. Al2O3
3.可用做医用胃酸中和剂的是:
A. NaOH B. Cu(OH)2 C. Al(OH)3 D. NaHCO3
C、D、F、G
(C、D)
4、 有1mol/L的AlCl3溶液1L,往其中加入2mol/L氢氧化钠溶液,要得到的沉淀最多,应加 L该浓度的氢氧化钠溶液;要沉淀全部溶解,还要继续加 L该浓度的氢氧化钠溶液。并画出沉淀随加入氢氧化钠溶液的体积变化的曲线。
1.5
0.5
三.盐
1.碳酸钠和碳酸氢钠
(1)Na2CO3和NaHCO3在水中的溶解性
Na2CO3 NaHCO3
俗名
步骤 ①
步骤 ②
步骤 ③
晶体部分溶解
溶液变浅红色
白色粉未,加水结块成晶体,放热
白色晶体,加水部分溶解,感受不到热量变化
振荡长时间可溶解
溶液变红色
加水先变成Na2CO3·10H2O晶体,比NaHCO3易溶,溶液的碱性比NaHCO3强
比Na2CO3难溶,溶液的碱性比Na2CO3弱
初步结论
纯碱、苏打
小苏打
(2)Na2CO3和NaHCO3的热稳定性
Na2CO3稳定受热不分解
NaHCO3不稳定,受热可分解
澄 清石灰水不变浑浊
2NaHCO3===Na2CO3+H2O+CO2↑
实验3-18
①Na2CO3 ②
①现象:
②现象:
澄 清石灰水变浑浊
结论:
(3)Na2CO3和NaHCO3盐酸的反应
Na2CO3 NaHCO3
逐滴滴入HCl的现象
反应方程式及离子方程式
刚开始滴入,没有明显现象,后来反应较剧烈,有气泡产生
刚开始滴入,反应很剧烈,有气泡产生
Na2CO3+HCl=NaHCO3+NaCl
CO32-+H+=HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
总结
Na2CO3
NaHCO3
俗 名
水溶性
溶液碱性
小苏打
纯碱 苏打
易溶(比NaHCO3易溶)
可溶
较强
较弱
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
稳定,加热难分解
不稳定,加热可分解
2NaHCO3==Na2CO3+H2O+CO2↑
热稳定性
Na2CO3+HCl=NaHCO3+NaCl
与酸反应
与某些碱反应
Na2CO3+ Ca(OH)2=CaCO3
+2NaOH
NaHCO3+NaOH=Na2CO3+H2O
2.铁盐
(1)Fe3+离子的检验
向FeCl3和FeCl2溶液中分别加入KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
交流和讨论: 有哪些方法可以鉴别FeCl3溶液和FeCl2溶液
亚铁(Fe 2+)盐
铁(Fe 3+)盐
(1)颜色:Fe 2+ Fe3+ .
Fe2+ 和Fe3+的鉴别方法
浅绿色
黄色
(2)SCN- 法:滴入KSCN溶液或其他可溶性硫氰化物的溶液,呈 色的是Fe 3+
血红
(3)碱液法:分别加入碱液(或氨水),生成 色沉淀是Fe3+溶液,先生成
色沉淀,又迅速转变为 色,最后变
为 的是Fe2+溶液
红褐
白
灰绿
红褐
(2)Fe3+离子的氧化性
实验1:在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液
现象:
结论:
2FeCl3 + Fe == 3FeCl2
反应方程式:
(氧化剂)
(还原剂)
离子方程式:
2FeCl3 + Cu == 2FeCl2+CuCl2
(氧化剂)
(还原剂)
溶液不显血红色
溶液中不含Fe3+
2Fe3+ + Fe == 3Fe2+
金属铜也能将Fe3+还原:
实验2:在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2)
现象:
溶液变成血红色
结论:
原溶液中的Fe2+转变成Fe3+
反应方程式:
2FeCl2 + Cl2 == 2FeCl3
氧化剂
还原剂
总结:
还原剂
+氧化剂(Cl2)
+还原剂(Fe)
氧化剂
Fe2+
Fe3+
离子方程式:
2Fe2+ + Cl2 == 2Fe3+ +2Cl-
2. 铝盐
偏铝酸钠(NaAlO2)
明矾[KAl(SO4)2·12H2O]
偏铝酸钠(NaAlO2)与酸的反应:
实验:
在NaAlO2溶液中滴入盐酸
现象:
产生白色沉淀,后消失。
反应方程式:
NaAlO2+HCl+H2O=NaCl+Al(OH)3↓
离子方程式:
AlO2-+H++H2O=Al(OH)3↓
Al(OH)3↓+3HCl=AlCl3+3H2O
Al(OH)3↓+3H+=Al3++3H2O
明矾[KAl(SO4)2·12H2O]可用作净水剂
科学探究:铝盐和铁盐的净水作用
不加试剂
加入明矾
加入硫酸铁溶液
2min
5min
无明显变化
有明显沉降溶液半透明
有明显沉降溶液半透明
沉淀沉在底部溶液接近透明
沉淀沉在底部溶液接近透明
浑浊 , 略有沉降
明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂
结 论
3.焰色反应
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈
黄色
②钠燃烧时,火焰呈
黄色
实验:用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
滤光
除去粘在铂丝上的杂质
一些金属及化合物的焰色反应
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
Li
Na
K
Ca
Sr
Ba
Cu
第三节
《用途广泛的金属
材料》
第三章 金属及其化合物
思考与交流:下列物品都使用了哪种材料
一、常见合金的重要应用
二、正确选用金属材料
三、课堂互动
四、整合拓展
一、常见合金的重要应用
学与问:
初中曾学过有关合金的一些知识,你还记得什么是合金吗?合金有哪些优良的性质?
你知道合金在生活中有哪些用途吗?举出一些例子。
合金是由一种金属跟其它一种或几种金属(或金属跟非金属)一起熔合而成的具有金属特性的物质。合金属于混合物。
合金具有许多优良的物理、化学或机械性能,在许多方面不同于各组分金属,例如,合金的硬度一般比它的各成分金属的大,合金的熔点比各成分的金属低。
在工农业生产和日常生活中,我们很少使用纯金属,而主要使用合金,常见的合金有铜合金、铁合金和铝合金。
1、铜合金:我国使用最早的合金
青铜:主要含铜和锡,有良好的强度和塑性、耐磨、耐腐蚀,主要用于制机器零件如轴承、齿轮等。
黄铜:主要含铜和锌,有良好的强度和塑性、易加工、耐腐蚀,主要用于制机器零件、仪表和日用品。
白铜:主要含铜和镍,它不容易生铜绿,常用于制造精密仪器和装饰品。
相关网址:
http:///ziyuan/mdv/juniorchem/html/6/index.htm
相关网址:
http://jdqx21cn./heheqingtong/index3.htm
钢的种类
生铁与钢的比较
其它几种常见合金的组成、性质和用途
2.钢:用量最大,用途最广的合金
铁的合金 生铁 钢
C% 2%-4.3% 0.03%-2%
其它杂质 Si、Mn、S、P
(较多) Si、Mn、S、P
(较少)
机械性能 质硬而脆、
无韧性 坚硬、韧性大、 可塑性好。
钢
碳素钢:
铁和碳的合金
合金钢:在碳素钢中加
入铬、锰、钨、镍、钼、
钴等合金元素(如不锈钢)
低碳钢
含碳量低于0.3%
中碳钢
含碳量0.3%~0.6%
高碳钢
含碳量高于0.6%
名称 组成 主要性质 主要用途
铝合金 含有10%~30%的镁 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
硬铝 含铜4%、镁0.5%、锰0.5%、硅0.7% 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
钛合金 含铝6%、钒4% 耐高温、耐腐蚀、高强度 用于飞机、宇航、化学工业
金合金 加入银、铜、稀土元素等 有光泽、易加工、耐磨耐腐蚀 金饰品、电子元件、钱币、笔尖
二、正确选用金属材料
思考与交流
实践活动
科学视野
思考与交流:
某家庭准备装修窗户(计划使用10年),可供选用的材料有:木材、钢铁、铝合金、塑钢。请调查分析选用哪种材料比较好?说明理由。
选用材料时,常常考虑经下几个方面:主要用途、外观、物理性质、化学性质、价格、加工难度、日常维护、对环境的影响等。
2003年底以来全国各地建筑材料价格都出现了上涨的情况。比如,钢材涨价超过了50%,水泥涨价超过了30%,木材涨价超过了10%。
调查报告
调查内容 家庭装修时材料的选用 指导老师
调查组成员 组长
背景介绍:某家庭准备装修窗户(计划使用10年),可供选用的材料有:木材、钢铁、铝合金、塑钢。请调查分析选用哪种材料比较好?
调查目的与意义:
调查内容与结果:
实践活动:
角色扮演:是否应该停止使用铝质饮料罐
铝质饮料罐
在饮料业的
发展中起到
了举足轻重
的作用,至
今仍广泛使
用,请你扮
演不同的角
色,分析是
否应该停止
使用铝质饮
料罐。
调查报告
调查内容 是否应该停止使用铝质饮料罐 指导老师
调查组成员 组长
扮演角色:
观点: 论据:
结论:
结合调查并查阅有关资料写一篇有产铝质饮料罐的小论文。
科学视野:
相关网址:中国稀土在线
http://www.cre-/soft/newmaterindex/newmaterin.htm
中国的改革总
设计师邓小平
同志早在1992
年春南巡时就
指出:“中东有石油,中国有
稀土,……一
定要把稀土的
事情办好,把
中国稀土的优
势发挥出来。”
2 、人类历史上大量生产和使用铝、铁、钛、
铜四种金属的时间顺序是( )
A。铜、铁、铝、钛
B。铁、铝、铜、钛
C。铜、铁、钛、铝
D。铁、铜、铝、钛
1、下列物质中,不属于合金的是( )
A、硬铝 B、黄铜
C、钢铁 D、水银
D
A
三、课堂互动
3、 我国在春秋战国时期,就懂得将白铁褪火
处理得到相当于铸钢的物器(如锋利的宝剑)
,这一技术要比欧洲早就两千年,那么白铁
褪火处理的主要作用是( )
A、除去硫、磷杂质
B、适当降低了含碳量
C、渗入了合金元素
D、改善表面的结构性质
B
四、整合拓展
1、本节教材内容的知识网络:
用途广泛的金属材料
常见合金的重要应用
正确选用金属材料
铜合金
钢
2、金属的分类
金属
冶金工业分
黑色金属:铁、铬、锰
有色金属:除铁、铬、锰以外的金属
按密度分
重金属 :密度4.5g/cm3以上
轻金属 :密度4.5g/cm3以下
按接触概率分
常见金属:如铁、铝、铜等
稀有金属:如锆、铌、钼等
3、金属的冶炼
目前工业上冶炼金属常用的方法有:
热分解法
适用范围:在金属活动顺序中,位于氢后面的金属。
热还原法
大多数金属的冶炼适用于此法。
电解法
钾、钙、钠、铝等活泼金属,只能用电解其熔融盐或氧化物的方法制解。
把金属从矿石中提炼出来,这个过程就叫金属的冶炼。
从金属矿石中提炼金属一般需经过三个步骤:(1)矿石的采集;(2)冶炼;(3)精炼。
世界近代史上,钢铁是国力最重要的标志. 尽管三千多年前商代的青铜器已表明我国古代无与伦比的冶炼技术,但直到晚清的洋务运动才开始发展钢铁工业,而1949年共和国建立时只有区区的15万吨。
1996年起,我国钢产量突破了一亿吨,跃居世界第一,据中国钢铁工业协会的预测,2004年我国钢产量将达到2.6亿吨,比2003年增长
16.9%,钢材消费量将达到2.8亿吨左右,比2003年增长13%左右。
炼钢过程
人类还准备向宇宙要铁,1970年前苏联空间站“月亮-16”首先从月球带回了铁矿石样品。人们发现月球上的铁矿石含有极微小的纯铁颗粒,它们毫无氧化痕迹。另人惊奇的是,月球铁在地球环境下仍然不易氧化。后来相继从月球带回不少月亮铁样品,几年后也不锈蚀。经过大量的模拟月亮环境条件的试验,并采用光谱分析,结论是:月亮上没有大气层保护,因而受到太阳风——一种粒子流的冲击之后,铁具有了对氧的稳定免疫性,到了地球上仍能抗拒氧的锈蚀。这就给我们提供了一种新的金属表面处理方法——用人为的粒子流冲击金属表面。
专家们设计了一种从月球矿石提取铁的特殊装置,其工作原理是:利用透镜聚集太阳光熔化矿石,随后由太阳能供电进行电解,使金属铁从其他杂质中分离出来。据估计,这种装置只有书桌大小,却可日产1吨铁。另外由于气压极低,铁在月亮上可出现升华现象,可以利用这种特点设计“炼铁”的特殊装置。
新课标人教版课件系列
《高中化学》
必修1
第三章
《金属及其化合物》
教学目标
1、金属的化学性质,金属与非金属的反应 ,金属与酸和水的反应 ,铝与氢氧化钠溶液的反应 ,物质的量在化学方程式计算中的应用 。
2、几种重要的金属化合物 ,钠的重要化合物 ,铝的重要化合物 ,铁的重要化合物 。
3、用途广泛的金属材料 ,常见合金的重要应用 ,正确选用金属材料 。
第一节
《金属的化学性质》
第三章 金属及其化合物
★金属在自然界的分布和存在
★绝大多数以化合态存在于自然界。
思考和交流
★金属有哪些共同的化学性质?
①金属能与酸反应
②与盐发生相互置换反应
★你能举例说明吗?
③与非金属单质的反应
(是不是所有的金属都能)
2Mg+O2=2MgO
2Al+3CuSO4=Al2(SO4)3+3Cu
Cu+2AgNO3=Cu(NO3)2+2Ag
Mg+2HCl=MgCl2+H2
(一).金属与氧气的反应
讨论:从以上实验,我们了解到金属钠的哪些物理和化学性质?
实验3-1
从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象.
现象:切口处可观察到银白色的金属光泽,在空气中很快变暗。
一、金属的性质
常温
物理性质:
1.为银白色的固体
2.质软(硬度小)
化学性质:
很活泼 ,常温下能与氧气反应.
4Na + O2 = 2Na2O
常温
Na的性质
实验3-2
把一小块金属钠放在坩埚上,加热,有何现象发生?
现象:可观察到钠先熔化后燃烧,燃烧时火焰呈黄色,生成淡黄色的固体。
2Na + O2 === Na2O2
* 反应条件不同,产物不同
科学视野
Na2O2 + 2H2O = 2NaOH + H2O2 ①
①×2 + ② 得
-1
-1
-2
-2
-1
-2
0
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2Na2O2 + 2H2O = 4NaOH + O2
Na2O2的用途:在呼吸面具、潜艇紧急情况时作供 氧剂,作秸杆、织物的漂白剂。
2H2O2 = 2H2O + O2 ②
练习:写出过氧化钠与盐酸反应的化学方程式:
2Na2O2 + 4HCl = 4NaCl + 2H2O + O2
Na2O2 + 2HCl = 2NaCl + H2O2 ①
2H2O2 = 2H2O + O2 ②
Na2O2不是碱性氧化物
现 象:铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
因为铝表面有一层氧化膜保护了铝。构成膜的氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
科学探究
加热铝箔
为什么?
铝和铁谁更活泼,将一根铝线和一根铁线放在野外哪个更容易生锈.
请思考:
科学探究
用砂纸打磨铝箔,除去氧化膜后,再加热至熔化。
现象:铝箔熔化,失去光泽,
熔化的铝仍然不滴落。
结论:铝很活泼,常温下能
与空气中的氧气反应,生成
一层致密的氧化膜,起保护
的作用。
原因:铝很活泼,除去原来
的氧化膜后,在空气中很快
生成一层新的氧化膜。
4Al + 3 O2 ==== 2Al2O3
常温或加热
思考:写出钠与硫酸铜的反应方程式
2Na+CuSO4+2H2O=Cu(OH)2 +Na2SO4+H2
(二).金属与水的反应
1.金属钠和水的反应
实验3-3
将一小块金属钠投入滴有酚酞的水中。
现 象 解 释
浮
游
熔
嘶
红
金属钠的密度小于水
产生的气体推动金属钠来回游动
反应放热,钠的熔点较低
剧烈反应,产生气体并燃烧
有碱性物质生成
2Na + 2H2O == 2NaOH + H2
物理性质:为银白色的固体,质软,密度比水还小(0.97g/cm3),熔点较低(97.87℃)
化学性质: 化学性质很活泼
1、与氧气反应
常温
4Na + O2 === 2Na2O
2Na + O2 === Na2O2
点燃
2、与水反应
2Na + 2H2O == 2NaOH + H2
3、与其它非金属单质的反应 2Na+Cl2 == 2NaCl
4、与酸的反应 2Na+2HCl == 2NaCl+H2
小结:钠的物理性质和化学性质
小结:钠的物理性质和化学性质
2、与酸的反应 2Na+2HCl == 2NaCl+H2
1、与水反应
2Na + 2H2O == 2NaOH + H2
注意:钠与水、酸反应的实质是与H+的反应,酸里面的H+浓度大,所以钠与酸反应更快。
铁与水如何反应?
1.铁与水蒸气的反应
铁不能与冷、热水反应,(可以在水,氧气的条件下被腐蚀生锈,主要成分是三氧化二铁)但能否与水蒸气反应
请设计一个简单的实验装置,使还原铁粉与水蒸气反应
1.水蒸气的发生装置
2.水蒸气与铁粉反应装置
3.产物的检验(收集)装置
水蒸气的发生装置
水蒸气与铁粉反应装置
产物收集装置
方案1:
方案2:
3Fe+4H2O(g) Fe3O4+4H2
方案3:
三.铝与氢氧化钠溶液的反应
1.铝与稀盐酸的反应
化学方程式为:
离子方程式为:
2.铝与氢氧化钠溶液的反应
2Al+2NaOH+2H2O==2NaAlO2+3H2
铝既能与强酸溶液反应也能与强碱溶液反应,因此酸、碱可直接侵蚀铝的保护膜以及铝制品本身,铝制品餐具不宜用来蒸煮或长时间存放酸性、碱性或咸的食物。
2Al+6H+==2Al3+ +3H2
2Al + 6HCl == 2AlCl3 + 3H2
2Al+2OH-+2H2O==2AlO2- + 3H2
(可看作分两步进行)
Al(OH)3:
两性氢氧化物
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都发生了变化,它们从0价升为正价。
在这些变化中,金属表现了强的还原性,做还原剂
在自然界中金属多以化合态存在,只有极少数不活泼的金属如金以游离态存在。
四、物质的量在化学中的应用:
1、化学方程式的计量数之比等于物质的量之比
2、同一物质下面对应的物理量(包括单位)一 致即可
【题1】在STP下,4.4gCO2气体通过足量的Na2O2,放出氧气的物质的量为多少,体积为多少,气体质量增加多少充分反应后固体质量增加多少。
【作业】:P45习题1,2,3,4,5,6
姓名:
过氧化钠
国籍:
过氧化物共和国
淡黄
肤色:
体重:
78公斤
性格:
活泼好动,团结合群。爱憎分明,一见到二氧化碳,脸色立变,一落水就非常生气。
简历:
中学毕业后参军,在4632部队防化连当战士,后调海军某潜艇当班长,复员后在立白化工厂当工人,曾与氯气、二氧化硫等
一起,光荣出席全国漂白积极分子群英会。
多次获得反黑扫毒模范称号。
愿望:
有一所坚固密实的房子保养身体,
为人民再立新功。
秘密档案
第二节
《几种重要的金属
化合物》
第三章 金属及其化合物
一.氧化物
1.金属氧化物的性质
(1)与水作用
①多数不溶于水,不跟水反应
如:Fe2O3 、CuO、 Al2O3等
②只有少数溶于水,能与水起反应生成可溶或微溶的碱
如:Na2O、K2O 、CaO等
CaO+H2O==Ca(OH)2
Na2O+H2O=2NaOH
K2O+H2O=2KOH
③过氧化钠溶于水,反应生成氢氧化钠和氧气
2Na2O2+2H2O==4NaOH+O2↑
金属氧化物有怎样的性质
(2)与酸反应
实验3-5
MgO、 Fe2O3 、 CuO 分别与盐酸反应
反应后溶液颜色
无色
黄色
蓝色
氧化物 固体颜色 与水反应 与盐酸反应
Na2O
MgO
Fe2O3
CuO
金属氧化物的性质
(溶液无色)
(溶液无色)
白色
白色
红棕色
黑色
MgO+2HCl=MgCl2+H2O
Na2O+2HCl=2NaCl+H2O
Fe2O3+6HCl=2FeCl3+3H2O
(溶液黄色)
CuO+2HCl=CuCl2+H2O
(溶液蓝色)
以上金属氧化物能与酸起反应,只生成盐和水,这类氧化物称为碱性氧化物
Na2O+H2O=2NaOH
MgO+H2O=Mg(OH)2
不溶,不反应
不溶,不反应
2、氧化铝的特殊性
Al2O3+6HCl==2AlCl3+3H2O
Al2O3+2NaOH==2NaAlO2+H2O
像氧化铝这样,既能与酸反应生成盐和水,也能与强碱溶液反应生成盐和水这类氧化物叫做两性氧化物
既能跟强酸(HCl),又能跟强碱(NaOH)反应
(偏铝酸钠)
3. 金属氧化物的用途
Ⅰ.作为冶炼金属的原料
Fe2O3+3CO===2Fe+3CO2
Ⅱ.氧化铁(Fe2O3)是一种红棕色的粉未(俗称铁红),常用于制造红色油漆和涂料
Ⅲ.氧化铝(Al2O3)是一种白色难熔的物质,是一种较好的耐火材料,制坩埚和耐火管。
Ⅳ.氧化亚铜(Cu2O)呈红色,可以制造玻璃、搪瓷的红色颜料
氧化铁作外墙涂料
含氧化亚铜
学与问
钠表面的氧化物与铝的氧化膜都是金属氧化物,它们的外观形态和性质相同吗?对内层金属的保护作用一样吗?
二.氢氧化物
思考和交流
氢氧化物可由 与 反应制得,氢氧化物具有哪些性质?(从颜色状态、水溶性和化学性质进行讨论)
2、与酸发生中和反应,
4、与盐发生复分解反应,
盐
碱
1、与酸碱指示剂作用,
3、与酸式盐发生中和反应,
6、不溶性碱受热分解。
共性:
5、与非金属氧化物反应,
1.铁的氢氧化物
思考:制备Fe(OH)3 、Fe(OH)2选用什么试剂?
FeCl3 FeSO4
加入NaOH溶液产生的现象
离子方程式
产生红褐色的沉淀
先有灰白色的沉淀,迅速变成灰绿色,最后变成红褐色
Fe3++3OH-=Fe(OH)3 ↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3
Fe(OH)2
实验3-6:在FeCl3、FeSO4分别加入NaOH溶液
Fe2++2OH-=Fe(OH)2 ↓
可溶性铁盐+可溶性碱
可溶性亚铁盐+可溶性碱
想一想:1、要制得Fe(OH)2 ,可采取什么措施?
用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)除去蒸馏水中溶解的O2常采用煮沸的方法
(2)生成白色Fe(OH)2沉淀的操作可采用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。
(3)用植物油将反应体系与空气隔离.
2、Fe(OH)2 在空气中加热生成FeO吗?
Fe2O3
学与问
你能归纳出Fe(OH)2和Fe(OH)3的化学性质吗?
(1)氢氧化铁的性质
①与酸反应
②受热可分解
Fe(OH)3+3HCl=FeCl3+3H2O
2Fe(OH)3===Fe2O3+3H2O
(2)氢氧化亚铁的性质
①与酸反应
② 有还原性,易被空气中的氧气氧化
Fe(OH)2+2HCl=FeCl2+2H2O
4Fe(OH)2+O2+2H2O=4Fe(OH)3
2.氢氧化铝
(1)氢氧化铝的制备
实验I: 向0.5mol/L的Al2(SO4)3溶液滴加NaOH溶液
现象: 产生白色胶状沉淀,后消失
想一想:制备Al(OH)3 ,可选用什么试剂?
实验II: 向0.5mol/L的Al2(SO4)3溶液滴加氨水
现象: 产生白色胶状沉淀
思考:
1、为什么在实验I得到的沉淀会消失?
2、制备Al(OH)3 ,最好选用什么试剂?
实验III: 在Al(OH)3沉淀中加入盐酸溶液
现象: 白色沉淀溶解
3、Al(OH)3 ,具有怎样的化学性质?
(2)氢氧化铝的性质
像氢氧化铝这样,既能与强酸反应也能与强碱反应的氢氧化物,叫两性氢氧化物
写出氢氧化铝与盐酸、氢氧化钠溶液反应的离子方程式
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
①与强酸反应
②与强碱反应
③受热分解
Al(OH)3==Al2O3+H2O
(1)氢氧化铝的制备
Al2(SO4)3+6NH3 H2O=2Al(OH)3 +3(NH4)2SO4
请大家归纳一下,本节课我们主要学习了什么知识?
1、碱的通性
与酸发生中和反应,
与盐发生复分解反应,
与酸碱指示剂作用,
与酸式盐发生中和反应,
不溶性碱受热分解。
与非金属氧化物反应,
2、 Fe(OH)2的还原性
易被空气中的氧气氧化
3、 Al(OH)3的两性
既能与强酸反应也能与强碱反应
1.在MgCl2溶液中滴加少量的NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为______________。在AlCl3溶液中滴加少量NaOH溶液,现象为_____________,继续加入过量的NaOH溶液,现象为___________.反应的化学方程式为 离子方程式为 。
产生白色沉淀
产生白色沉淀
白色沉淀不溶解
白色沉淀溶解
2.下列物质,既能与盐酸又能与氢氧化钠溶液反应的是: A. FeCl3 B. Fe2O3 C.Al D.Al(OH)3 E. Na2CO3 F.NaHCO3 G. Al2O3
3.可用做医用胃酸中和剂的是:
A. NaOH B. Cu(OH)2 C. Al(OH)3 D. NaHCO3
C、D、F、G
(C、D)
4、 有1mol/L的AlCl3溶液1L,往其中加入2mol/L氢氧化钠溶液,要得到的沉淀最多,应加 L该浓度的氢氧化钠溶液;要沉淀全部溶解,还要继续加 L该浓度的氢氧化钠溶液。并画出沉淀随加入氢氧化钠溶液的体积变化的曲线。
1.5
0.5
三.盐
1.碳酸钠和碳酸氢钠
(1)Na2CO3和NaHCO3在水中的溶解性
Na2CO3 NaHCO3
俗名
步骤 ①
步骤 ②
步骤 ③
晶体部分溶解
溶液变浅红色
白色粉未,加水结块成晶体,放热
白色晶体,加水部分溶解,感受不到热量变化
振荡长时间可溶解
溶液变红色
加水先变成Na2CO3·10H2O晶体,比NaHCO3易溶,溶液的碱性比NaHCO3强
比Na2CO3难溶,溶液的碱性比Na2CO3弱
初步结论
纯碱、苏打
小苏打
(2)Na2CO3和NaHCO3的热稳定性
Na2CO3稳定受热不分解
NaHCO3不稳定,受热可分解
澄 清石灰水不变浑浊
2NaHCO3===Na2CO3+H2O+CO2↑
实验3-18
①Na2CO3 ②
①现象:
②现象:
澄 清石灰水变浑浊
结论:
(3)Na2CO3和NaHCO3盐酸的反应
Na2CO3 NaHCO3
逐滴滴入HCl的现象
反应方程式及离子方程式
刚开始滴入,没有明显现象,后来反应较剧烈,有气泡产生
刚开始滴入,反应很剧烈,有气泡产生
Na2CO3+HCl=NaHCO3+NaCl
CO32-+H+=HCO3-
NaHCO3+HCl=NaCl+H2O+CO2↑
HCO3-+H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
总结
Na2CO3
NaHCO3
俗 名
水溶性
溶液碱性
小苏打
纯碱 苏打
易溶(比NaHCO3易溶)
可溶
较强
较弱
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
稳定,加热难分解
不稳定,加热可分解
2NaHCO3==Na2CO3+H2O+CO2↑
热稳定性
Na2CO3+HCl=NaHCO3+NaCl
与酸反应
与某些碱反应
Na2CO3+ Ca(OH)2=CaCO3
+2NaOH
NaHCO3+NaOH=Na2CO3+H2O
2.铁盐
(1)Fe3+离子的检验
向FeCl3和FeCl2溶液中分别加入KSCN溶液
滴入KSCN溶液
FeCl3溶液
FeCl2溶液
溶液呈血红色
溶液颜色无变化
交流和讨论: 有哪些方法可以鉴别FeCl3溶液和FeCl2溶液
亚铁(Fe 2+)盐
铁(Fe 3+)盐
(1)颜色:Fe 2+ Fe3+ .
Fe2+ 和Fe3+的鉴别方法
浅绿色
黄色
(2)SCN- 法:滴入KSCN溶液或其他可溶性硫氰化物的溶液,呈 色的是Fe 3+
血红
(3)碱液法:分别加入碱液(或氨水),生成 色沉淀是Fe3+溶液,先生成
色沉淀,又迅速转变为 色,最后变
为 的是Fe2+溶液
红褐
白
灰绿
红褐
(2)Fe3+离子的氧化性
实验1:在FeCl3溶液中加入Fe粉,振荡。再滴入几滴KSCN溶液
现象:
结论:
2FeCl3 + Fe == 3FeCl2
反应方程式:
(氧化剂)
(还原剂)
离子方程式:
2FeCl3 + Cu == 2FeCl2+CuCl2
(氧化剂)
(还原剂)
溶液不显血红色
溶液中不含Fe3+
2Fe3+ + Fe == 3Fe2+
金属铜也能将Fe3+还原:
实验2:在以上所得到的FeCl2和KSCN的混合溶液中,滴加氯水(Cl2)
现象:
溶液变成血红色
结论:
原溶液中的Fe2+转变成Fe3+
反应方程式:
2FeCl2 + Cl2 == 2FeCl3
氧化剂
还原剂
总结:
还原剂
+氧化剂(Cl2)
+还原剂(Fe)
氧化剂
Fe2+
Fe3+
离子方程式:
2Fe2+ + Cl2 == 2Fe3+ +2Cl-
2. 铝盐
偏铝酸钠(NaAlO2)
明矾[KAl(SO4)2·12H2O]
偏铝酸钠(NaAlO2)与酸的反应:
实验:
在NaAlO2溶液中滴入盐酸
现象:
产生白色沉淀,后消失。
反应方程式:
NaAlO2+HCl+H2O=NaCl+Al(OH)3↓
离子方程式:
AlO2-+H++H2O=Al(OH)3↓
Al(OH)3↓+3HCl=AlCl3+3H2O
Al(OH)3↓+3H+=Al3++3H2O
明矾[KAl(SO4)2·12H2O]可用作净水剂
科学探究:铝盐和铁盐的净水作用
不加试剂
加入明矾
加入硫酸铁溶液
2min
5min
无明显变化
有明显沉降溶液半透明
有明显沉降溶液半透明
沉淀沉在底部溶液接近透明
沉淀沉在底部溶液接近透明
浑浊 , 略有沉降
明矾和硫酸铁溶液可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,可用做净水剂
结 论
3.焰色反应
很多金属或它们的化合物在灼烧时都会使火焰呈现特殊的颜色,这在化学上叫做焰色反应
①我们在炒菜的时候,偶有食盐溅在煤气火焰上,火焰呈
黄色
②钠燃烧时,火焰呈
黄色
实验:用铂丝分别蘸取碳酸钠溶液和碳酸钾溶液,在火焰上灼烧
问题
1.铂丝为什么要用盐酸洗涤
2.为什么要用蓝色钴玻璃观察钾的焰色
滤光
除去粘在铂丝上的杂质
一些金属及化合物的焰色反应
黄色
紫色
砖红色
洋红色
绿色
紫红色
黄绿色
Li
Na
K
Ca
Sr
Ba
Cu
第三节
《用途广泛的金属
材料》
第三章 金属及其化合物
思考与交流:下列物品都使用了哪种材料
一、常见合金的重要应用
二、正确选用金属材料
三、课堂互动
四、整合拓展
一、常见合金的重要应用
学与问:
初中曾学过有关合金的一些知识,你还记得什么是合金吗?合金有哪些优良的性质?
你知道合金在生活中有哪些用途吗?举出一些例子。
合金是由一种金属跟其它一种或几种金属(或金属跟非金属)一起熔合而成的具有金属特性的物质。合金属于混合物。
合金具有许多优良的物理、化学或机械性能,在许多方面不同于各组分金属,例如,合金的硬度一般比它的各成分金属的大,合金的熔点比各成分的金属低。
在工农业生产和日常生活中,我们很少使用纯金属,而主要使用合金,常见的合金有铜合金、铁合金和铝合金。
1、铜合金:我国使用最早的合金
青铜:主要含铜和锡,有良好的强度和塑性、耐磨、耐腐蚀,主要用于制机器零件如轴承、齿轮等。
黄铜:主要含铜和锌,有良好的强度和塑性、易加工、耐腐蚀,主要用于制机器零件、仪表和日用品。
白铜:主要含铜和镍,它不容易生铜绿,常用于制造精密仪器和装饰品。
相关网址:
http:///ziyuan/mdv/juniorchem/html/6/index.htm
相关网址:
http://jdqx21cn./heheqingtong/index3.htm
钢的种类
生铁与钢的比较
其它几种常见合金的组成、性质和用途
2.钢:用量最大,用途最广的合金
铁的合金 生铁 钢
C% 2%-4.3% 0.03%-2%
其它杂质 Si、Mn、S、P
(较多) Si、Mn、S、P
(较少)
机械性能 质硬而脆、
无韧性 坚硬、韧性大、 可塑性好。
钢
碳素钢:
铁和碳的合金
合金钢:在碳素钢中加
入铬、锰、钨、镍、钼、
钴等合金元素(如不锈钢)
低碳钢
含碳量低于0.3%
中碳钢
含碳量0.3%~0.6%
高碳钢
含碳量高于0.6%
名称 组成 主要性质 主要用途
铝合金 含有10%~30%的镁 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
硬铝 含铜4%、镁0.5%、锰0.5%、硅0.7% 硬度和强度都比纯铝和纯镁大 火箭、飞机、轮船等制造业
钛合金 含铝6%、钒4% 耐高温、耐腐蚀、高强度 用于飞机、宇航、化学工业
金合金 加入银、铜、稀土元素等 有光泽、易加工、耐磨耐腐蚀 金饰品、电子元件、钱币、笔尖
二、正确选用金属材料
思考与交流
实践活动
科学视野
思考与交流:
某家庭准备装修窗户(计划使用10年),可供选用的材料有:木材、钢铁、铝合金、塑钢。请调查分析选用哪种材料比较好?说明理由。
选用材料时,常常考虑经下几个方面:主要用途、外观、物理性质、化学性质、价格、加工难度、日常维护、对环境的影响等。
2003年底以来全国各地建筑材料价格都出现了上涨的情况。比如,钢材涨价超过了50%,水泥涨价超过了30%,木材涨价超过了10%。
调查报告
调查内容 家庭装修时材料的选用 指导老师
调查组成员 组长
背景介绍:某家庭准备装修窗户(计划使用10年),可供选用的材料有:木材、钢铁、铝合金、塑钢。请调查分析选用哪种材料比较好?
调查目的与意义:
调查内容与结果:
实践活动:
角色扮演:是否应该停止使用铝质饮料罐
铝质饮料罐
在饮料业的
发展中起到
了举足轻重
的作用,至
今仍广泛使
用,请你扮
演不同的角
色,分析是
否应该停止
使用铝质饮
料罐。
调查报告
调查内容 是否应该停止使用铝质饮料罐 指导老师
调查组成员 组长
扮演角色:
观点: 论据:
结论:
结合调查并查阅有关资料写一篇有产铝质饮料罐的小论文。
科学视野:
相关网址:中国稀土在线
http://www.cre-/soft/newmaterindex/newmaterin.htm
中国的改革总
设计师邓小平
同志早在1992
年春南巡时就
指出:“中东有石油,中国有
稀土,……一
定要把稀土的
事情办好,把
中国稀土的优
势发挥出来。”
2 、人类历史上大量生产和使用铝、铁、钛、
铜四种金属的时间顺序是( )
A。铜、铁、铝、钛
B。铁、铝、铜、钛
C。铜、铁、钛、铝
D。铁、铜、铝、钛
1、下列物质中,不属于合金的是( )
A、硬铝 B、黄铜
C、钢铁 D、水银
D
A
三、课堂互动
3、 我国在春秋战国时期,就懂得将白铁褪火
处理得到相当于铸钢的物器(如锋利的宝剑)
,这一技术要比欧洲早就两千年,那么白铁
褪火处理的主要作用是( )
A、除去硫、磷杂质
B、适当降低了含碳量
C、渗入了合金元素
D、改善表面的结构性质
B
四、整合拓展
1、本节教材内容的知识网络:
用途广泛的金属材料
常见合金的重要应用
正确选用金属材料
铜合金
钢
2、金属的分类
金属
冶金工业分
黑色金属:铁、铬、锰
有色金属:除铁、铬、锰以外的金属
按密度分
重金属 :密度4.5g/cm3以上
轻金属 :密度4.5g/cm3以下
按接触概率分
常见金属:如铁、铝、铜等
稀有金属:如锆、铌、钼等
3、金属的冶炼
目前工业上冶炼金属常用的方法有:
热分解法
适用范围:在金属活动顺序中,位于氢后面的金属。
热还原法
大多数金属的冶炼适用于此法。
电解法
钾、钙、钠、铝等活泼金属,只能用电解其熔融盐或氧化物的方法制解。
把金属从矿石中提炼出来,这个过程就叫金属的冶炼。
从金属矿石中提炼金属一般需经过三个步骤:(1)矿石的采集;(2)冶炼;(3)精炼。
世界近代史上,钢铁是国力最重要的标志. 尽管三千多年前商代的青铜器已表明我国古代无与伦比的冶炼技术,但直到晚清的洋务运动才开始发展钢铁工业,而1949年共和国建立时只有区区的15万吨。
1996年起,我国钢产量突破了一亿吨,跃居世界第一,据中国钢铁工业协会的预测,2004年我国钢产量将达到2.6亿吨,比2003年增长
16.9%,钢材消费量将达到2.8亿吨左右,比2003年增长13%左右。
炼钢过程
人类还准备向宇宙要铁,1970年前苏联空间站“月亮-16”首先从月球带回了铁矿石样品。人们发现月球上的铁矿石含有极微小的纯铁颗粒,它们毫无氧化痕迹。另人惊奇的是,月球铁在地球环境下仍然不易氧化。后来相继从月球带回不少月亮铁样品,几年后也不锈蚀。经过大量的模拟月亮环境条件的试验,并采用光谱分析,结论是:月亮上没有大气层保护,因而受到太阳风——一种粒子流的冲击之后,铁具有了对氧的稳定免疫性,到了地球上仍能抗拒氧的锈蚀。这就给我们提供了一种新的金属表面处理方法——用人为的粒子流冲击金属表面。
专家们设计了一种从月球矿石提取铁的特殊装置,其工作原理是:利用透镜聚集太阳光熔化矿石,随后由太阳能供电进行电解,使金属铁从其他杂质中分离出来。据估计,这种装置只有书桌大小,却可日产1吨铁。另外由于气压极低,铁在月亮上可出现升华现象,可以利用这种特点设计“炼铁”的特殊装置。
