2.4《归纳与整理-第二章 化学物质及其变化》PPT课件(新人教版-必修1)
文档属性
| 名称 | 2.4《归纳与整理-第二章 化学物质及其变化》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 88.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 00:00:00 | ||
图片预览



文档简介
(共21张PPT)
新课标人教版课件系列
《高中化学》
必修1
2.4《归纳与整理-
第二章 化学物质及
其变化》
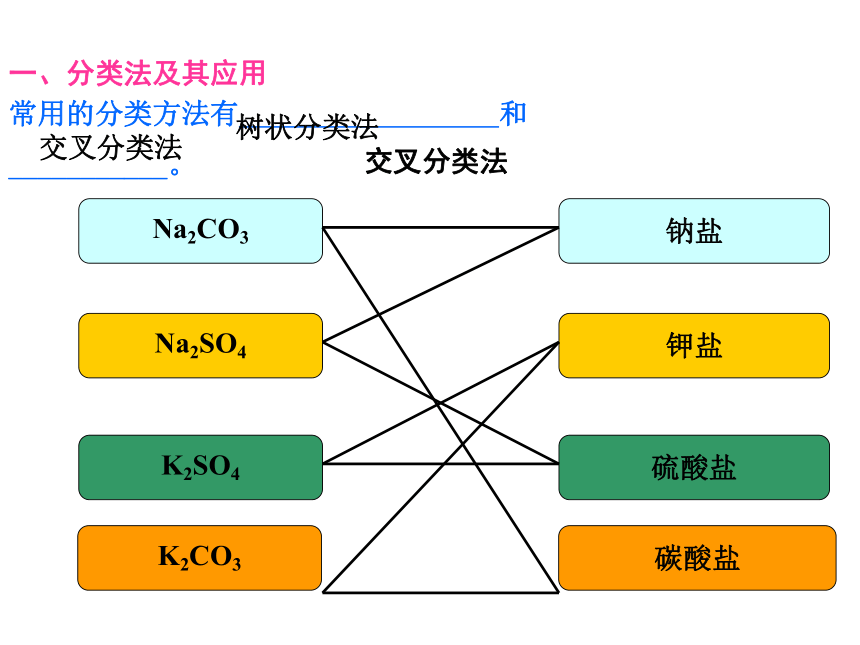
Na2CO3
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
钠盐
交叉分类法
常用的分类方法有 和
___________。
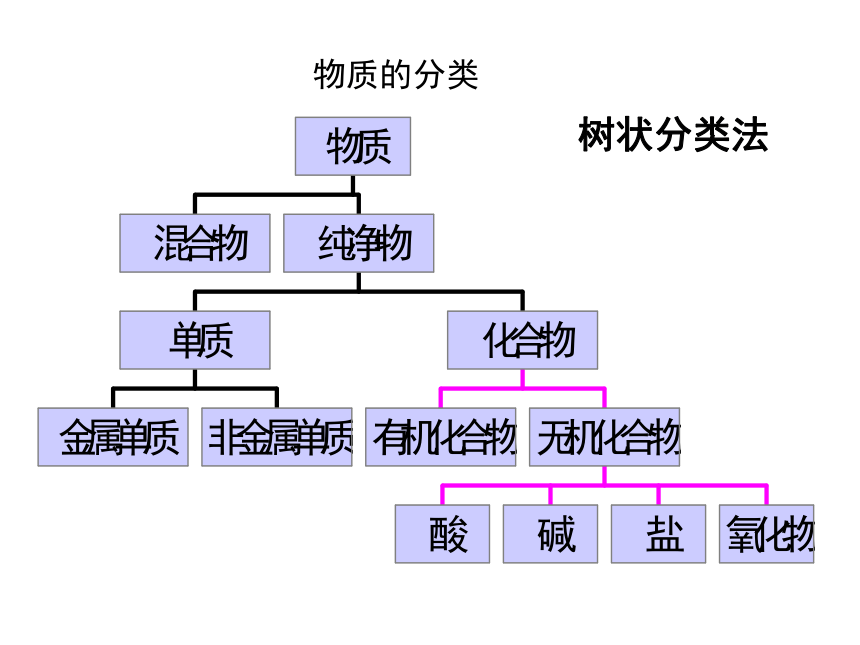
一、分类法及其应用
树状分类法
交叉分类法
物质的分类
树状分类法
1、分散系:
概念:把一种物质或几种物质分散到另一种或多种物质里所得到的体系(混合物)。
在分散系中,被分散的物质叫分散质,分散质分散于其中的物质叫做分散剂。
二、分散系及其分类
2、分类:
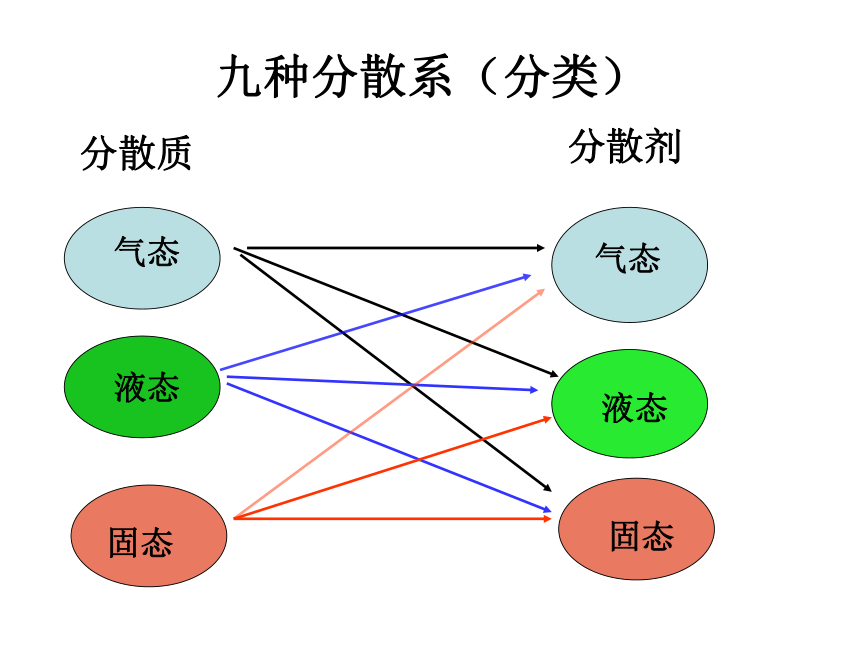
(1)按照分散质或分散剂所处的状态,可以有九种组合方式。
九种分散系(分类)
分散质
分散剂
气态
液态
固态
固态
液态
气态
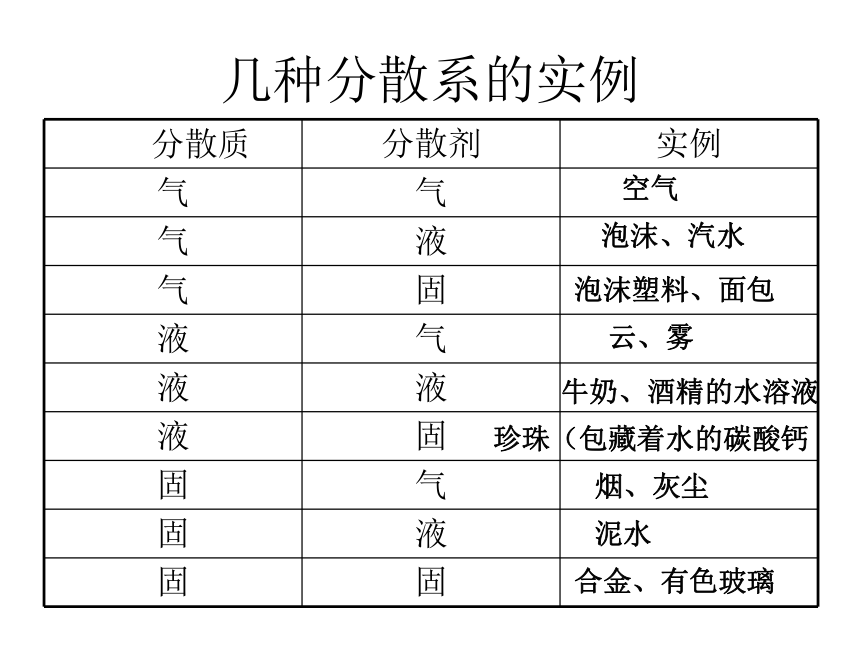
几种分散系的实例
分散质 分散剂 实例
气 气
气 液
气 固
液 气
液 液
液 固
固 气
固 液
固 固
空气
泡沫、汽水
泡沫塑料、面包
云、雾
牛奶、酒精的水溶液
珍珠(包藏着水的碳酸钙
烟、灰尘
泥水
合金、有色玻璃
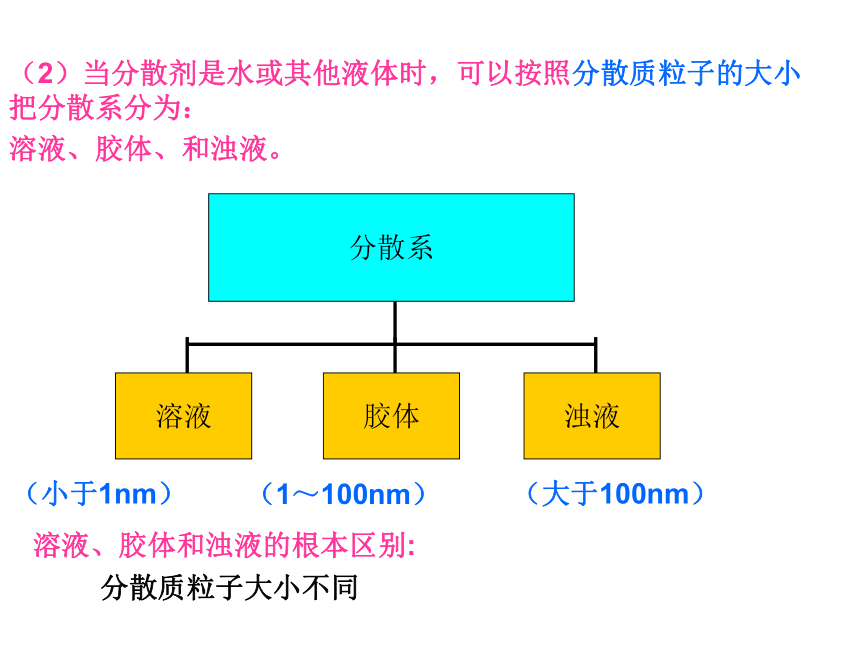
(2)当分散剂是水或其他液体时,可以按照分散质粒子的大小把分散系分为:
溶液、胶体、和浊液。
溶液、胶体和浊液的根本区别:
分散质粒子大小不同
分散系
溶液
胶体
浊液
(小于1nm)
(1~100nm)
(大于100nm)
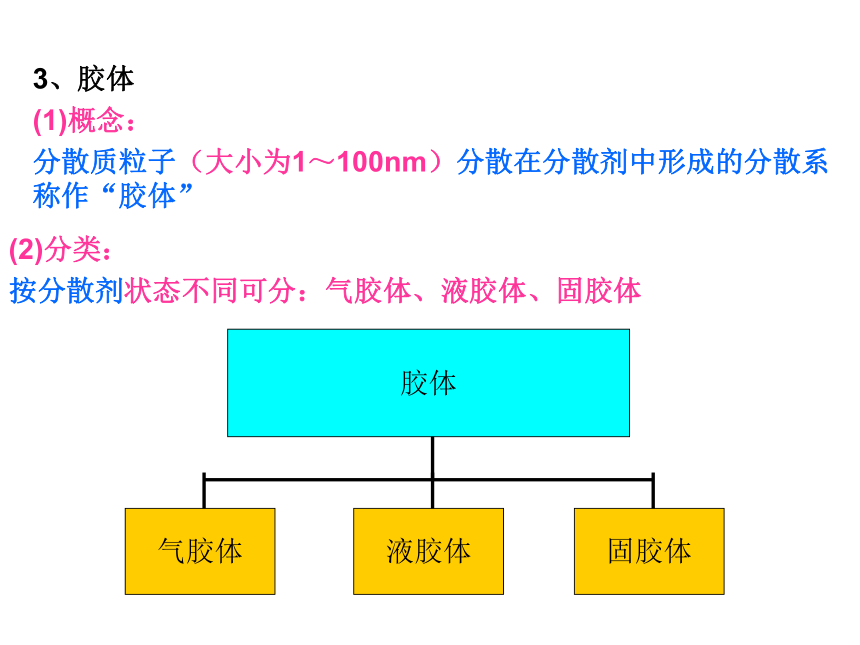
3、胶体
(1)概念:
分散质粒子(大小为1~100nm)分散在分散剂中形成的分散系称作“胶体”
胶体
气胶体
液胶体
固胶体
(2)分类:
按分散剂状态不同可分:气胶体、液胶体、固胶体
科学探究:丁达尔效应
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
能看见一条光亮的通路
无光亮的通路
结论:当光束通过胶体时,能看见一条光亮的通路,而溶液没有,可以利用丁达尔效应来区分溶液和胶体。
CuSO4溶液
Fe(OH)3胶体
科学探究:胶体能过滤吗?
过滤后的现象
Fe(OH)3胶体
泥水
分散质随分散剂透过滤纸
分散质不能通过滤纸
结论:胶体粒子能通过滤纸,不能利用过滤的方法分离胶体中的分散质和分散剂。
三、物质的化学变化
化学反应
根据反应物和生成物的类别及反应前后物质种类的多少
四大基本反应类型
根据反应中是否有离子参加
离子反应
根据反应中是否有电子转移
氧化还原反应
非离子反应
非氧化还原反应
1.反应分类
化合反应
分解反应
置换反应
复分解反应
氧化还原反应方程式 编号 化学基本反应类型 是否为氧化还原反应
A
B
CaO+H2O = Ca(OH)2 C
2Al2O3==4Al+3O2 D
CaCO3==CaO+CO2 E
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH F
Fe+CuSO4==FeSO4+Cu G
HCl+NaOH=NaCl+H2O H
CuO+H2 Cu+H2O
2 Mg+O2 2MgO
化合反应(B、C)
分解反应(D、E)
置换反应(A、G)
复分解反应(F、H)
化学基本反应类型
化学反应
氧化还原反应
非氧化还原反应
反应中有电子转移
元素化合价升降
电子得失(或元素化合价升降)总数相等
四、氧化还原反应
氧化还原反应的本质是电子转移,特征是化合价变化。“氧化”和“还原” 同时存在、不可分割的。
还原剂 + 氧化剂 == 氧化产物+还原产物
还原剂被氧化
氧化剂被还原
4Al + 3O2 == 2Al2O3
点燃
+3
0
0
-2
化合价降低,得到电子、氧化剂被还原
化合价升高,失去电子,还原剂被氧化
O2 是氧化剂
Al是还原剂
Al2O3既是氧化产物又是还原产物
高
失
还
还
高 失 还
低
得
氧
氧
低 得 氧
对于任何氧化还原反应,都满足下列规律:
强氧化剂 + 强还原剂 = 还原产物+ 氧化产物
A
B
b
a
氧化性:A >a
还原性:B > b
五、离子共存问题
所谓离子在同一溶液中能大量共存,就是离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存
(1)相互结合成难溶物质的离子不能大量共存。
如: Ba2+和SO42— Ag+ 和Cl— Ca2+和CO32—
(2)相互结合成气体或挥发性物质的离子不能大量共存
如: H+与CO32— 、SO32—、HCO3—
(3)相互结合成难电离物质的离子不能大量共存
如: H+与 CH3COO— 、F—、OH—、ClO—;OH— 与NH4+
(4)弱酸酸式根离子与H+、OH—均不能大量共存
如: H+与HCO3— OH—与HCO3—
在无色溶液中可以大量共存的离子组是
A、 Na+、Cl—、NH4+、NO3— B、 Cu2+、SO42—、Cl—、Na+
C 、 Ca2+、CO32—、NO3—、Na+ D 、OH— 、HCO3—、K+、NO3—
注:无色溶液时应排除:浅绿色Fe2+ 黄色Fe3+ 蓝色Cu2+ 紫色MnO4—
酸性溶液,存在大量H+; 碱性溶液,存在大量OH—
(5)可发生氧化还原反应的离子均不能大量共存
如: H+ 、 NO3— 、Fe2+
电解质:在水溶液或熔融状态下,能够导电的化合物。
非电解质:在水溶液或熔融状态下都不能导电的化合物。
六、电解质与非电解质
强电解质和弱电解质
强电解质:
能全部电离成离子的电解质。
强酸、强碱、大部分盐。
弱电解质:
能部分电离成离子的电解质。
弱酸、弱碱、水。
存在电离平衡。
(1)强电解质——完全电离,用“=”
(2)弱电解质——部分电离,用“ ”
写、拆、删、查
可溶性的强电解质拆成离子形式,其它保留化学式
下列离子方程式正确的是 A.澄清的石灰水与稀盐酸反应
Ca(OH)2 + 2H+ === Ca2+ + 2H2O B.钠与水的反应 Na + 2H2O === Na+ + 2OH-+ H2↑ C.铜片插入硝酸银溶液中
Cu + Ag+ === Cu2+ + Ag D.大理石溶于醋酸的反应
CaCO3 + 2CH3COOH ===
Ca2+ + 2CH3COO- +CO2↑+ H2O
离子方程式的书写
新课标人教版课件系列
《高中化学》
必修1
2.4《归纳与整理-
第二章 化学物质及
其变化》
Na2CO3
Na2SO4
K2SO4
K2CO3
碳酸盐
硫酸盐
钾盐
钠盐
交叉分类法
常用的分类方法有 和
___________。
一、分类法及其应用
树状分类法
交叉分类法
物质的分类
树状分类法
1、分散系:
概念:把一种物质或几种物质分散到另一种或多种物质里所得到的体系(混合物)。
在分散系中,被分散的物质叫分散质,分散质分散于其中的物质叫做分散剂。
二、分散系及其分类
2、分类:
(1)按照分散质或分散剂所处的状态,可以有九种组合方式。
九种分散系(分类)
分散质
分散剂
气态
液态
固态
固态
液态
气态
几种分散系的实例
分散质 分散剂 实例
气 气
气 液
气 固
液 气
液 液
液 固
固 气
固 液
固 固
空气
泡沫、汽水
泡沫塑料、面包
云、雾
牛奶、酒精的水溶液
珍珠(包藏着水的碳酸钙
烟、灰尘
泥水
合金、有色玻璃
(2)当分散剂是水或其他液体时,可以按照分散质粒子的大小把分散系分为:
溶液、胶体、和浊液。
溶液、胶体和浊液的根本区别:
分散质粒子大小不同
分散系
溶液
胶体
浊液
(小于1nm)
(1~100nm)
(大于100nm)
3、胶体
(1)概念:
分散质粒子(大小为1~100nm)分散在分散剂中形成的分散系称作“胶体”
胶体
气胶体
液胶体
固胶体
(2)分类:
按分散剂状态不同可分:气胶体、液胶体、固胶体
科学探究:丁达尔效应
光束照射时的现象
Fe(OH)3胶体
CuSO4溶液
能看见一条光亮的通路
无光亮的通路
结论:当光束通过胶体时,能看见一条光亮的通路,而溶液没有,可以利用丁达尔效应来区分溶液和胶体。
CuSO4溶液
Fe(OH)3胶体
科学探究:胶体能过滤吗?
过滤后的现象
Fe(OH)3胶体
泥水
分散质随分散剂透过滤纸
分散质不能通过滤纸
结论:胶体粒子能通过滤纸,不能利用过滤的方法分离胶体中的分散质和分散剂。
三、物质的化学变化
化学反应
根据反应物和生成物的类别及反应前后物质种类的多少
四大基本反应类型
根据反应中是否有离子参加
离子反应
根据反应中是否有电子转移
氧化还原反应
非离子反应
非氧化还原反应
1.反应分类
化合反应
分解反应
置换反应
复分解反应
氧化还原反应方程式 编号 化学基本反应类型 是否为氧化还原反应
A
B
CaO+H2O = Ca(OH)2 C
2Al2O3==4Al+3O2 D
CaCO3==CaO+CO2 E
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH F
Fe+CuSO4==FeSO4+Cu G
HCl+NaOH=NaCl+H2O H
CuO+H2 Cu+H2O
2 Mg+O2 2MgO
化合反应(B、C)
分解反应(D、E)
置换反应(A、G)
复分解反应(F、H)
化学基本反应类型
化学反应
氧化还原反应
非氧化还原反应
反应中有电子转移
元素化合价升降
电子得失(或元素化合价升降)总数相等
四、氧化还原反应
氧化还原反应的本质是电子转移,特征是化合价变化。“氧化”和“还原” 同时存在、不可分割的。
还原剂 + 氧化剂 == 氧化产物+还原产物
还原剂被氧化
氧化剂被还原
4Al + 3O2 == 2Al2O3
点燃
+3
0
0
-2
化合价降低,得到电子、氧化剂被还原
化合价升高,失去电子,还原剂被氧化
O2 是氧化剂
Al是还原剂
Al2O3既是氧化产物又是还原产物
高
失
还
还
高 失 还
低
得
氧
氧
低 得 氧
对于任何氧化还原反应,都满足下列规律:
强氧化剂 + 强还原剂 = 还原产物+ 氧化产物
A
B
b
a
氧化性:A >a
还原性:B > b
五、离子共存问题
所谓离子在同一溶液中能大量共存,就是离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存
(1)相互结合成难溶物质的离子不能大量共存。
如: Ba2+和SO42— Ag+ 和Cl— Ca2+和CO32—
(2)相互结合成气体或挥发性物质的离子不能大量共存
如: H+与CO32— 、SO32—、HCO3—
(3)相互结合成难电离物质的离子不能大量共存
如: H+与 CH3COO— 、F—、OH—、ClO—;OH— 与NH4+
(4)弱酸酸式根离子与H+、OH—均不能大量共存
如: H+与HCO3— OH—与HCO3—
在无色溶液中可以大量共存的离子组是
A、 Na+、Cl—、NH4+、NO3— B、 Cu2+、SO42—、Cl—、Na+
C 、 Ca2+、CO32—、NO3—、Na+ D 、OH— 、HCO3—、K+、NO3—
注:无色溶液时应排除:浅绿色Fe2+ 黄色Fe3+ 蓝色Cu2+ 紫色MnO4—
酸性溶液,存在大量H+; 碱性溶液,存在大量OH—
(5)可发生氧化还原反应的离子均不能大量共存
如: H+ 、 NO3— 、Fe2+
电解质:在水溶液或熔融状态下,能够导电的化合物。
非电解质:在水溶液或熔融状态下都不能导电的化合物。
六、电解质与非电解质
强电解质和弱电解质
强电解质:
能全部电离成离子的电解质。
强酸、强碱、大部分盐。
弱电解质:
能部分电离成离子的电解质。
弱酸、弱碱、水。
存在电离平衡。
(1)强电解质——完全电离,用“=”
(2)弱电解质——部分电离,用“ ”
写、拆、删、查
可溶性的强电解质拆成离子形式,其它保留化学式
下列离子方程式正确的是 A.澄清的石灰水与稀盐酸反应
Ca(OH)2 + 2H+ === Ca2+ + 2H2O B.钠与水的反应 Na + 2H2O === Na+ + 2OH-+ H2↑ C.铜片插入硝酸银溶液中
Cu + Ag+ === Cu2+ + Ag D.大理石溶于醋酸的反应
CaCO3 + 2CH3COOH ===
Ca2+ + 2CH3COO- +CO2↑+ H2O
离子方程式的书写
