1.1《化学实验基本方法》PPT课件(新人教版-必修1)
文档属性
| 名称 | 1.1《化学实验基本方法》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 00:00:00 | ||
图片预览









文档简介
(共37张PPT)
新课标人教版课件系列
《高中化学》
必修1
第一节
《化学实验基本方法》
第一章 从实验学化学
教学目标
知识与能力:
1.体验科学探究的过程,学习运用以实验为基础的实证研究方法。 2.树立安全意识,能识别化学品安全使用标识,初步形成良好的实验工作习惯。 3.掌握物质过滤、蒸发操作的方法,能根据常见物质的性质设计除杂质方案。
情感目标:
1.树立绿色化学思想,形成环境保护的意识。2.能发现学习和生产、生活中有意义的化学问题,并进行实验探究
教学重点难点:
过滤、蒸发操作的掌握及应用。
实验准备:
(4人一组)烧杯(15)、玻璃棒(15)、过滤装置(15)、蒸发装置(15)、试管4×15、稀硝酸、氯化钡。
我们使用的高中化学教材
一、教科书的体系和内容结构
各模块都根据构成内容的基本线索,选择、安排具体内容,构建教材体系。
1.重视化学学科的基本知识和技能
2.反映化学与科学和技术及社会、生活实际的密切联系、作用和影响的教育内容和素材
3.体现化学学科的思想、观念及研究方法的内容和素材
基本线索
必修化学1、化学2
高中化学学习的原则、方法和要求
化学学习原则:
化学学习方法
化学学习要求
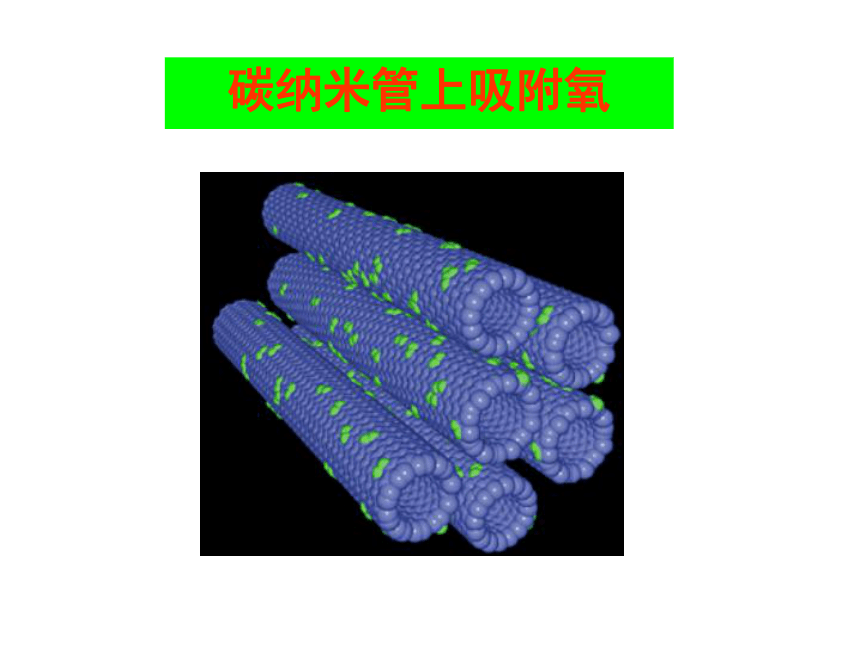
碳纳米管上吸附氧
引
言
1999年发现 O4 分子呈四边形结构
人造多面体超分子
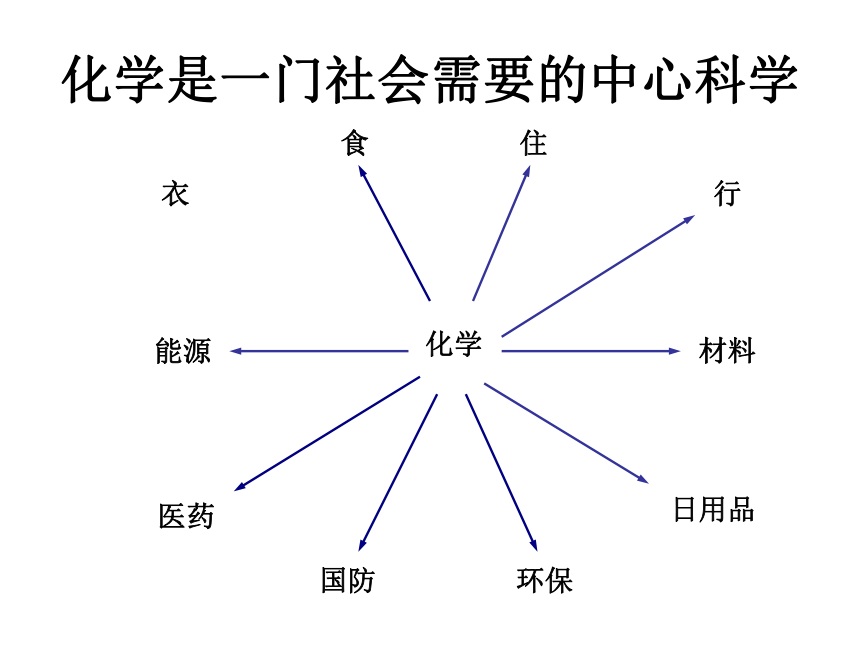
化学是一门社会需要的中心科学
化学
衣
食
住
行
能源
材料
医药
国防
环保
日用品
化学发展的标志
时间分辨
飞秒级 10-15s
空间分辨
原子级 10-10m
检测限
分子级 10-23mol
合成的化合物
[10-22s-- 1018s (100亿年)]
[10-18m-- 1026m(100亿光年)]
4683万种
化学是自然科学中一门承上启下的中心科学
物理学
信息科学
数 学
天文学
地 学
生命科学
材料科学
环境科学
化 学
化合物总数知多少?
1991年高考试题——第1000万种化合物
1996~1999每年登录新化合物超过100万
1999年底登录的化合物总数为 2340万种
2001.3 3013万种
2003.3 4683万种
2007.9 种
一、化学实验安全
1、实验室规则
2、安全措施
3、掌握正确的操作方法
中学化学实验室规则
一、实验课前要认真预习,理解实验的目的、步骤、操作及注意事项。?
二、准时进实验室,进实验室后要安静、守纪,不大声喧哗。?
三、爱护公物,严禁乱动水电开关,不经老师允许不得擅自做自己想做的实验。
四、实验前检查仪器,如有破损,及时报告和调换。实验后破损,及时报告和登记,酌情赔偿。?
五、注意安全,严格按照操作要求进行实验,实验后的废液应倒在指定的容器内,妥善处理易燃、易爆、易腐蚀及有毒物质。?
六、实验完毕,洗净仪器,清洁水槽,擦好桌子,并将仪器药品按要求放整齐,然后切断水、电,关好门窗。经老师检查,才可离开实验室。?
七、要严格执行以上各条规则,严重违反本实验室规定者,视情节轻重,报请学校领导给予纪律处分。
回顾与思考:
二、混合物的分离和提纯
在我们的日常生活和所接触的实验中,物质混合的常见形式有哪些?一般可采取哪些措施进行分离和提纯?
利用混合物中组分的性质(物理性质,如:溶解性不同等;化学性质,与物质反应的现象不同等)不同,除去杂质达到提纯的目的
分离和提纯:
1、过滤和蒸发 ①过滤:利用物质的可溶性不同分离
难溶物与可溶物 ②蒸发:利用溶液沸点不同加热使溶
剂挥发,分离溶质与溶剂 2、蒸馏与萃取 ①蒸馏:利用液体沸点不同,提纯液态纯净物 ②萃取:利用溶质在不同溶剂中的溶解度不同分离溶液
如:粗盐的提纯:
步 骤
现 象
1、
2、
3、
溶 解
过 滤
蒸 发
烧杯内为无色透明
溶液,滤纸有残物
有白色晶体析出
粗盐溶解有少量不
溶物
1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃 棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次
3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)接近蒸干时,利用余
热加热
(4)取下未冷却的蒸发
皿时,要放在石棉网
问题:
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?
过滤
NaCl、CaCl2、MgCl2、可溶性硫酸盐
沸点不同
NaCl、CaCl2、MgCl2、硫酸盐
除杂:
例:除去NaCl溶液中可能存在的
Na2SO4(验证是否有可溶性的硫酸盐存在)
实验1-2
实验:加BaCl2溶液(稀硝酸)
现象:
有白色难溶物生成
化学方程式:
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4:难溶于H2O、难溶于酸、经过滤除去
除杂原则:
不增
不减
易分
不加入新的物质
不消耗被提纯的物质
如:不能减少NaCl成分
杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO4
2、蒸馏和萃取
(1)蒸馏
利用液体混合物沸点不同
分析蒸馏过程:
原理
根据液态物质沸点不同
液态混合物 气(易挥发) 液态纯净物
△
冷凝
问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶
内物质?
控温显示加热范围
如:自来水蒸馏时
温度≈100℃
冷凝收集
在100℃难于挥发,
不挥发的杂质
蒸馏实验注意事项
①所盛液体不超过蒸馏瓶球部容积的 1/2 加热时,不能将液体蒸干
②温度计的水银球应位于蒸馏烧瓶的支管口下沿
③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸
④冷凝管中通冷却水时,下口( ),
上口( )
进水
出水
萃取
液体混合物中一种溶质在互不相溶的
溶剂里溶解性不同,用一种溶剂把溶质
从它与另一溶剂所组成的溶液中提取出
来.
概念分析
混合物
溶质
溶剂
(一种)
(两种)
溶解性不同
两者互不相溶
萃取液
萃取
分液漏斗
分液
使用分液漏斗注意事项:
1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,再静置
3、分液时,上层液体由上口倒出,下层液体由下端流出且分液漏斗下端紧贴烧杯内壁。
实验1-4 用CCl4萃取碘水(饱和)
现象
液体分层
上层液体显( )色
下层液体显( )色
黄
紫红
分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?
H2O
CCl4
四氯化碳(CCl4)
都能溶解碘单质( I2);都不与
碘单质( I2)反应。
异:
CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。
同:
萃取剂选择条件
1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应
如, CCl4不与I2反应
思考与讨论
1、根据实验1-4分析,请分总结CCl4性质?
2、将实验1-4中的萃取剂换为酒精是否可以?请说明原因
①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)
不可以,酒精与水互溶
新课标人教版课件系列
《高中化学》
必修1
第一节
《化学实验基本方法》
第一章 从实验学化学
教学目标
知识与能力:
1.体验科学探究的过程,学习运用以实验为基础的实证研究方法。 2.树立安全意识,能识别化学品安全使用标识,初步形成良好的实验工作习惯。 3.掌握物质过滤、蒸发操作的方法,能根据常见物质的性质设计除杂质方案。
情感目标:
1.树立绿色化学思想,形成环境保护的意识。2.能发现学习和生产、生活中有意义的化学问题,并进行实验探究
教学重点难点:
过滤、蒸发操作的掌握及应用。
实验准备:
(4人一组)烧杯(15)、玻璃棒(15)、过滤装置(15)、蒸发装置(15)、试管4×15、稀硝酸、氯化钡。
我们使用的高中化学教材
一、教科书的体系和内容结构
各模块都根据构成内容的基本线索,选择、安排具体内容,构建教材体系。
1.重视化学学科的基本知识和技能
2.反映化学与科学和技术及社会、生活实际的密切联系、作用和影响的教育内容和素材
3.体现化学学科的思想、观念及研究方法的内容和素材
基本线索
必修化学1、化学2
高中化学学习的原则、方法和要求
化学学习原则:
化学学习方法
化学学习要求
碳纳米管上吸附氧
引
言
1999年发现 O4 分子呈四边形结构
人造多面体超分子
化学是一门社会需要的中心科学
化学
衣
食
住
行
能源
材料
医药
国防
环保
日用品
化学发展的标志
时间分辨
飞秒级 10-15s
空间分辨
原子级 10-10m
检测限
分子级 10-23mol
合成的化合物
[10-22s-- 1018s (100亿年)]
[10-18m-- 1026m(100亿光年)]
4683万种
化学是自然科学中一门承上启下的中心科学
物理学
信息科学
数 学
天文学
地 学
生命科学
材料科学
环境科学
化 学
化合物总数知多少?
1991年高考试题——第1000万种化合物
1996~1999每年登录新化合物超过100万
1999年底登录的化合物总数为 2340万种
2001.3 3013万种
2003.3 4683万种
2007.9 种
一、化学实验安全
1、实验室规则
2、安全措施
3、掌握正确的操作方法
中学化学实验室规则
一、实验课前要认真预习,理解实验的目的、步骤、操作及注意事项。?
二、准时进实验室,进实验室后要安静、守纪,不大声喧哗。?
三、爱护公物,严禁乱动水电开关,不经老师允许不得擅自做自己想做的实验。
四、实验前检查仪器,如有破损,及时报告和调换。实验后破损,及时报告和登记,酌情赔偿。?
五、注意安全,严格按照操作要求进行实验,实验后的废液应倒在指定的容器内,妥善处理易燃、易爆、易腐蚀及有毒物质。?
六、实验完毕,洗净仪器,清洁水槽,擦好桌子,并将仪器药品按要求放整齐,然后切断水、电,关好门窗。经老师检查,才可离开实验室。?
七、要严格执行以上各条规则,严重违反本实验室规定者,视情节轻重,报请学校领导给予纪律处分。
回顾与思考:
二、混合物的分离和提纯
在我们的日常生活和所接触的实验中,物质混合的常见形式有哪些?一般可采取哪些措施进行分离和提纯?
利用混合物中组分的性质(物理性质,如:溶解性不同等;化学性质,与物质反应的现象不同等)不同,除去杂质达到提纯的目的
分离和提纯:
1、过滤和蒸发 ①过滤:利用物质的可溶性不同分离
难溶物与可溶物 ②蒸发:利用溶液沸点不同加热使溶
剂挥发,分离溶质与溶剂 2、蒸馏与萃取 ①蒸馏:利用液体沸点不同,提纯液态纯净物 ②萃取:利用溶质在不同溶剂中的溶解度不同分离溶液
如:粗盐的提纯:
步 骤
现 象
1、
2、
3、
溶 解
过 滤
蒸 发
烧杯内为无色透明
溶液,滤纸有残物
有白色晶体析出
粗盐溶解有少量不
溶物
1、固体溶解:
先将固体研细,溶解
时要搅拌,搅拌时玻
璃 棒不能碰击容器壁,
以防容器破损
2、过滤:
“一贴”,滤纸紧贴漏斗的内壁,中间不留有气泡(操作时要用手压住,用水润湿
“二低”,滤纸的边缘低于漏斗口,漏斗里的液体低于滤纸的边缘
“三靠”,倾倒液体的烧杯尖口要紧靠玻璃棒,玻璃棒的末端轻靠在三层滤纸的一边,漏斗下端的管口靠烧杯内壁。
若:滤液浑浊应再过滤一次
3、蒸发
(1)蒸发皿的液体不超过
容积的2/3
(2)加热时,用玻璃棒不
断搅拌
(3)接近蒸干时,利用余
热加热
(4)取下未冷却的蒸发
皿时,要放在石棉网
问题:
1、不溶性的泥沙与盐分离是哪一步骤?
2、过滤后,烧杯内的物质可能是哪些?
3、蒸发过程利用的是物质的什么性质?
4、蒸发后得到的盐的成分可能是么?
过滤
NaCl、CaCl2、MgCl2、可溶性硫酸盐
沸点不同
NaCl、CaCl2、MgCl2、硫酸盐
除杂:
例:除去NaCl溶液中可能存在的
Na2SO4(验证是否有可溶性的硫酸盐存在)
实验1-2
实验:加BaCl2溶液(稀硝酸)
现象:
有白色难溶物生成
化学方程式:
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaSO4:难溶于H2O、难溶于酸、经过滤除去
除杂原则:
不增
不减
易分
不加入新的物质
不消耗被提纯的物质
如:不能减少NaCl成分
杂质转换为沉淀、气体等易分离除去
如:将NaCl溶液中可能存在的
Na2SO4转换为沉淀BaSO4
2、蒸馏和萃取
(1)蒸馏
利用液体混合物沸点不同
分析蒸馏过程:
原理
根据液态物质沸点不同
液态混合物 气(易挥发) 液态纯净物
△
冷凝
问题:
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏瓶
内物质?
控温显示加热范围
如:自来水蒸馏时
温度≈100℃
冷凝收集
在100℃难于挥发,
不挥发的杂质
蒸馏实验注意事项
①所盛液体不超过蒸馏瓶球部容积的 1/2 加热时,不能将液体蒸干
②温度计的水银球应位于蒸馏烧瓶的支管口下沿
③蒸馏瓶内要加几颗沸石或瓷片,防止液体爆沸
④冷凝管中通冷却水时,下口( ),
上口( )
进水
出水
萃取
液体混合物中一种溶质在互不相溶的
溶剂里溶解性不同,用一种溶剂把溶质
从它与另一溶剂所组成的溶液中提取出
来.
概念分析
混合物
溶质
溶剂
(一种)
(两种)
溶解性不同
两者互不相溶
萃取液
萃取
分液漏斗
分液
使用分液漏斗注意事项:
1、使用前检查是否漏水
2、加入萃取液后要先倒转分液漏斗用力振荡,再静置
3、分液时,上层液体由上口倒出,下层液体由下端流出且分液漏斗下端紧贴烧杯内壁。
实验1-4 用CCl4萃取碘水(饱和)
现象
液体分层
上层液体显( )色
下层液体显( )色
黄
紫红
分析讨论
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 CCl4与H2O比较有何异同?
H2O
CCl4
四氯化碳(CCl4)
都能溶解碘单质( I2);都不与
碘单质( I2)反应。
异:
CCl4与H2O互不相溶;碘单质在CCl4中的溶解度大。
同:
萃取剂选择条件
1、与原溶剂互不相溶
如,CCl4与H2O互不相溶
2、溶解溶质的能力大于原溶剂
如, CCl4(I2)>H2O (I2)
3、不与被萃取的物质反应
如, CCl4不与I2反应
思考与讨论
1、根据实验1-4分析,请分总结CCl4性质?
2、将实验1-4中的萃取剂换为酒精是否可以?请说明原因
①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)
不可以,酒精与水互溶
