1.2.1《物质的量的单位-摩尔》PPT课件(新人教版-必修1)
文档属性
| 名称 | 1.2.1《物质的量的单位-摩尔》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 143.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 14:33:06 | ||
图片预览








文档简介
(共22张PPT)
新课标人教版课件系列
《高中化学》
必修1
1.2.1《物质的量的
单位-摩尔》
化学计量在实验中的应用(1)
教学目标
知识与能力
掌握物质的量的定义、符号及其单位摩尔的定义、符号等,了解它们的使用范围,使用时的注意事项,使学生对物质的量形成一定的印象。
掌握摩尔质量的概念,理解物质的量、摩尔质量、物质的质量之间的关系。
【教学重点】
物质的量及其单位、摩尔质量的概念和相关计算
【教学难点】物质的量及其单位、摩尔质量与相对原子质量、相对分子质量之间的关系
1g水约含有3.34×1022个水分子
2H2 + O2 = 2 H2O
2个氢气分子
1个氧气分子
1个水分子
----→微观粒子
4g
32g
36g
-----→宏观质量
[问题]
(1)怎样知道一定质量的物质里含有多少粒子
(2)如何把难见难称量的微观粒子和可见可称量的宏观物质联系起来
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
宏观物质
微观粒子
物质的量
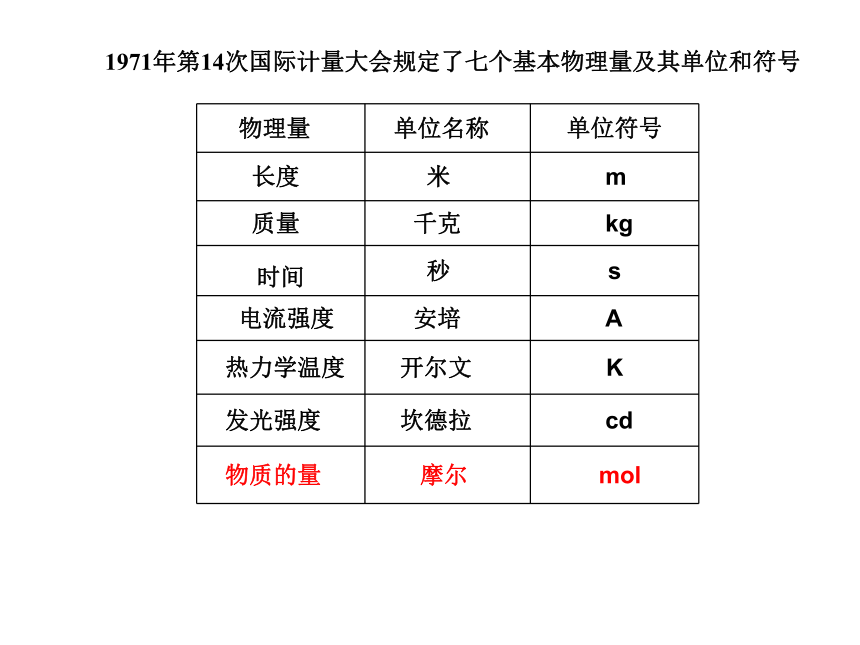
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流强度 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
物质的量 摩尔 mol
一、物质的量(n)
2、表示含有一定数目粒子的集体
1、是一个物理量,专用名词,不能增减
3、单位: 摩尔 (符号:mol)
二、摩尔(mol)——物质的量的单位
1、每摩尔物质含有阿伏加德罗常数个微粒
2、微粒──可以是分子、原子、离子,
电子、中子、质子等基本的粒子,也可
以是特定微粒的组合,但是一定要说明确。
●
●
3、使用摩尔作单位时,应用化学式(符号)指明粒子种类,而不能使用中文名称。
三、阿伏加德罗常数(NA)
1、定义:用12g12C所含的碳原子数叫
阿伏加德罗常数。
2、阿伏加德罗常数的近似值是:
6.02×1023mol-1
12g C :
0.012kg
1.993×10-26 kg/个
= 6.02×1023个
6.02×1023这个数非常庞大。如果把6.02×1023
个直径为2.5cm的硬币排成一行,
可以来回于地球与太阳之间240.8亿次。
6.02×1023
1mol粒子的粒子数
约为
阿伏加德罗常数
约为
0.012Kg12C中所含原子数
约为
练习 判断
1 1 mol 氧
2 0.25 mol CO2
3 摩尔为7个基本物理量之一
4 1 mol 是 6.02×1023 个粒子的集体
5 0.5 mol H2 有 3.01 ×1023 个氢原子
6 3 mol NH3 有3 mol N 原子, 9mol H 原子
3 mol H2SO4 中约有-----个H2SO4 ,可以电离出-----mol H+
4 mol O2含有------mol O原子,------mol质子
10 mol Na+中约含有-----Na+
填空
O2的物质的量 阿伏加德罗常数 粒子数
1mol × 6.02×1023 mol-1 = 6.02×1023
2mol × 6.02×1023 mol-1 = 1.204×1024
n ×NA = N
四、物质的量(n)、
阿伏加德罗常数(NA)、
粒子数(N)之间的关系
物质的量 =
微粒个数
阿伏加德罗常数
N个
NA个/mol
=
n( mol)
练习
已知一个氢原子的质量为1.674×10-24g,求
1molH的质量。
氢原子的质量m= 1.674×10-24g ×6.02×1023
=1.0g
数值上与氢原子的原子量相等
1mol氢原子的质量,以克为单位,
数值上与氢原子的原子量相等
微粒 C H O H2O
相对原子
(分子)质量
12 1 16 18
1mol的质量
12克
1克
16克
18克
1mol 物质的质量(g)在数值上
等于其相对原子(分子)质量
结论:
1mol任何微粒的质量都是以克为单位
数值上等于该物质化学式的式量
●
●
1molO2的质量为32克
1molNa+的质量为23克
1molNaCl的质量为58.5克
1molAl的质量为27克
五、物质的摩尔质量(M)
1、定义:单位物质的量的物质的质量叫物质的摩尔质量。
2、单位:g/mol或g.mol-1 , kg/mol
1mol
M =
m
n
物质的摩尔质量 =
物质的质量
物质的量
数值: 等于相对原子(分子)质量
总结:
物质的质量m、物质的量n、粒子数N之间的关系如下:
m
N
(÷M)
(×M)
(×NA)
(÷NA)
n
微观
宏观
练习:
3.01×1022个OH- 的物质的量为0.05mol,
质量为 ,
含有质子的物质的量为 ,
含有电子的物质的量为 ,
这些 OH- 与 NH3的质量相同,
这些 OH- 和 Na+含有的离子数相同。
0.85g
0.45mol
0.5mol
0.05mol
1.15g
练习:
将4g NaOH溶于多少克水中,才能使每100个H2O分子溶有一个Na+
解:n(Na+)= n(NaOH)=
m (NaOH)
M (NaOH)
= 4g÷40g/mol = 0.1 mol
n(H2O)= 100 × n(Na+)= 100 × 0.1mol
= 10mol
m(H2O)= n(H2O)× M(H2O)
= 10mol × 18g/mol = 180g
新课标人教版课件系列
《高中化学》
必修1
1.2.1《物质的量的
单位-摩尔》
化学计量在实验中的应用(1)
教学目标
知识与能力
掌握物质的量的定义、符号及其单位摩尔的定义、符号等,了解它们的使用范围,使用时的注意事项,使学生对物质的量形成一定的印象。
掌握摩尔质量的概念,理解物质的量、摩尔质量、物质的质量之间的关系。
【教学重点】
物质的量及其单位、摩尔质量的概念和相关计算
【教学难点】物质的量及其单位、摩尔质量与相对原子质量、相对分子质量之间的关系
1g水约含有3.34×1022个水分子
2H2 + O2 = 2 H2O
2个氢气分子
1个氧气分子
1个水分子
----→微观粒子
4g
32g
36g
-----→宏观质量
[问题]
(1)怎样知道一定质量的物质里含有多少粒子
(2)如何把难见难称量的微观粒子和可见可称量的宏观物质联系起来
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
∷
宏观物质
微观粒子
物质的量
1971年第14次国际计量大会规定了七个基本物理量及其单位和符号
物理量 单位名称 单位符号
长度 米 m
质量 千克 kg
时间 秒 s
电流强度 安培 A
热力学温度 开尔文 K
发光强度 坎德拉 cd
物质的量 摩尔 mol
一、物质的量(n)
2、表示含有一定数目粒子的集体
1、是一个物理量,专用名词,不能增减
3、单位: 摩尔 (符号:mol)
二、摩尔(mol)——物质的量的单位
1、每摩尔物质含有阿伏加德罗常数个微粒
2、微粒──可以是分子、原子、离子,
电子、中子、质子等基本的粒子,也可
以是特定微粒的组合,但是一定要说明确。
●
●
3、使用摩尔作单位时,应用化学式(符号)指明粒子种类,而不能使用中文名称。
三、阿伏加德罗常数(NA)
1、定义:用12g12C所含的碳原子数叫
阿伏加德罗常数。
2、阿伏加德罗常数的近似值是:
6.02×1023mol-1
12g C :
0.012kg
1.993×10-26 kg/个
= 6.02×1023个
6.02×1023这个数非常庞大。如果把6.02×1023
个直径为2.5cm的硬币排成一行,
可以来回于地球与太阳之间240.8亿次。
6.02×1023
1mol粒子的粒子数
约为
阿伏加德罗常数
约为
0.012Kg12C中所含原子数
约为
练习 判断
1 1 mol 氧
2 0.25 mol CO2
3 摩尔为7个基本物理量之一
4 1 mol 是 6.02×1023 个粒子的集体
5 0.5 mol H2 有 3.01 ×1023 个氢原子
6 3 mol NH3 有3 mol N 原子, 9mol H 原子
3 mol H2SO4 中约有-----个H2SO4 ,可以电离出-----mol H+
4 mol O2含有------mol O原子,------mol质子
10 mol Na+中约含有-----Na+
填空
O2的物质的量 阿伏加德罗常数 粒子数
1mol × 6.02×1023 mol-1 = 6.02×1023
2mol × 6.02×1023 mol-1 = 1.204×1024
n ×NA = N
四、物质的量(n)、
阿伏加德罗常数(NA)、
粒子数(N)之间的关系
物质的量 =
微粒个数
阿伏加德罗常数
N个
NA个/mol
=
n( mol)
练习
已知一个氢原子的质量为1.674×10-24g,求
1molH的质量。
氢原子的质量m= 1.674×10-24g ×6.02×1023
=1.0g
数值上与氢原子的原子量相等
1mol氢原子的质量,以克为单位,
数值上与氢原子的原子量相等
微粒 C H O H2O
相对原子
(分子)质量
12 1 16 18
1mol的质量
12克
1克
16克
18克
1mol 物质的质量(g)在数值上
等于其相对原子(分子)质量
结论:
1mol任何微粒的质量都是以克为单位
数值上等于该物质化学式的式量
●
●
1molO2的质量为32克
1molNa+的质量为23克
1molNaCl的质量为58.5克
1molAl的质量为27克
五、物质的摩尔质量(M)
1、定义:单位物质的量的物质的质量叫物质的摩尔质量。
2、单位:g/mol或g.mol-1 , kg/mol
1mol
M =
m
n
物质的摩尔质量 =
物质的质量
物质的量
数值: 等于相对原子(分子)质量
总结:
物质的质量m、物质的量n、粒子数N之间的关系如下:
m
N
(÷M)
(×M)
(×NA)
(÷NA)
n
微观
宏观
练习:
3.01×1022个OH- 的物质的量为0.05mol,
质量为 ,
含有质子的物质的量为 ,
含有电子的物质的量为 ,
这些 OH- 与 NH3的质量相同,
这些 OH- 和 Na+含有的离子数相同。
0.85g
0.45mol
0.5mol
0.05mol
1.15g
练习:
将4g NaOH溶于多少克水中,才能使每100个H2O分子溶有一个Na+
解:n(Na+)= n(NaOH)=
m (NaOH)
M (NaOH)
= 4g÷40g/mol = 0.1 mol
n(H2O)= 100 × n(Na+)= 100 × 0.1mol
= 10mol
m(H2O)= n(H2O)× M(H2O)
= 10mol × 18g/mol = 180g
