1.2.3《物质的量浓度》PPT课件(新人教版-必修1)
文档属性
| 名称 | 1.2.3《物质的量浓度》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 91.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 00:00:00 | ||
图片预览








文档简介
(共23张PPT)
新课标人教版课件系列
《高中化学》
必修1
1.2.3《物质的量浓度》
化学计量在实验中的应用(3)
教学目标
知识与能力
1、使学生理解物质的量浓度的概念,了解物质的量浓度与质量分数的区别。
2、掌握配制一定物质的量浓度的溶液的方法。
重点、难点:
1、物质的量浓度的概念、有关物质的量浓度的简单计算
2、物质的量浓度与质量分数的区别
3、一定物质的量浓度的溶液的配制方法
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数= ×100%
溶质质量
溶液质量
一、物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L或mol/m3
含义:在1L溶液中含有1mol的溶质,这种溶液中溶质的物质的量浓度就是1mol/L。
符号:cB 表达式:cB=
nB
V
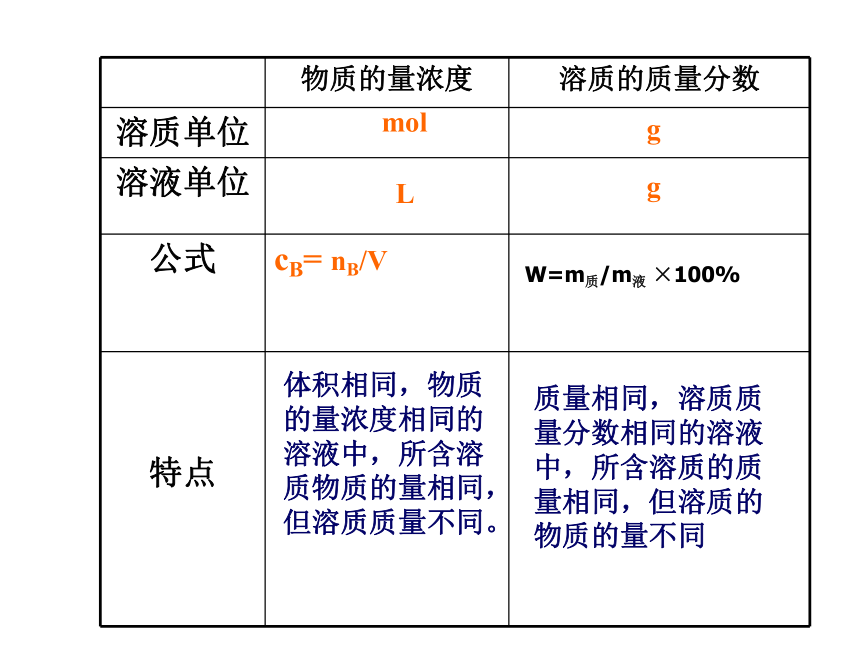
物质的量浓度 溶质的质量分数
溶质单位
溶液单位
公式 cB= nB/V
特点
mol
g
L
g
体积相同,物质的量浓度相同的溶液中,所含溶质物质的量相同,但溶质质量不同。
质量相同,溶质质量分数相同的溶液中,所含溶质的质量相同,但溶质的物质的量不同
W=m质/m液 ×100%
课堂练习
1、将40g NaOH溶于2L水中配成溶液,其物质的量浓度为0.5mol/L。这样叙述是否正确?为什么?
2、从1L3mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度是多少?
课堂练习
3、10mL1mol/L的硫酸溶液比100mL1mol/L的硫酸溶液的浓度小。这种说法是否正确,为什么?
4、现有0.2mol/L的K2SO4溶液,当取此溶液1L时,K+离子浓度是0.4mol/L,当取此溶液2L时,SO42-离子的浓度为0.4mol/L。这样说对吗?
运用物质的量浓度的概念计算
课堂练习
1、下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是
A、200mL0.5mol/LNaCl溶液
B、100mL1mol/LNa2CO3溶液
C、100mL0.5mol/LNa3PO4溶液
D、1L1mol/LNaOH溶液
D
2、在200mL某硫酸盐溶液中,含硫酸根离子1.5NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为
A、2.5mol/L B、5mol/L
C、7.5mol/L D、2mol/L
A
3、1mol/L的Na2SO4溶液是
A、溶液中含有1molNaSO4
B、1L溶液中含有142gNa2SO4
C、1molNa2SO4溶于1L水中
D、将322gNa2SO4.10H2O溶于少量水后再稀释成1000mL。
BD
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
课堂小结
复习提问
如何配制100g质量分数为5%的NaCl溶液?
计算溶质的质量和量取水的体积。
用天平称量5gNaCl。
用量筒量取95mL水。
在烧杯中溶解(把水的密度近似看作1g/cm3)。
二、一定物质的量浓度溶液的配制
在实验室用Na2CO3固体配制500mL0.1mol/LNa2CO3溶液
∵n(Na2CO3)=c(Na2CO3) ×V[Na2CO3(aq)]
=0.1mol/L×0.5L=0.05mol
∴m(Na2CO3)=n(Na2CO3) ×M(Na2CO3)
=0.05mol×106g/mol=5.3g
演示实验[3-1]
讨论与思考
1、为什么要将烧杯中的溶液冷却至室温后再转入容量瓶?
2、为什么要用蒸馏水洗涤烧杯内壁?为何要将洗涤烧杯后的溶液注入容量瓶中?
4、为何要改用胶头滴管滴加蒸馏水至刻度?
3、为什么要轻轻振荡容量瓶,使容量瓶中的溶液充分混合?
配制一定物质的量浓度的溶液步骤
计算:Na2CO3的质量
称量:(复的使用)
溶解:在烧杯中用100毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
转移:移入500mL容量瓶。
洗涤:洗涤烧杯两至三次。
定容:加水到接近刻度1-2厘米时,改用胶头滴管加水到刻度。
摇匀、贮存:存放于试剂瓶。
实验所需仪器
烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
误差分析及讨论
1、下列操作对实验结果有何影响(偏高、偏低、无影响)?
称量时,Na2CO3固体与砝码的位置颠倒。
天平的砝码生锈。
溶质溶解后没有恢复至室温就转移。
容量瓶内壁有水珠。
转移溶液时有部分液体溅出。
未用蒸馏水洗涤烧杯内壁。
2、视线误差分析
俯视(视线偏高)
仰视(视线偏低)
俯视或仰视刻度线对溶液浓度的影响
俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
小结:容量瓶的使用六忌
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器)
思考
1、如何用物质的量浓度为18.4mol/L、密度为1.84g/cm3的浓硫酸配制浓度1.84mol/L的稀硫酸500mL。
c(浓溶液)×V(浓溶液)=c(稀溶液) ×V(稀溶液)
2、如何用CuSO4·5H2O配制100mL1mol/LCuSO4溶液。
新课标人教版课件系列
《高中化学》
必修1
1.2.3《物质的量浓度》
化学计量在实验中的应用(3)
教学目标
知识与能力
1、使学生理解物质的量浓度的概念,了解物质的量浓度与质量分数的区别。
2、掌握配制一定物质的量浓度的溶液的方法。
重点、难点:
1、物质的量浓度的概念、有关物质的量浓度的简单计算
2、物质的量浓度与质量分数的区别
3、一定物质的量浓度的溶液的配制方法
1、什么叫溶液?溶液是由什么组成的?
一种或几种物质分散到另一种物质里形成均一的、稳定的混合物,叫做溶液。溶液由溶质和溶剂组成。
2、什么是溶液中溶质的质量分数?
溶质的质量分数= ×100%
溶质质量
溶液质量
一、物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L或mol/m3
含义:在1L溶液中含有1mol的溶质,这种溶液中溶质的物质的量浓度就是1mol/L。
符号:cB 表达式:cB=
nB
V
物质的量浓度 溶质的质量分数
溶质单位
溶液单位
公式 cB= nB/V
特点
mol
g
L
g
体积相同,物质的量浓度相同的溶液中,所含溶质物质的量相同,但溶质质量不同。
质量相同,溶质质量分数相同的溶液中,所含溶质的质量相同,但溶质的物质的量不同
W=m质/m液 ×100%
课堂练习
1、将40g NaOH溶于2L水中配成溶液,其物质的量浓度为0.5mol/L。这样叙述是否正确?为什么?
2、从1L3mol/L的NaOH溶液中取出50mL,则取出的溶液中溶质的物质的量浓度是多少?
课堂练习
3、10mL1mol/L的硫酸溶液比100mL1mol/L的硫酸溶液的浓度小。这种说法是否正确,为什么?
4、现有0.2mol/L的K2SO4溶液,当取此溶液1L时,K+离子浓度是0.4mol/L,当取此溶液2L时,SO42-离子的浓度为0.4mol/L。这样说对吗?
运用物质的量浓度的概念计算
课堂练习
1、下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是
A、200mL0.5mol/LNaCl溶液
B、100mL1mol/LNa2CO3溶液
C、100mL0.5mol/LNa3PO4溶液
D、1L1mol/LNaOH溶液
D
2、在200mL某硫酸盐溶液中,含硫酸根离子1.5NA个,含金属离子NA个,则该硫酸盐溶液的物质的量浓度为
A、2.5mol/L B、5mol/L
C、7.5mol/L D、2mol/L
A
3、1mol/L的Na2SO4溶液是
A、溶液中含有1molNaSO4
B、1L溶液中含有142gNa2SO4
C、1molNa2SO4溶于1L水中
D、将322gNa2SO4.10H2O溶于少量水后再稀释成1000mL。
BD
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
课堂小结
复习提问
如何配制100g质量分数为5%的NaCl溶液?
计算溶质的质量和量取水的体积。
用天平称量5gNaCl。
用量筒量取95mL水。
在烧杯中溶解(把水的密度近似看作1g/cm3)。
二、一定物质的量浓度溶液的配制
在实验室用Na2CO3固体配制500mL0.1mol/LNa2CO3溶液
∵n(Na2CO3)=c(Na2CO3) ×V[Na2CO3(aq)]
=0.1mol/L×0.5L=0.05mol
∴m(Na2CO3)=n(Na2CO3) ×M(Na2CO3)
=0.05mol×106g/mol=5.3g
演示实验[3-1]
讨论与思考
1、为什么要将烧杯中的溶液冷却至室温后再转入容量瓶?
2、为什么要用蒸馏水洗涤烧杯内壁?为何要将洗涤烧杯后的溶液注入容量瓶中?
4、为何要改用胶头滴管滴加蒸馏水至刻度?
3、为什么要轻轻振荡容量瓶,使容量瓶中的溶液充分混合?
配制一定物质的量浓度的溶液步骤
计算:Na2CO3的质量
称量:(复的使用)
溶解:在烧杯中用100毫升蒸馏水使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
转移:移入500mL容量瓶。
洗涤:洗涤烧杯两至三次。
定容:加水到接近刻度1-2厘米时,改用胶头滴管加水到刻度。
摇匀、贮存:存放于试剂瓶。
实验所需仪器
烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
误差分析及讨论
1、下列操作对实验结果有何影响(偏高、偏低、无影响)?
称量时,Na2CO3固体与砝码的位置颠倒。
天平的砝码生锈。
溶质溶解后没有恢复至室温就转移。
容量瓶内壁有水珠。
转移溶液时有部分液体溅出。
未用蒸馏水洗涤烧杯内壁。
2、视线误差分析
俯视(视线偏高)
仰视(视线偏低)
俯视或仰视刻度线对溶液浓度的影响
俯视刻度线,实际加水量未到刻度线,使溶液的物质的量浓度增大;
仰视刻度线,实际加水量超过刻度线,使溶液的物质的量浓度减小。
小结:容量瓶的使用六忌
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液(洒到外面)
三忌加水超过刻度线(浓度偏低)
四忌读数仰视或俯视(仰视浓度偏低, 俯视浓度偏高)
五忌不洗涤玻璃棒和烧杯(浓度偏低)
六忌标准液存放于容量瓶(容量瓶是量器,不是容器)
思考
1、如何用物质的量浓度为18.4mol/L、密度为1.84g/cm3的浓硫酸配制浓度1.84mol/L的稀硫酸500mL。
c(浓溶液)×V(浓溶液)=c(稀溶液) ×V(稀溶液)
2、如何用CuSO4·5H2O配制100mL1mol/LCuSO4溶液。
