2.0《化学物质及其变化》PPT课件(新人教版-必修1)
文档属性
| 名称 | 2.0《化学物质及其变化》PPT课件(新人教版-必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 727.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 00:00:00 | ||
图片预览






文档简介
(共81张PPT)
新课标人教版课件系列
《高中化学》
必修1
第二章
《化学物质及其变化》
教学目标
1、巩固物质的分类及方法,了解胶体的主要性质。
2、进一了解离子反应的本质及离子方程式书写。
3、进一步了解氧化还原反应的实质及有关基本概念。
教学重点:
1、离子反应的本质及离子方程式书写。
2、氧化还原反应的实质及有关基本概念。
第二章《化学物质及其变化》
第一节
物质的分类
第二章 化学物质及其变化
第一节 物质的分类
图1、图书馆陈列的图书
图2、商场摆放的商品
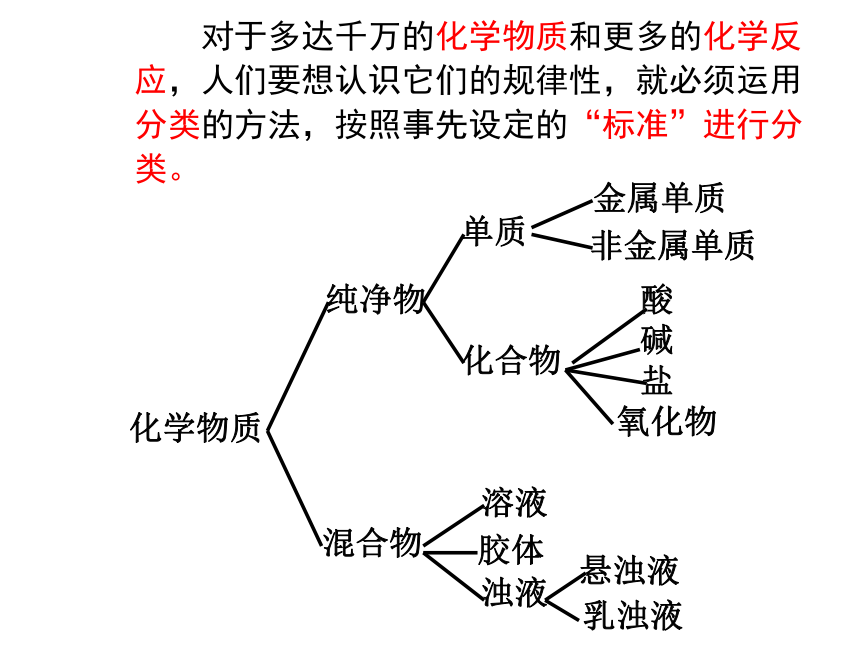
对于多达千万的化学物质和更多的化学反应,人们要想认识它们的规律性,就必须运用分类的方法,按照事先设定的“标准”进行分类。
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
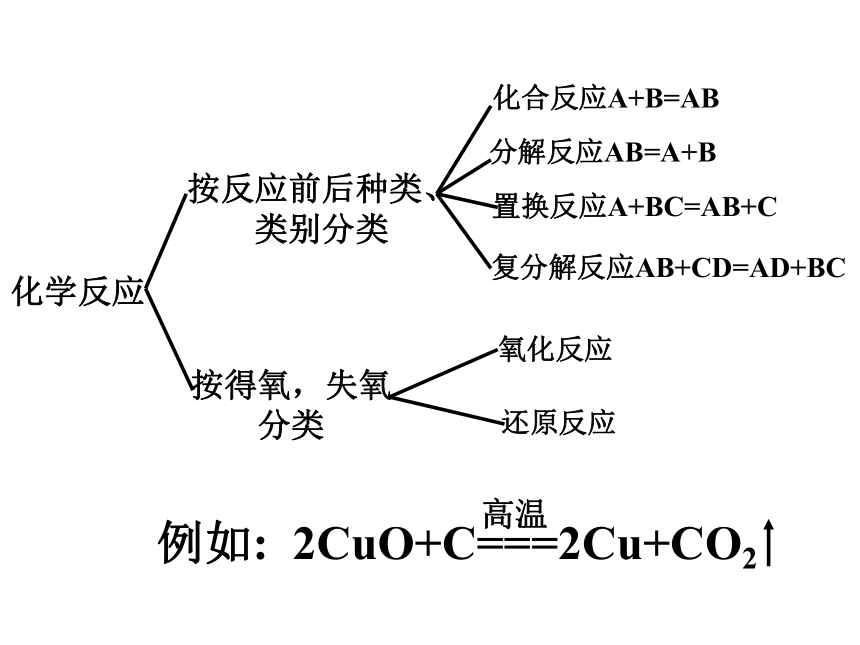
化学反应
按反应前后种类、类别分类
按得氧,失氧分类
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AB+C
复分解反应AB+CD=AD+BC
氧化反应
还原反应
例如: 2CuO+C===2Cu+CO2
高温
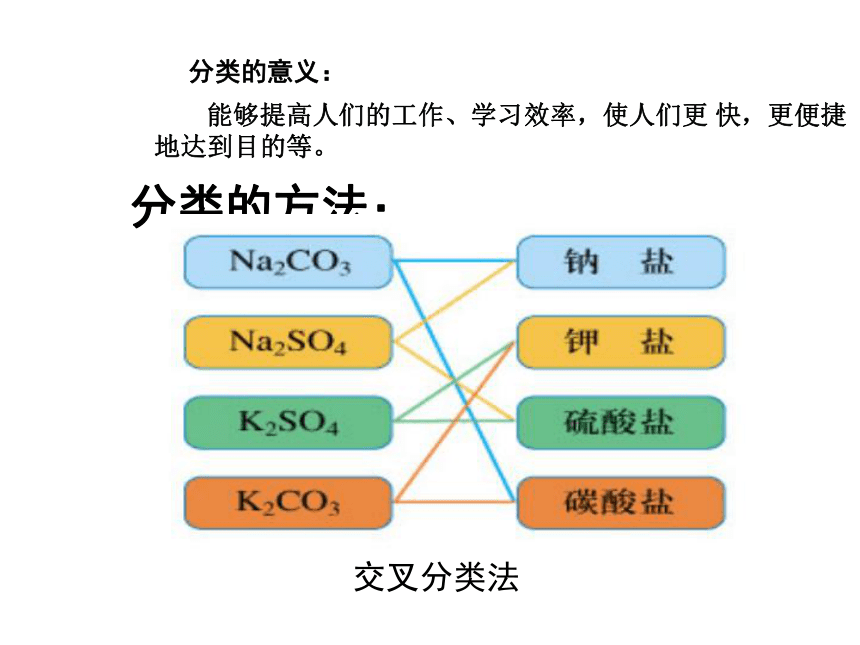
分类的方法:
交叉分类法
能够提高人们的工作、学习效率,使人们更 快,更便捷地达到目的等。
分类的意义:
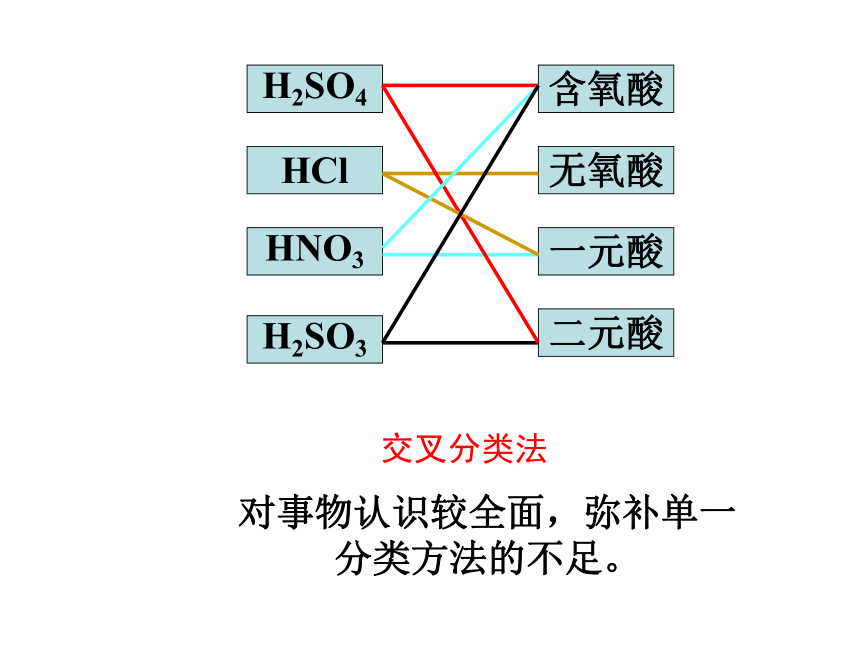
H2SO4
HCl
HNO3
H2SO3
含氧酸
无氧酸
一元酸
二元酸
交叉分类法
对事物认识较全面,弥补单一分类方法的不足。
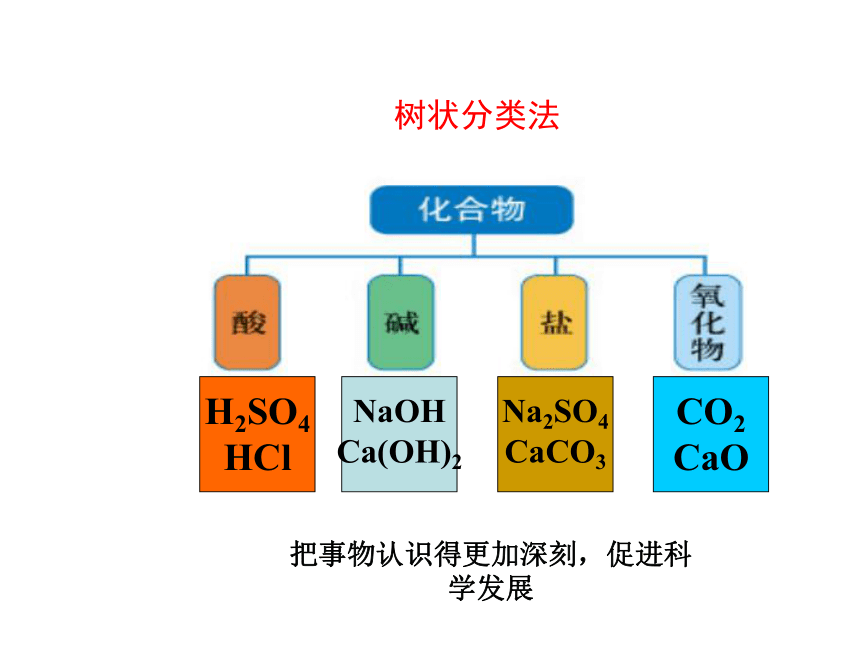
树状分类法
H2SO4
HCl
NaOH
Ca(OH)2
Na2SO4
CaCO3
CO2
CaO
把事物认识得更加深刻,促进科学发展
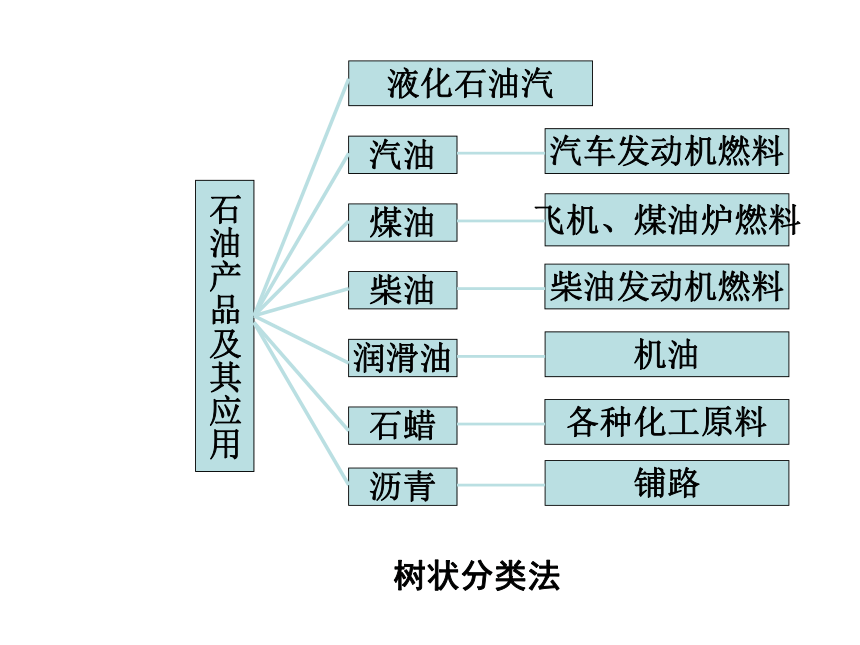
石油产品及其应用
汽油
煤油
柴油
润滑油
石蜡
沥青
液化石油汽
汽车发动机燃料
飞机、煤油炉燃料
柴油发动机燃料
机油
各种化工原料
铺路
树状分类法
1、下列物质按不同的分类标准选择,可选出
与其他三项不属同类的物质?
(1)选___. 标准是________________.
(2)选___. 标准是________________.
A. 盐酸 B. 浓硫酸 C. 硝酸溶液
D. 纯碱
2、按照物质的组成和性质,对纯净物进
行分类,作出树状分类图,然后选择下列
合适的物质类别上.
O2 Cu 硫酸溶液 Ba(OH)2 KNO3
CO2 空气
D
其它三种都是溶液
D
其它三种都是酸
九种分散系(分类)
分散系及其分类
把一种(或多种)物质分散在另一种(或多种)物质所得到的体系,叫做分散系。前者属于被分散物质,称做分散质;后者起容纳分散质的作用,称做分散剂
按照分散质或分散剂的聚集状态(气、固、液)来分,有9种类型:
分散质 分散剂 实 例
汽 汽 空气
液 汽 云、雾
固 汽 烟灰尘
汽 液 泡沫
液 液 牛奶、酒精的水溶液
固 液 糖水、油漆
汽 固 泡沫塑料
液 固 珍珠(包藏着水的碳酸钙)
固 固 有色玻璃、合金
分散系的分类
分散系 分散质粒子大小 主要特征 举例
溶液 < 1 nm 稳定、均一 饱和NaCl溶液
胶体 1 ~ 100 nm 较稳定、均一 豆浆
浊液 > 100 nm 不稳定、不均一 泥浆水
溶液
胶体
浊液
分散质粒子大小
当分散剂是水或其它液体时
小结:
三种分散系对比,溶液是最稳定的,而浊液是很不稳定,胶体则介于两者中间,在一定条件下能稳定存在,属于介稳体系
下面我们通过实验来探究胶体与溶液的区别:
【实验2-1】
Fe(OH)3胶体的制备及胶体、溶液、浊液外观特征的比较
现象:
Fe(OH)3胶体和CuSO4溶液都是均一、稳定、透明的,而泥水浑浊,不透明,有泥沙沉淀
结论:
FeCl3+3H2O=== Fe(OH)3(胶体)+3HCl
胶体和溶液都属于稳定的分散系,而浊液属于不稳定的分散系
【实验2-2】
验证Fe(OH)3胶体和CuSO4溶液是否发生丁达尔效应
现象:
结论:
可见到Fe(OH)3胶体有一条光亮的“通路”,而CuSO4溶液看不到此现象
胶体能发生丁达尔效应,而溶液不能,丁达尔效应是区别溶液与胶体常用的物理方法
【实验2-3】
过滤Fe(OH)3胶体和泥水
现象:
结论:
Fe(OH)3胶体全透过滤纸,没得到滤渣,过滤后的液体还是红褐色;泥水过滤后在滤纸上得到泥沙,而过滤后的液体是澄清、透明的。
胶体粒子可以通过滤纸空隙,浊液分散质粒子则不行
胶体的用途:
(1)盐卤点豆腐; (2)肥皂的制取和分离; (3)明矾净水; (4)FeCl3溶液用于伤口止血。 (5)水泥硬化; (6)冶金厂大量烟尘用高压电除去。 (7)土壤胶体中离子吸附和交换过程,保肥作用。
当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”,这种现象叫做丁达尔效应。
胶体中分散质微粒对可见光(波长为400~700nm)散射而形成的。
区别溶液和胶体。
丁达尔效应:
丁达尔现象产生的原因:
丁达尔现象的应用:
退出
分散系 溶液 胶体 悬,乳浊液
分散质
粒子的大小(nm)
外观特征
能否通过滤纸
是否有丁达尔现象
事例
分散系 溶液 胶体 悬,乳浊液
分散质粒子的大小 <1nm 1~100nm >100nm
外观特征 均匀,透明,稳定 均匀,有的透明,较稳定 不均匀,不透明,不稳定
能否通过滤纸 能 能 不能
是否有丁达尔现象 无 有 无
事例 NaCl溶液,蔗糖溶液 Fe(OH)3胶体 泥水
A、根据分散质粒子的大小 (当分散剂是水或其他液体时)
分散系
溶液
胶体
浊液
小于1nm
1~100nm
大于100nm
分散系的分类:
B、根据分散质和分散剂的状态不同
胶体
气溶胶
液溶胶
固溶胶
思考
1、空气中如果没有气溶胶会怎么样?
夜晚用手电筒照射夜空
放电影时,放映室射到银幕上的光柱
光线
透过树叶间
的缝隙射入
密林中
?空气也是胶体吗
是的。叫气溶胶
思考
胶体为什么具有介稳性?
原因一 胶体粒子可以通过吸附而带有电荷,同种胶粒带同种电荷,而同种电荷会相互排斥,要使胶体聚沉,就要克服排斥力,消除胶粒所带电荷
原因二 胶体粒子在不停的做布朗运动
第二章《化学物质及其变化》
第二节
离子反应
化学反应
根据反应物和生成物类别及种类划分
前提测评1
化合反应 分解反应
置换反应 复分解反应
氧化还原反应
非氧化还原反应
根据是否有
电子转移
根据是否有
离子参加
离子反应
非离子反应
其它方法
课时一
第二节 离子反应
思考1:下列物质中哪些能导电 为什么能导电
盐酸、NaOH溶液、NaCl固体、铁、蔗糖溶液、酒精溶液、K2SO4溶液、Cu。
小结:
①铁、铜能导电
思考2:在盐酸、NaOH溶液、K2SO4溶液里的自由移动的离子是怎样产生的 是否所有溶液都能导电?
小结:自由移动的离子是电离产生 ,并不是所有溶液都能导电
②盐酸、NaOH溶液、K2SO4溶液能导电
因为其中有自由移动的电子存在。
因为它们的溶液中有自由移动的离子存在。
一、电解质和非电解质
电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐等。
非电解质:在水溶液里和熔化状态下都不导电的化合物,如蔗糖、酒精等。
下列物质中哪些是电解质
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、H2O、酒精。
讨论:
结论:NaCl固体、NaOH固体是电解质
课时一
二、强电解质和弱电解质
思考3:
相同条件下,不同种类的酸、碱、盐溶液的导电能力是否相同
课时一
导电实验
思考3:
相同条件下,不同种类的酸、碱、盐溶液的导电能力是否相同
1.强电解质:在水溶液中全部电离成离子的电解质。如NaCl、NaOH、盐酸等
2.弱电解质:在水溶液中只一部分电离成离子的电解质。如NH3·H2O、醋酸等。
3.强弱电解质的区别。
强电解质 弱电解质
电离程度
溶液里粒子
同条件下导电性
物质类别
化合物类型
完全
部分
水合离子
分子、水合离子
强
弱
强酸、强碱、大多数盐
弱酸、弱碱、水
离子化合物,某些共价化合物
某些共价化合物
课时一
讨论
BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质 醋酸易溶,是否属强电解质
小结:BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是完全电离,所以它们为强电解质,醋酸易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中的电离程度。
课时一
课时二
第二节 离子反应
前提测评:
一、在下列物质中:①CH3COOH ②HCl③NaOH ④Cu(OH)2 ⑤AgCl ⑥Na2CO3 ⑦C2H5OH ⑧H2O ⑨SO2⑩Fe
1.属于强电解质的是____________
2.属于弱电解质的是____________
3.属于非电解质的是____________
4.溶液中主要以离子形式存在的是____________
② ③ ④ ⑤ ⑥
① ⑧
⑦ ⑨
② ③ ⑥
二、请完成下列方程式:
1、CuCl2+2AgNO3 3、NaCl+CuSO4
2、CuSO4+BaCl2
==2AgCl↓+Cu(NO3)2
=== BaSO4↓ +CuCl2
不反应
① ⑧
⑦ ⑨
② ③ ⑥
==2AgCl↓+Cu(NO3)2
课时二
三、离子反应
1.离子反应:有离子参加的反应。
编号 1 2 3
反应 CuSO4 + NaCl CuSO4+BaCl2 CuCl2+AgNO3
现象
结论和
解释
有难溶于稀HNO3的白色沉淀生成
有白色沉淀生成,滤液为蓝色
无明显现象,溶液仍为蓝色
Ag++Cl-==AgCl↓
NO3-、Cu2+没有参加反应
Ba2++SO42-=BaSO4↓
Cl-、Cu2+没有参加
反应
没有发生反应,溶液中仍为Na+、Cl-、Cu2+、SO42-
实验探究:
下列各组物质两两之间,哪些可以发生化学反应能反应的有何现象,写出相应的化学反应方式。
1 CuSO4. BaCl2. NaCl
2 Na2CO3. HCl. NaCl
3 NaOH.HCl. NaCl 酚酞
反应过程
讨论:
1 上述反应是不是所有的离子都参加了?参加反应的离子在溶液中浓度如何变化?为什么会有这样的变化?
2 发生复分解反应的条件是什么?
3 请尝试用化学符号把实际上发生的 反应表示出来。
离子反应 :
就是有离子参加或生 成的反应
复分解反应的条件:
生成沉淀 生成气体 生成水
离子方程式:
用实际参加反应的离子符号来表示溶液中离子反应的式子
优 点:
能揭示反应的实质
离子反应的条件:
①生成沉淀(生成更难溶的物质);
②离子之间结合成气体挥发掉;
③离子之间结合成难电离的物质(弱酸、弱碱、水)
Cu2++H2S=CuS↓+2H+
2H++S2-=H2S↑
CH3COO-+H+=CH3COOH
离子反应总是向着
降低某种离子浓度,
减少某离子数目的方向进行.
离子方程式的书写
步骤: 1、写
2、改
3、删
4、查
NaOH+HCl=NaCl+H2O
CuSO4 +BaCl2=BaSO4↓+CuCl2
写: 即写出化学反应方程式
例:
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
改:
把易溶于水并且易电离的反应物.生成物改写成离子的形式(难溶或难电离物质,气态物质、单质、氧化物仍用“分子式”表示)
Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
Na++CO32-+2H++2Cl- =Na++2Cl-+CO2↑+ H2O
Na++OH-+H++Cl-=Na++Cl-+H2O
删:即删去方程式两边不参加反应的离子:
SO42-+Ba2+=BaSO4↓
CO32-+2H+=CO2 ↑ +H2O
OH-+H+=H2O
查:
例:判断下列离子方程式是否配平
Cu+Ag+=Cu2++Ag
Fe3++Fe=2Fe2+
1.要看质量守恒
2.要看电荷是否守恒
结论:
3.必须符合反应事实
练习
1 写出硫酸和氢氧化钡溶液混合的离子方程式
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
2写出铁加入硫酸铜溶液的离子方程式
Fe+Cu2+=Fe2++Cu
3已知钠和水的反应方程式为:2Na+2H2O=2NaOH+H2 ↑ 写出该反应的离子方程式:
2Na+2H2O=2Na + +2OH-+H2↑
H++SO42-+Ba2++OH-=H2O+BaSO4↓
探究
分别写出 NaOH+H2SO4 KOH+HNO3
Ba(OH)2+HCl 的离子方程式:
H++OH-=H2O
离子方程式的优点有哪些
酸碱中和反应的实质是什么
酸和碱的反应是否都如此表示
思考:能用Cl-+Ag+=AgCl 表示的化学反应有哪些?
练习
1.下列各组离子能在溶液中大量共存的是( )
A Cl- Na+ NO3- Ag+
B K+ H+ OH- Cl-
C CO32- Na+ Cl- H+
D Cu2+ SO42- Cl- H+
2.某无色溶液中,可大量共存的离子组是( ) A. Na+ Ba2+ SO42- Cl- B. Cu2+ NO3- Cl- SO42- C. K+ Cl- Na+ CO32- D. K+ Ba2+ SO42- OH-
离子共存问题
能反应则不能大量共存,常见如下反应:
1、生成沉淀而不能大量共存
判断原则:溶解性表中不溶或微溶的物质的阴、阳离子,不能大量共存。
如:Ag+和Cl-、Fe3+和OH-、Cu2+和S2-等。
2、生成挥发性而不能共存
判断原则:有不稳定酸或不稳定碱生成。
如:H+和OH-、H+和CO32-,H+和SO32-,H+和HSO3-,NH4+和OH-等都不能在溶液中大量共存。
3、生成弱电解质而不能大量共存
判断原则:有弱酸、弱碱和水等弱电解质 生成,它们在水溶液中主要以难 电离的分子状态存在,因此不能大量共存。
如:H+和OH-、H+和CO32-,H+和PO43-等。
不能大量离子共存
5、酸碱环境不同而不能大量共存
判断原则:只能存在于酸性环境中的离子和只能存在于碱性环境中的离子,它们不能共 存。
在强酸性条件下:OH- CO32- HCO3-等
在强碱性条件下:H+ HCO3- Mg2+等
另外要注意条件:如颜色问题:Fe3+ Fe2+
Cu2+ MnO4-
不能大量离子共存
小结
离子反应的概念:
用离子方程式表示反应的优点:
离子反应牵涉到离子共存的问题:
H++OH-=H2O是否仅
表示酸碱反应
1.在强酸性条件下:OH- CO32- HCO3-等
2.在强碱性条件下:H+ HCO3- Mg2+等
3.生成沉淀:Cl-+Ag+等
另外要注意条件:如颜色问题:Fe3+ Fe2+ Cu2+ MnO4-
第二章《化学物质及其变化》
第三节
氧化还原反应
思考:请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么
观察我们周围的物质,有哪些是被氧化的产物?
思考与交流
Fe
Fe2O3
在我们生活的大气圈中,最具反应活性的物质是什么?它能与哪些物质发生反应?
C + O2 == CO2
S + O2 == SO2
CH4 + 2O2 == CO2 + 2H2O
点燃
点燃
点燃
氧化反应
南钢2号新炉
设计炉容:2550 m3
Fe2O3 Fe
还原反应
幽深的水域隐藏着许多危险的动物,其中最危险
的当属放电鱼。这种身长4米的潜伏杀手,狡诈而
诡异。它能放出一千多伏的电流,即便是最庞大
的猎物也不堪一击。
生物体的氧化反应
CuO失氧,发生还原反应。
CuO失氧,发生还原反应;
CuO + H2 = Cu + H2O
2CuO + C = 2Cu + CO2
分类标准:得氧失氧
思考:氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应总是同时进行
思考:请判断上述反应中各元素的化合价在反应前后有无变化?怎样变化?
H2得氧,发生氧化反应;
C得氧,发生氧化反应。
CuO + H2 == Cu + H2O
Fe2O3 + 3CO == 2Fe + 3CO2
化合价升高,
化合价升高,
化合价降低,
化合价降低,
+2 –2 0 0 +1 -2
+3 –2 +2 -2 0 +4 -2
被还原
被还原
被氧化
被氧化
(2)得、失氧过程与化合价变化的关系
化合价升高,
被氧化
化合价升高,
化合价降低,
化合价降低,
被还原
被还原
被氧化
CuO + H2 = Cu + H2O
2CuO + C = 2Cu + CO2
+2
0
0
+1
+2
0
0
+4
化合价降低,被还原
(氧化反应)
化合价降低,被还原
化合价升高,被氧化
结论:
得氧
失氧
化合价升高,被氧化
(还原反应)
(氧化反应)
(还原反应)
—化合价升高
—氧化反应
—化合价降低
—还原反应
2Cu + O2 == 2CuO
化合价升高,被氧化
化合价降低,被还原
2NaBr + Cl2 == Br2 + 2NaCl
化合价升高,被氧化
化合价降低,被还原
0 0 +2 -2
+1 -1 0 0 +1 -1
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
凡是有元素化合价升降的化学反应都是氧化还原反应
并非只有得氧、失氧的反应才是氧化还原反应
(3)化合价变化本质原因的分析
2Na + Cl2 == 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
化合价升高,失去电子
化合价降低,得到电子
氧化反应的实质是原子失去电子的过程。
还原反应的实质是原子得到电子的过程。
2Na + Cl2 = 2NaCl
点燃
H Cl
+17
+1
+1
+17
H Cl
δ+ δ-
H2 + Cl2 == 2HCl
H
Cl
HCl
化合价的升降——共用电子对的偏移
化合价升高,失去电子
化合价降低,得到电子
在生成的氯化氢分子中,一对共用电子对偏向于Cl原子而偏离于H原子,使H从0→+1价,被氧化,发生氧化反应;同时使Cl从0→-1价被还原,发生还原反应。
化学反应的本质是原子之间的重新组合
H2 + Cl2 = 2HCl
光照
H
H Cl
Cl
2Na + Cl2 = 2NaCl
0
0
+1
化合价升高,被氧化
化合价降低,被还原
H2 + Cl2 = 2HCl
0
0
+1
化合价升高,被氧化
化合价降低,被还原
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。
-1
-1
失电子,
得电子,
电子对偏离,
电子对偏向,
(4)氧化还原反应概念体系的建立
MnO2 + 4HCl== MnCl2 + Cl2 ↑+ 2H2O
化合价降低、被还原、得到2e-
化合价升高、被氧化、失去2×e-
双线桥表示法
CH4 + 2O2 == CO2 + 2H2O
Fe2O3 + 3CO == 2Fe + 3CO2
用双线桥表示下列氧化还原反应:
CuO + H2 == Cu + H2O
2NaBr + Cl2 == Br2 + 2NaCl
从得氧失氧角度分析:
一种物质得到氧被氧化,同时另一种物质失去氧被还原的反应是氧化还原反应。
从化合价升降角度分析:
有元素化合价升降的反应是氧化还原反应。
从电子转移角度分析:
有电子转移(得失或偏移)的反应是氧化还原反应。
局限于得氧失氧的反应
是氧化还原反应的表观特征,可作为氧化还原反应的判断依据。
氧化还原反应的本质是电子转移
一、氧化还原反应
思考与交流
下列化学反应属于氧化还原反应的有 ,
1、CaCO3+2HCl=CaCl2+CO2↑+H2O 2、CaO+H2O=Ca(OH)2 3、C+O2=CO2 4、CaCO3=CaO+CO2↑ 5、2KClO3=2KCl+3O2↑ 6、NaOH+HCl=NaCl+H2O 7、BaCl2+K2SO4=BaSO4↓+2KCl 8、MnO2+4HCl=MnCl2+Cl2↑+2H2O 9、2H2S+SO2=3S+2H2O 10、H2S+Cu2+=CuS↓+2H+
失去电子的反应叫氧化反应;
得到电子的反应叫还原反应;
凡是有电子得失的反应就叫氧化还原反应。
某元素失去电子
(或电子对偏离) 化合价升高 氧化反应
某元素得到电子
(或电子对偏向) 化合价降低 还原反应
(本质) (特征)
得氧的反应
失氧的反应
有得失氧的反应
化合价升高的反应
化合价降低的反应
有化合价升降的反应
得到(偏向)电子的反应
失去(偏离)电子的反应
有得失(偏向、离)电子的反应
氧化反应
还原反应
氧化还原反应
请对下列各反应进行分类:
非氧化还原反应
二、氧化剂和还原剂
1.氧化剂:得到电子(或电子对偏向)的物质
[所含元素化合价降低的物质]
2.还原剂:失去电子(或电子对偏离)的物质
[所含元素化合价升高的物质]
2CuO + C = 2Cu + CO2
H2 + Cl2 = 2HCl
氧化剂
还原剂
氧化剂
还原剂
常见的氧化剂有:
①活泼的非金属单质如:Cl2、O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、
HNO3、酸化KMnO4。
常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。
3.氧化性和还原性
氧化性:氧化剂夺电子的性质(或称氧化能力)
氧化剂具有氧化性;
还原性:还原剂失电子的性质(或还原能力)
还原剂具有还原性。
1、下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低
B.凡有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的得失或偏移
[练习]
B D
3、下列反应属于氧化还原反应的是( )
A.CuO + 2HCl = CuCl2 + H2O
B.Na2CO3 + 2HCl = 2NaCl + CO2 ↑+ H2O
C.2KMnO4 = K2MnO4 + MnO2 + O2↑
D.Ca(OH)2 + CO2 = CaCO3↓ + H2O
2、下列变化需要加入还原剂的是( )
A.Fe2O3 → Fe B.C → CO2
C.Na2CO3 → CO2 D.Al → Al2O3
4、分析四种基本类型反应与氧化还原反应之间的关系,并画出它们之间的交叉分类示意图。
A
C
学与问
1、有人说置换反应、有单质参与的化合反应和有单质生成的分解反应全部都属于氧化还原反应。你认为这个说法正确吗?请说明你的理由。
氧化还原反应与四种基本类型反应的关系:
化合反应
分解反应
复分解反应
置换反应
氧化还原反应
非氧化还原反应
学与问
2、尝试列举具体的化学反应画出化合反应、分解反应、置换反应与氧化还原反应的交叉分类示意图。
C+O2=CO2
CO2+NH3+H2O=NH4HCO3
2KClO3=2KCl+3O2↑
Cu2(OH)2CO3=2CuO+CO2↑+H2O
△
△
点燃
Fe+CuSO4=Cu+FeSO4
化合反应
分解反应
置换反应
氧化还原反应
非氧化还原反应
化学反应
按反应物和生成物的种类和类别分
化合反应
分解反应
置换反应
复分解反应
按反应中是否有离子参加分
离子反应
非离子反应
按反应中是否有电子转移分
氧化还原反应
非氧化还原反应
新课标人教版课件系列
《高中化学》
必修1
第二章
《化学物质及其变化》
教学目标
1、巩固物质的分类及方法,了解胶体的主要性质。
2、进一了解离子反应的本质及离子方程式书写。
3、进一步了解氧化还原反应的实质及有关基本概念。
教学重点:
1、离子反应的本质及离子方程式书写。
2、氧化还原反应的实质及有关基本概念。
第二章《化学物质及其变化》
第一节
物质的分类
第二章 化学物质及其变化
第一节 物质的分类
图1、图书馆陈列的图书
图2、商场摆放的商品
对于多达千万的化学物质和更多的化学反应,人们要想认识它们的规律性,就必须运用分类的方法,按照事先设定的“标准”进行分类。
化学物质
纯净物
混合物
单质
化合物
金属单质
非金属单质
酸
碱
氧化物
盐
溶液
胶体
浊液
悬浊液
乳浊液
化学反应
按反应前后种类、类别分类
按得氧,失氧分类
化合反应A+B=AB
分解反应AB=A+B
置换反应A+BC=AB+C
复分解反应AB+CD=AD+BC
氧化反应
还原反应
例如: 2CuO+C===2Cu+CO2
高温
分类的方法:
交叉分类法
能够提高人们的工作、学习效率,使人们更 快,更便捷地达到目的等。
分类的意义:
H2SO4
HCl
HNO3
H2SO3
含氧酸
无氧酸
一元酸
二元酸
交叉分类法
对事物认识较全面,弥补单一分类方法的不足。
树状分类法
H2SO4
HCl
NaOH
Ca(OH)2
Na2SO4
CaCO3
CO2
CaO
把事物认识得更加深刻,促进科学发展
石油产品及其应用
汽油
煤油
柴油
润滑油
石蜡
沥青
液化石油汽
汽车发动机燃料
飞机、煤油炉燃料
柴油发动机燃料
机油
各种化工原料
铺路
树状分类法
1、下列物质按不同的分类标准选择,可选出
与其他三项不属同类的物质?
(1)选___. 标准是________________.
(2)选___. 标准是________________.
A. 盐酸 B. 浓硫酸 C. 硝酸溶液
D. 纯碱
2、按照物质的组成和性质,对纯净物进
行分类,作出树状分类图,然后选择下列
合适的物质类别上.
O2 Cu 硫酸溶液 Ba(OH)2 KNO3
CO2 空气
D
其它三种都是溶液
D
其它三种都是酸
九种分散系(分类)
分散系及其分类
把一种(或多种)物质分散在另一种(或多种)物质所得到的体系,叫做分散系。前者属于被分散物质,称做分散质;后者起容纳分散质的作用,称做分散剂
按照分散质或分散剂的聚集状态(气、固、液)来分,有9种类型:
分散质 分散剂 实 例
汽 汽 空气
液 汽 云、雾
固 汽 烟灰尘
汽 液 泡沫
液 液 牛奶、酒精的水溶液
固 液 糖水、油漆
汽 固 泡沫塑料
液 固 珍珠(包藏着水的碳酸钙)
固 固 有色玻璃、合金
分散系的分类
分散系 分散质粒子大小 主要特征 举例
溶液 < 1 nm 稳定、均一 饱和NaCl溶液
胶体 1 ~ 100 nm 较稳定、均一 豆浆
浊液 > 100 nm 不稳定、不均一 泥浆水
溶液
胶体
浊液
分散质粒子大小
当分散剂是水或其它液体时
小结:
三种分散系对比,溶液是最稳定的,而浊液是很不稳定,胶体则介于两者中间,在一定条件下能稳定存在,属于介稳体系
下面我们通过实验来探究胶体与溶液的区别:
【实验2-1】
Fe(OH)3胶体的制备及胶体、溶液、浊液外观特征的比较
现象:
Fe(OH)3胶体和CuSO4溶液都是均一、稳定、透明的,而泥水浑浊,不透明,有泥沙沉淀
结论:
FeCl3+3H2O=== Fe(OH)3(胶体)+3HCl
胶体和溶液都属于稳定的分散系,而浊液属于不稳定的分散系
【实验2-2】
验证Fe(OH)3胶体和CuSO4溶液是否发生丁达尔效应
现象:
结论:
可见到Fe(OH)3胶体有一条光亮的“通路”,而CuSO4溶液看不到此现象
胶体能发生丁达尔效应,而溶液不能,丁达尔效应是区别溶液与胶体常用的物理方法
【实验2-3】
过滤Fe(OH)3胶体和泥水
现象:
结论:
Fe(OH)3胶体全透过滤纸,没得到滤渣,过滤后的液体还是红褐色;泥水过滤后在滤纸上得到泥沙,而过滤后的液体是澄清、透明的。
胶体粒子可以通过滤纸空隙,浊液分散质粒子则不行
胶体的用途:
(1)盐卤点豆腐; (2)肥皂的制取和分离; (3)明矾净水; (4)FeCl3溶液用于伤口止血。 (5)水泥硬化; (6)冶金厂大量烟尘用高压电除去。 (7)土壤胶体中离子吸附和交换过程,保肥作用。
当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”,这种现象叫做丁达尔效应。
胶体中分散质微粒对可见光(波长为400~700nm)散射而形成的。
区别溶液和胶体。
丁达尔效应:
丁达尔现象产生的原因:
丁达尔现象的应用:
退出
分散系 溶液 胶体 悬,乳浊液
分散质
粒子的大小(nm)
外观特征
能否通过滤纸
是否有丁达尔现象
事例
分散系 溶液 胶体 悬,乳浊液
分散质粒子的大小 <1nm 1~100nm >100nm
外观特征 均匀,透明,稳定 均匀,有的透明,较稳定 不均匀,不透明,不稳定
能否通过滤纸 能 能 不能
是否有丁达尔现象 无 有 无
事例 NaCl溶液,蔗糖溶液 Fe(OH)3胶体 泥水
A、根据分散质粒子的大小 (当分散剂是水或其他液体时)
分散系
溶液
胶体
浊液
小于1nm
1~100nm
大于100nm
分散系的分类:
B、根据分散质和分散剂的状态不同
胶体
气溶胶
液溶胶
固溶胶
思考
1、空气中如果没有气溶胶会怎么样?
夜晚用手电筒照射夜空
放电影时,放映室射到银幕上的光柱
光线
透过树叶间
的缝隙射入
密林中
?空气也是胶体吗
是的。叫气溶胶
思考
胶体为什么具有介稳性?
原因一 胶体粒子可以通过吸附而带有电荷,同种胶粒带同种电荷,而同种电荷会相互排斥,要使胶体聚沉,就要克服排斥力,消除胶粒所带电荷
原因二 胶体粒子在不停的做布朗运动
第二章《化学物质及其变化》
第二节
离子反应
化学反应
根据反应物和生成物类别及种类划分
前提测评1
化合反应 分解反应
置换反应 复分解反应
氧化还原反应
非氧化还原反应
根据是否有
电子转移
根据是否有
离子参加
离子反应
非离子反应
其它方法
课时一
第二节 离子反应
思考1:下列物质中哪些能导电 为什么能导电
盐酸、NaOH溶液、NaCl固体、铁、蔗糖溶液、酒精溶液、K2SO4溶液、Cu。
小结:
①铁、铜能导电
思考2:在盐酸、NaOH溶液、K2SO4溶液里的自由移动的离子是怎样产生的 是否所有溶液都能导电?
小结:自由移动的离子是电离产生 ,并不是所有溶液都能导电
②盐酸、NaOH溶液、K2SO4溶液能导电
因为其中有自由移动的电子存在。
因为它们的溶液中有自由移动的离子存在。
一、电解质和非电解质
电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐等。
非电解质:在水溶液里和熔化状态下都不导电的化合物,如蔗糖、酒精等。
下列物质中哪些是电解质
Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、H2O、酒精。
讨论:
结论:NaCl固体、NaOH固体是电解质
课时一
二、强电解质和弱电解质
思考3:
相同条件下,不同种类的酸、碱、盐溶液的导电能力是否相同
课时一
导电实验
思考3:
相同条件下,不同种类的酸、碱、盐溶液的导电能力是否相同
1.强电解质:在水溶液中全部电离成离子的电解质。如NaCl、NaOH、盐酸等
2.弱电解质:在水溶液中只一部分电离成离子的电解质。如NH3·H2O、醋酸等。
3.强弱电解质的区别。
强电解质 弱电解质
电离程度
溶液里粒子
同条件下导电性
物质类别
化合物类型
完全
部分
水合离子
分子、水合离子
强
弱
强酸、强碱、大多数盐
弱酸、弱碱、水
离子化合物,某些共价化合物
某些共价化合物
课时一
讨论
BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质 醋酸易溶,是否属强电解质
小结:BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是完全电离,所以它们为强电解质,醋酸易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中的电离程度。
课时一
课时二
第二节 离子反应
前提测评:
一、在下列物质中:①CH3COOH ②HCl③NaOH ④Cu(OH)2 ⑤AgCl ⑥Na2CO3 ⑦C2H5OH ⑧H2O ⑨SO2⑩Fe
1.属于强电解质的是____________
2.属于弱电解质的是____________
3.属于非电解质的是____________
4.溶液中主要以离子形式存在的是____________
② ③ ④ ⑤ ⑥
① ⑧
⑦ ⑨
② ③ ⑥
二、请完成下列方程式:
1、CuCl2+2AgNO3 3、NaCl+CuSO4
2、CuSO4+BaCl2
==2AgCl↓+Cu(NO3)2
=== BaSO4↓ +CuCl2
不反应
① ⑧
⑦ ⑨
② ③ ⑥
==2AgCl↓+Cu(NO3)2
课时二
三、离子反应
1.离子反应:有离子参加的反应。
编号 1 2 3
反应 CuSO4 + NaCl CuSO4+BaCl2 CuCl2+AgNO3
现象
结论和
解释
有难溶于稀HNO3的白色沉淀生成
有白色沉淀生成,滤液为蓝色
无明显现象,溶液仍为蓝色
Ag++Cl-==AgCl↓
NO3-、Cu2+没有参加反应
Ba2++SO42-=BaSO4↓
Cl-、Cu2+没有参加
反应
没有发生反应,溶液中仍为Na+、Cl-、Cu2+、SO42-
实验探究:
下列各组物质两两之间,哪些可以发生化学反应能反应的有何现象,写出相应的化学反应方式。
1 CuSO4. BaCl2. NaCl
2 Na2CO3. HCl. NaCl
3 NaOH.HCl. NaCl 酚酞
反应过程
讨论:
1 上述反应是不是所有的离子都参加了?参加反应的离子在溶液中浓度如何变化?为什么会有这样的变化?
2 发生复分解反应的条件是什么?
3 请尝试用化学符号把实际上发生的 反应表示出来。
离子反应 :
就是有离子参加或生 成的反应
复分解反应的条件:
生成沉淀 生成气体 生成水
离子方程式:
用实际参加反应的离子符号来表示溶液中离子反应的式子
优 点:
能揭示反应的实质
离子反应的条件:
①生成沉淀(生成更难溶的物质);
②离子之间结合成气体挥发掉;
③离子之间结合成难电离的物质(弱酸、弱碱、水)
Cu2++H2S=CuS↓+2H+
2H++S2-=H2S↑
CH3COO-+H+=CH3COOH
离子反应总是向着
降低某种离子浓度,
减少某离子数目的方向进行.
离子方程式的书写
步骤: 1、写
2、改
3、删
4、查
NaOH+HCl=NaCl+H2O
CuSO4 +BaCl2=BaSO4↓+CuCl2
写: 即写出化学反应方程式
例:
Na2CO3+2HCl=2NaCl+CO2↑+ H2O
改:
把易溶于水并且易电离的反应物.生成物改写成离子的形式(难溶或难电离物质,气态物质、单质、氧化物仍用“分子式”表示)
Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
Na++CO32-+2H++2Cl- =Na++2Cl-+CO2↑+ H2O
Na++OH-+H++Cl-=Na++Cl-+H2O
删:即删去方程式两边不参加反应的离子:
SO42-+Ba2+=BaSO4↓
CO32-+2H+=CO2 ↑ +H2O
OH-+H+=H2O
查:
例:判断下列离子方程式是否配平
Cu+Ag+=Cu2++Ag
Fe3++Fe=2Fe2+
1.要看质量守恒
2.要看电荷是否守恒
结论:
3.必须符合反应事实
练习
1 写出硫酸和氢氧化钡溶液混合的离子方程式
2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓
2写出铁加入硫酸铜溶液的离子方程式
Fe+Cu2+=Fe2++Cu
3已知钠和水的反应方程式为:2Na+2H2O=2NaOH+H2 ↑ 写出该反应的离子方程式:
2Na+2H2O=2Na + +2OH-+H2↑
H++SO42-+Ba2++OH-=H2O+BaSO4↓
探究
分别写出 NaOH+H2SO4 KOH+HNO3
Ba(OH)2+HCl 的离子方程式:
H++OH-=H2O
离子方程式的优点有哪些
酸碱中和反应的实质是什么
酸和碱的反应是否都如此表示
思考:能用Cl-+Ag+=AgCl 表示的化学反应有哪些?
练习
1.下列各组离子能在溶液中大量共存的是( )
A Cl- Na+ NO3- Ag+
B K+ H+ OH- Cl-
C CO32- Na+ Cl- H+
D Cu2+ SO42- Cl- H+
2.某无色溶液中,可大量共存的离子组是( ) A. Na+ Ba2+ SO42- Cl- B. Cu2+ NO3- Cl- SO42- C. K+ Cl- Na+ CO32- D. K+ Ba2+ SO42- OH-
离子共存问题
能反应则不能大量共存,常见如下反应:
1、生成沉淀而不能大量共存
判断原则:溶解性表中不溶或微溶的物质的阴、阳离子,不能大量共存。
如:Ag+和Cl-、Fe3+和OH-、Cu2+和S2-等。
2、生成挥发性而不能共存
判断原则:有不稳定酸或不稳定碱生成。
如:H+和OH-、H+和CO32-,H+和SO32-,H+和HSO3-,NH4+和OH-等都不能在溶液中大量共存。
3、生成弱电解质而不能大量共存
判断原则:有弱酸、弱碱和水等弱电解质 生成,它们在水溶液中主要以难 电离的分子状态存在,因此不能大量共存。
如:H+和OH-、H+和CO32-,H+和PO43-等。
不能大量离子共存
5、酸碱环境不同而不能大量共存
判断原则:只能存在于酸性环境中的离子和只能存在于碱性环境中的离子,它们不能共 存。
在强酸性条件下:OH- CO32- HCO3-等
在强碱性条件下:H+ HCO3- Mg2+等
另外要注意条件:如颜色问题:Fe3+ Fe2+
Cu2+ MnO4-
不能大量离子共存
小结
离子反应的概念:
用离子方程式表示反应的优点:
离子反应牵涉到离子共存的问题:
H++OH-=H2O是否仅
表示酸碱反应
1.在强酸性条件下:OH- CO32- HCO3-等
2.在强碱性条件下:H+ HCO3- Mg2+等
3.生成沉淀:Cl-+Ag+等
另外要注意条件:如颜色问题:Fe3+ Fe2+ Cu2+ MnO4-
第二章《化学物质及其变化》
第三节
氧化还原反应
思考:请举几个氧化反应和还原反应的实例,指出这类化学反应的分类标准是什么
观察我们周围的物质,有哪些是被氧化的产物?
思考与交流
Fe
Fe2O3
在我们生活的大气圈中,最具反应活性的物质是什么?它能与哪些物质发生反应?
C + O2 == CO2
S + O2 == SO2
CH4 + 2O2 == CO2 + 2H2O
点燃
点燃
点燃
氧化反应
南钢2号新炉
设计炉容:2550 m3
Fe2O3 Fe
还原反应
幽深的水域隐藏着许多危险的动物,其中最危险
的当属放电鱼。这种身长4米的潜伏杀手,狡诈而
诡异。它能放出一千多伏的电流,即便是最庞大
的猎物也不堪一击。
生物体的氧化反应
CuO失氧,发生还原反应。
CuO失氧,发生还原反应;
CuO + H2 = Cu + H2O
2CuO + C = 2Cu + CO2
分类标准:得氧失氧
思考:氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应总是同时进行
思考:请判断上述反应中各元素的化合价在反应前后有无变化?怎样变化?
H2得氧,发生氧化反应;
C得氧,发生氧化反应。
CuO + H2 == Cu + H2O
Fe2O3 + 3CO == 2Fe + 3CO2
化合价升高,
化合价升高,
化合价降低,
化合价降低,
+2 –2 0 0 +1 -2
+3 –2 +2 -2 0 +4 -2
被还原
被还原
被氧化
被氧化
(2)得、失氧过程与化合价变化的关系
化合价升高,
被氧化
化合价升高,
化合价降低,
化合价降低,
被还原
被还原
被氧化
CuO + H2 = Cu + H2O
2CuO + C = 2Cu + CO2
+2
0
0
+1
+2
0
0
+4
化合价降低,被还原
(氧化反应)
化合价降低,被还原
化合价升高,被氧化
结论:
得氧
失氧
化合价升高,被氧化
(还原反应)
(氧化反应)
(还原反应)
—化合价升高
—氧化反应
—化合价降低
—还原反应
2Cu + O2 == 2CuO
化合价升高,被氧化
化合价降低,被还原
2NaBr + Cl2 == Br2 + 2NaCl
化合价升高,被氧化
化合价降低,被还原
0 0 +2 -2
+1 -1 0 0 +1 -1
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
凡是有元素化合价升降的化学反应都是氧化还原反应
并非只有得氧、失氧的反应才是氧化还原反应
(3)化合价变化本质原因的分析
2Na + Cl2 == 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
化合价升高,失去电子
化合价降低,得到电子
氧化反应的实质是原子失去电子的过程。
还原反应的实质是原子得到电子的过程。
2Na + Cl2 = 2NaCl
点燃
H Cl
+17
+1
+1
+17
H Cl
δ+ δ-
H2 + Cl2 == 2HCl
H
Cl
HCl
化合价的升降——共用电子对的偏移
化合价升高,失去电子
化合价降低,得到电子
在生成的氯化氢分子中,一对共用电子对偏向于Cl原子而偏离于H原子,使H从0→+1价,被氧化,发生氧化反应;同时使Cl从0→-1价被还原,发生还原反应。
化学反应的本质是原子之间的重新组合
H2 + Cl2 = 2HCl
光照
H
H Cl
Cl
2Na + Cl2 = 2NaCl
0
0
+1
化合价升高,被氧化
化合价降低,被还原
H2 + Cl2 = 2HCl
0
0
+1
化合价升高,被氧化
化合价降低,被还原
凡有电子转移(得失或偏移)的化学反应都是氧化还原反应。
-1
-1
失电子,
得电子,
电子对偏离,
电子对偏向,
(4)氧化还原反应概念体系的建立
MnO2 + 4HCl== MnCl2 + Cl2 ↑+ 2H2O
化合价降低、被还原、得到2e-
化合价升高、被氧化、失去2×e-
双线桥表示法
CH4 + 2O2 == CO2 + 2H2O
Fe2O3 + 3CO == 2Fe + 3CO2
用双线桥表示下列氧化还原反应:
CuO + H2 == Cu + H2O
2NaBr + Cl2 == Br2 + 2NaCl
从得氧失氧角度分析:
一种物质得到氧被氧化,同时另一种物质失去氧被还原的反应是氧化还原反应。
从化合价升降角度分析:
有元素化合价升降的反应是氧化还原反应。
从电子转移角度分析:
有电子转移(得失或偏移)的反应是氧化还原反应。
局限于得氧失氧的反应
是氧化还原反应的表观特征,可作为氧化还原反应的判断依据。
氧化还原反应的本质是电子转移
一、氧化还原反应
思考与交流
下列化学反应属于氧化还原反应的有 ,
1、CaCO3+2HCl=CaCl2+CO2↑+H2O 2、CaO+H2O=Ca(OH)2 3、C+O2=CO2 4、CaCO3=CaO+CO2↑ 5、2KClO3=2KCl+3O2↑ 6、NaOH+HCl=NaCl+H2O 7、BaCl2+K2SO4=BaSO4↓+2KCl 8、MnO2+4HCl=MnCl2+Cl2↑+2H2O 9、2H2S+SO2=3S+2H2O 10、H2S+Cu2+=CuS↓+2H+
失去电子的反应叫氧化反应;
得到电子的反应叫还原反应;
凡是有电子得失的反应就叫氧化还原反应。
某元素失去电子
(或电子对偏离) 化合价升高 氧化反应
某元素得到电子
(或电子对偏向) 化合价降低 还原反应
(本质) (特征)
得氧的反应
失氧的反应
有得失氧的反应
化合价升高的反应
化合价降低的反应
有化合价升降的反应
得到(偏向)电子的反应
失去(偏离)电子的反应
有得失(偏向、离)电子的反应
氧化反应
还原反应
氧化还原反应
请对下列各反应进行分类:
非氧化还原反应
二、氧化剂和还原剂
1.氧化剂:得到电子(或电子对偏向)的物质
[所含元素化合价降低的物质]
2.还原剂:失去电子(或电子对偏离)的物质
[所含元素化合价升高的物质]
2CuO + C = 2Cu + CO2
H2 + Cl2 = 2HCl
氧化剂
还原剂
氧化剂
还原剂
常见的氧化剂有:
①活泼的非金属单质如:Cl2、O2、S等。
②高价金属阳离子如:Fe3+、Cu2+等。
③高价或较高价含氧化合物如:MnO2、浓H2SO4、
HNO3、酸化KMnO4。
常见的还原剂有:
①活泼或较活泼的金属:如K、Na、Al、Fe等。
②一些非金属单质:如H2、C、Si等。
③较低态的化合物:CO、SO2、H2S等。
3.氧化性和还原性
氧化性:氧化剂夺电子的性质(或称氧化能力)
氧化剂具有氧化性;
还原性:还原剂失电子的性质(或还原能力)
还原剂具有还原性。
1、下列叙述正确的是( )
A.在氧化还原反应中,失去电子的物质,所含元素化合价降低
B.凡有元素化合价升降的化学反应都是氧化还原反应
C.在氧化还原反应中一定所有的元素化合价都发生变化
D.氧化还原反应的本质是电子的得失或偏移
[练习]
B D
3、下列反应属于氧化还原反应的是( )
A.CuO + 2HCl = CuCl2 + H2O
B.Na2CO3 + 2HCl = 2NaCl + CO2 ↑+ H2O
C.2KMnO4 = K2MnO4 + MnO2 + O2↑
D.Ca(OH)2 + CO2 = CaCO3↓ + H2O
2、下列变化需要加入还原剂的是( )
A.Fe2O3 → Fe B.C → CO2
C.Na2CO3 → CO2 D.Al → Al2O3
4、分析四种基本类型反应与氧化还原反应之间的关系,并画出它们之间的交叉分类示意图。
A
C
学与问
1、有人说置换反应、有单质参与的化合反应和有单质生成的分解反应全部都属于氧化还原反应。你认为这个说法正确吗?请说明你的理由。
氧化还原反应与四种基本类型反应的关系:
化合反应
分解反应
复分解反应
置换反应
氧化还原反应
非氧化还原反应
学与问
2、尝试列举具体的化学反应画出化合反应、分解反应、置换反应与氧化还原反应的交叉分类示意图。
C+O2=CO2
CO2+NH3+H2O=NH4HCO3
2KClO3=2KCl+3O2↑
Cu2(OH)2CO3=2CuO+CO2↑+H2O
△
△
点燃
Fe+CuSO4=Cu+FeSO4
化合反应
分解反应
置换反应
氧化还原反应
非氧化还原反应
化学反应
按反应物和生成物的种类和类别分
化合反应
分解反应
置换反应
复分解反应
按反应中是否有离子参加分
离子反应
非离子反应
按反应中是否有电子转移分
氧化还原反应
非氧化还原反应
