2.2.1《酸、碱、盐在水水溶液中的电离》PPT课件(新人教版-必修1)
文档属性
| 名称 | 2.2.1《酸、碱、盐在水水溶液中的电离》PPT课件(新人教版-必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 370.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 15:43:57 | ||
图片预览








文档简介
(共22张PPT)
新课标人教版课件系列
《高中化学》
必修1
2.2.1《酸、碱、盐在水
水溶液中的电离》
第二节 离子反应
教学目标
知识与能力
1. 了解电解质的概念,知道酸、碱、盐在水中能发生电离;
2. 通过实验事实认识离子反应及其发生的条件。
【教学重点】:
离子反应发生的条件
【教学难点】:
电离、电解质等概念的建立
【教学方法】:
结合实验进行教学
【教具】:
多媒体电脑投影设备、必须的实验仪器和药品(本节在实验室上)
一、酸、碱、盐在水溶液中的电离
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不导电的化合物。
电解质:
非电解质:
化合物
想一想:
1、下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4
⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨蔗糖
电解质:②④⑧
非电解质:⑨
能导电:①⑤⑦⑧
1、能够导电的物质不一定是电解质。
2、是电解质的物质不一定能导电。
启示:
注意事项:
①电解质与非电解质都指化合物,但单质及混合物既不是电解质也不是非电解质;
②电解质与非电解质的本质区别是看化合物自身在熔融或在水溶液中能否电离 ;例如:氨气 二氧化碳 二氧化硫是非电解质;硫酸钡 氯化银是电解质;
2、BaSO4是不是电解质?为什么?
二氧化碳、二氧化硫、氨气溶于水都能导电,他们是电解质吗?
氯化氢和盐酸都叫电解质吗?
⑴电解质分类:
本身含有离子:
(碱、盐)
溶于水
熔融状态
本身不含离子:
(酸)
溶于水
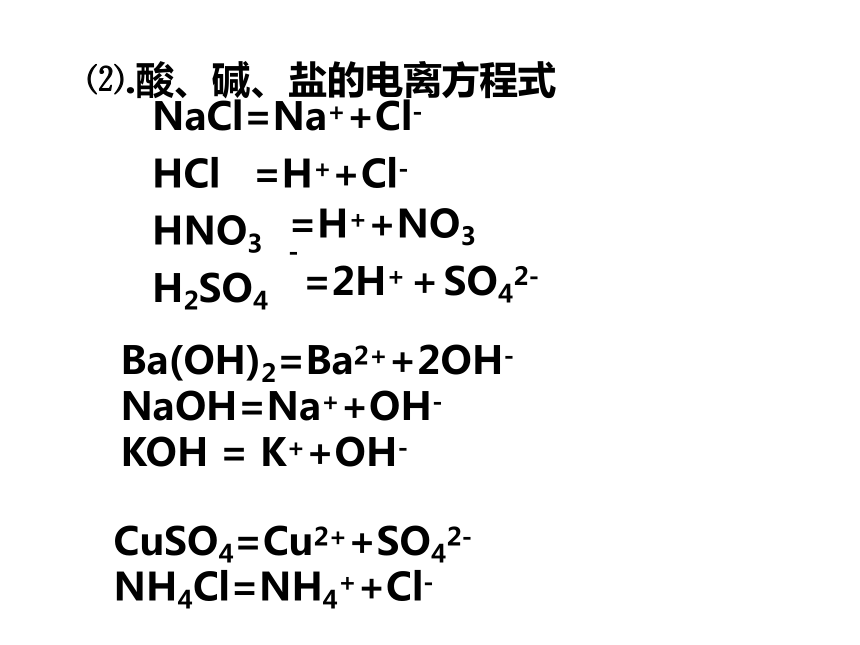
⑵.酸、碱、盐的电离方程式
NaCl=Na++Cl-
HCl
HNO3
H2SO4
=H++Cl-
=H++NO3-
=2H++SO42-
CuSO4=Cu2++SO42-NH4Cl=NH4++Cl-
Ba(OH)2=Ba2++2OH-
NaOH=Na++OH-
KOH = K++OH-
⑶酸、碱、盐的定义(本质)
酸:凡电离时生成的阳离子全部 是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属阳离子(或NH4+)和酸根阴离子的化合物。
[巩固练习]
1.下列物质中,能够导电的电解质是 ( )
A.Cu丝 B.熔融的MgCl2
C.NaCl溶液 D.蔗糖
2.在下列物质中,只有在溶液中才能导电的电解质是 ( )
A.NaCl B.酒精
C.H2SO4 D.SO3
3.下列物质中,不能电离出酸根离子的是 ( )
A.Na2S B.Ba(OH)2
C.KMnO4 D.KCl
思考与交流:
为什么电解质在水溶液中能导电?
氯化钠溶液能导电,氯化钠的固体能否导电?为什么?如果加热到熔融状态呢?
2、电解质导电的原因
电解质在溶于水或熔融状态下能够离解出可以自由移动的离子。
离子浓度越大,导电能力越____。
3强电解质与弱电解质
强电解质是指在水溶液中能完全电离的电解质,其特点是溶液中只存在电解质电离后产生的离子。在电离方程式中用“=”连接。如:HCl = H+ + Cl- NaOH = Na+ + OH-
弱电解质是指在水溶液中只有部分发生电离的电解质,其特点是溶液中既有电解质的分子,又有电解质的离子,在电离方程式中用“可逆号”表示
电解质溶质(C、V相等) 盐酸 氨水 NaOH(aq) 醋酸溶液
电解质
通电后灯泡
亮度
离子浓度
HCl
NH3 H2O
NaOH
CH3COOH
亮
亮
暗
暗
大
大
小
小
“强电解质溶液的导电能力一定比弱电解质溶液的导电能力强”对吗?为什么?
解释:用强弱电解质的理论来解释实验现象
由于C、V相同,电解质n相同,但由于电解质的强弱不同。如:HCl、NaOH是强电解质,在溶液中完全电离,离子浓度较大,导电能力较强,灯泡较亮。而CH3COOH、 NH3 H2O 是弱电解质,在溶液中部分电离,离子浓度较小,导电能力较弱,灯泡较暗。
想一想:
不对,因为溶液的导电能力取决于溶液中离子浓度的大小,稀的强电解质溶液离子浓度可能小于弱电解质溶液中离子的浓度,则弱电解质溶液的导电性强于强电解质溶液的导电性!
从电离的角度对化合物分类
化合物
电解质
非 电解质:
强电解质
弱电解质
强酸
强碱
大多数盐
弱酸
弱碱
水
非金属化合物,氨气,大多数有机物
三、强弱电解质的判断:
强酸(如硫酸、盐酸、硝酸等)、强碱(如氢氧化钠、氢氧化钾等)以及绝大多数盐(包括难溶性的盐,如BaSO4)在水溶液中能完全电离,这样的电解质称为强电解质。
弱酸(如碳酸、醋酸等)、弱碱(如一水合氨等)、难溶性的碱(如氢氧化铜等)等在水溶液中不能完全电离,这样的电解质称为弱电解质。
练一练:
1.下列各组化合物中,均为弱电解质的是( ),均为强电解质的是( )。
A.H2CO3 Ba(OH)2 H2S H3PO4
B.FeCl3 HCl C2H5OH(乙醇) NH4Cl
C.CH3COOH H2S NH3 H2O H2O
D.Na2SO4 H2SO4 HNO3 KNO3
C
D
2.某化合物易溶于水,但其水溶液不导电,则该化合物是( )。
A.弱电解质 B.强电解质
C.非电解质 D.不能确定其类型
C
4.NaHSO4在水溶液中能够电离出H+、Na+、和SO42- 。下列对于NaHSO4的分类中不正确的是 ( )
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
5.对电解质的叙述正确的是 ( )
A.溶于水后得到的溶液能导电的物质
B.熔融态能导电的物质
C.电解所得到的物质
D.在水溶液中或熔融状态下能导电的化合物
6.下列物质属电解质的是: ;
A.熔融的氯化钾B.干冰C.硫酸钡D.酒精E.铜片F.硫酸铜溶液G.硫酸H.氢氧化钙
7.请从电离的角度概括出酸、碱、盐的本质
酸: ;
碱: ;
盐: 。
8.写出下列物质的电离方程式:
H2SO4—
HNO3—
Ca(OH)2—
CuCl2—
Al2(SO4)3—
9.两种电解质溶液混合后,溶液中存在有Na+、K+、SO42-、Cl-,请思考:这两种电解质分别是什么?
10.固体氯化钠中存在着钠离子(Na+)与氯离子(Cl-),为何固体氯化钠几乎不导电,而将其熔融或溶于水形成溶液就能导电,这是因为
。物质能导电,必须具有 ,金属能够导电是由于含有 ,电解质溶液导电是由于有 ,一般而言,温度对金属导体与电解质溶液导电能力的影响刚好相反,就此推知,温度越高,金属导体的导电能力 ,电解质溶液导电能力 。
新课标人教版课件系列
《高中化学》
必修1
2.2.1《酸、碱、盐在水
水溶液中的电离》
第二节 离子反应
教学目标
知识与能力
1. 了解电解质的概念,知道酸、碱、盐在水中能发生电离;
2. 通过实验事实认识离子反应及其发生的条件。
【教学重点】:
离子反应发生的条件
【教学难点】:
电离、电解质等概念的建立
【教学方法】:
结合实验进行教学
【教具】:
多媒体电脑投影设备、必须的实验仪器和药品(本节在实验室上)
一、酸、碱、盐在水溶液中的电离
在水溶液里或熔融状态下能够导电的化合物。
在水溶液里和熔融状态下都不导电的化合物。
电解质:
非电解质:
化合物
想一想:
1、下列物质哪些是电解质?哪些是非电解质?哪些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4
⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液
⑧熔融状态的KNO3 ⑨蔗糖
电解质:②④⑧
非电解质:⑨
能导电:①⑤⑦⑧
1、能够导电的物质不一定是电解质。
2、是电解质的物质不一定能导电。
启示:
注意事项:
①电解质与非电解质都指化合物,但单质及混合物既不是电解质也不是非电解质;
②电解质与非电解质的本质区别是看化合物自身在熔融或在水溶液中能否电离 ;例如:氨气 二氧化碳 二氧化硫是非电解质;硫酸钡 氯化银是电解质;
2、BaSO4是不是电解质?为什么?
二氧化碳、二氧化硫、氨气溶于水都能导电,他们是电解质吗?
氯化氢和盐酸都叫电解质吗?
⑴电解质分类:
本身含有离子:
(碱、盐)
溶于水
熔融状态
本身不含离子:
(酸)
溶于水
⑵.酸、碱、盐的电离方程式
NaCl=Na++Cl-
HCl
HNO3
H2SO4
=H++Cl-
=H++NO3-
=2H++SO42-
CuSO4=Cu2++SO42-NH4Cl=NH4++Cl-
Ba(OH)2=Ba2++2OH-
NaOH=Na++OH-
KOH = K++OH-
⑶酸、碱、盐的定义(本质)
酸:凡电离时生成的阳离子全部 是H+的化合物。
碱:凡电离时生成的阴离子全部是OH-离子的化合物。
盐:凡电离时生成金属阳离子(或NH4+)和酸根阴离子的化合物。
[巩固练习]
1.下列物质中,能够导电的电解质是 ( )
A.Cu丝 B.熔融的MgCl2
C.NaCl溶液 D.蔗糖
2.在下列物质中,只有在溶液中才能导电的电解质是 ( )
A.NaCl B.酒精
C.H2SO4 D.SO3
3.下列物质中,不能电离出酸根离子的是 ( )
A.Na2S B.Ba(OH)2
C.KMnO4 D.KCl
思考与交流:
为什么电解质在水溶液中能导电?
氯化钠溶液能导电,氯化钠的固体能否导电?为什么?如果加热到熔融状态呢?
2、电解质导电的原因
电解质在溶于水或熔融状态下能够离解出可以自由移动的离子。
离子浓度越大,导电能力越____。
3强电解质与弱电解质
强电解质是指在水溶液中能完全电离的电解质,其特点是溶液中只存在电解质电离后产生的离子。在电离方程式中用“=”连接。如:HCl = H+ + Cl- NaOH = Na+ + OH-
弱电解质是指在水溶液中只有部分发生电离的电解质,其特点是溶液中既有电解质的分子,又有电解质的离子,在电离方程式中用“可逆号”表示
电解质溶质(C、V相等) 盐酸 氨水 NaOH(aq) 醋酸溶液
电解质
通电后灯泡
亮度
离子浓度
HCl
NH3 H2O
NaOH
CH3COOH
亮
亮
暗
暗
大
大
小
小
“强电解质溶液的导电能力一定比弱电解质溶液的导电能力强”对吗?为什么?
解释:用强弱电解质的理论来解释实验现象
由于C、V相同,电解质n相同,但由于电解质的强弱不同。如:HCl、NaOH是强电解质,在溶液中完全电离,离子浓度较大,导电能力较强,灯泡较亮。而CH3COOH、 NH3 H2O 是弱电解质,在溶液中部分电离,离子浓度较小,导电能力较弱,灯泡较暗。
想一想:
不对,因为溶液的导电能力取决于溶液中离子浓度的大小,稀的强电解质溶液离子浓度可能小于弱电解质溶液中离子的浓度,则弱电解质溶液的导电性强于强电解质溶液的导电性!
从电离的角度对化合物分类
化合物
电解质
非 电解质:
强电解质
弱电解质
强酸
强碱
大多数盐
弱酸
弱碱
水
非金属化合物,氨气,大多数有机物
三、强弱电解质的判断:
强酸(如硫酸、盐酸、硝酸等)、强碱(如氢氧化钠、氢氧化钾等)以及绝大多数盐(包括难溶性的盐,如BaSO4)在水溶液中能完全电离,这样的电解质称为强电解质。
弱酸(如碳酸、醋酸等)、弱碱(如一水合氨等)、难溶性的碱(如氢氧化铜等)等在水溶液中不能完全电离,这样的电解质称为弱电解质。
练一练:
1.下列各组化合物中,均为弱电解质的是( ),均为强电解质的是( )。
A.H2CO3 Ba(OH)2 H2S H3PO4
B.FeCl3 HCl C2H5OH(乙醇) NH4Cl
C.CH3COOH H2S NH3 H2O H2O
D.Na2SO4 H2SO4 HNO3 KNO3
C
D
2.某化合物易溶于水,但其水溶液不导电,则该化合物是( )。
A.弱电解质 B.强电解质
C.非电解质 D.不能确定其类型
C
4.NaHSO4在水溶液中能够电离出H+、Na+、和SO42- 。下列对于NaHSO4的分类中不正确的是 ( )
A.NaHSO4是盐 B.NaHSO4是酸式盐
C.NaHSO4是钠盐 D.NaHSO4是酸
5.对电解质的叙述正确的是 ( )
A.溶于水后得到的溶液能导电的物质
B.熔融态能导电的物质
C.电解所得到的物质
D.在水溶液中或熔融状态下能导电的化合物
6.下列物质属电解质的是: ;
A.熔融的氯化钾B.干冰C.硫酸钡D.酒精E.铜片F.硫酸铜溶液G.硫酸H.氢氧化钙
7.请从电离的角度概括出酸、碱、盐的本质
酸: ;
碱: ;
盐: 。
8.写出下列物质的电离方程式:
H2SO4—
HNO3—
Ca(OH)2—
CuCl2—
Al2(SO4)3—
9.两种电解质溶液混合后,溶液中存在有Na+、K+、SO42-、Cl-,请思考:这两种电解质分别是什么?
10.固体氯化钠中存在着钠离子(Na+)与氯离子(Cl-),为何固体氯化钠几乎不导电,而将其熔融或溶于水形成溶液就能导电,这是因为
。物质能导电,必须具有 ,金属能够导电是由于含有 ,电解质溶液导电是由于有 ,一般而言,温度对金属导体与电解质溶液导电能力的影响刚好相反,就此推知,温度越高,金属导体的导电能力 ,电解质溶液导电能力 。
