高中化学新人教版选修5《脂肪烃》课件
文档属性
| 名称 | 高中化学新人教版选修5《脂肪烃》课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-01 00:00:00 | ||
图片预览






文档简介
(共43张PPT)
第二章 烃和卤代烃
第一节 脂肪烃
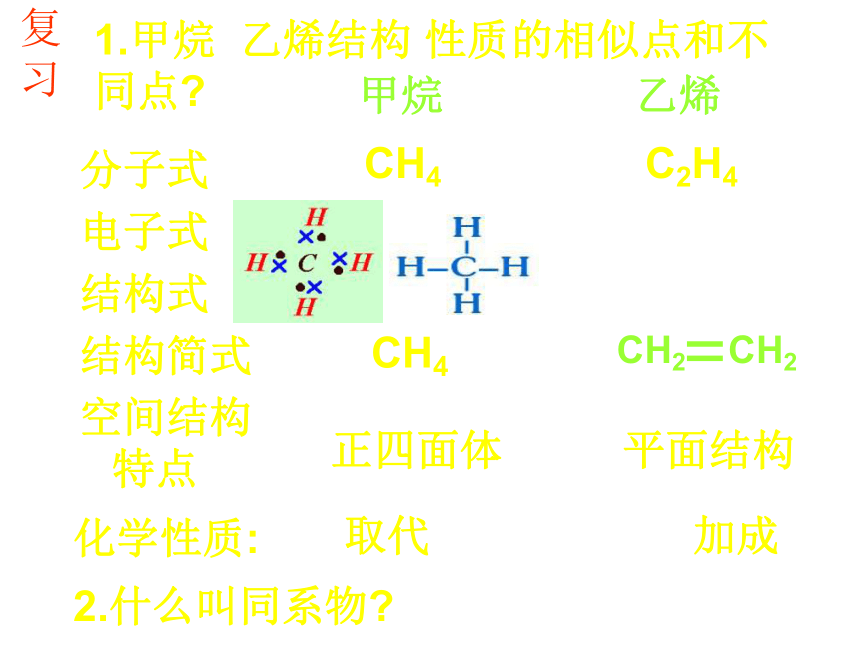
1.甲烷 乙烯结构 性质的相似点和不同点
化学性质:
分子式
电子式
结构式
结构简式
空间结构特点
复习
甲烷
乙烯
CH4 C2H4
‥
‥
H H
H : C : : C : H
CH2 CH2
CH4
正四面体 平面结构
取代 加成
2.什么叫同系物
一.烷烃和烯烃
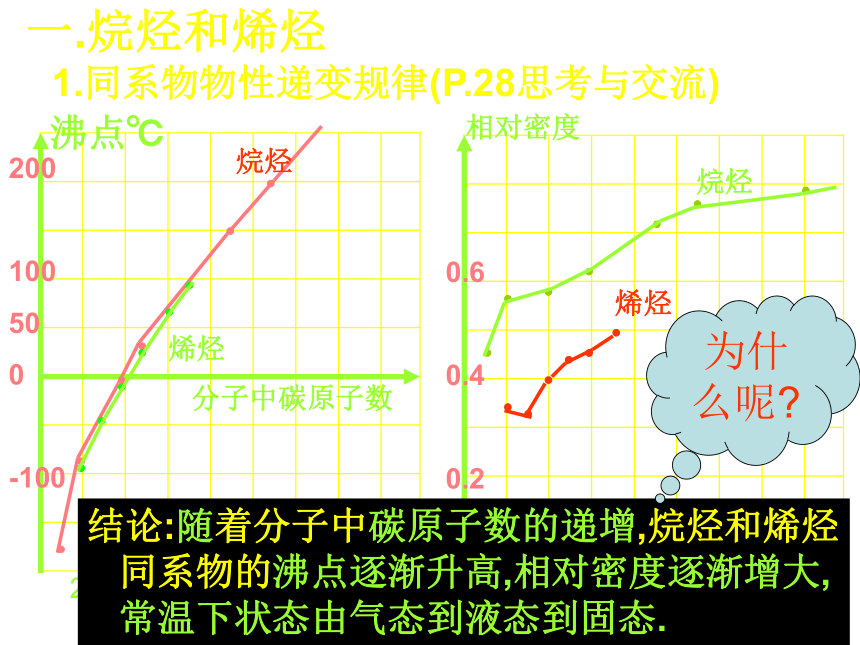
1.同系物物性递变规律(P.28思考与交流)
沸点℃
分子中碳原子数
2 4 6 8 10 12 14 16
200
100
50
0
-100
分子中碳原子数
相对密度
2 4 6 8 10 12 14 16
0.6
0.4
0.2
0
烷烃
烷烃
烯烃
烯烃
结论:随着分子中碳原子数的递增,烷烃和烯烃同系物的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态.
为什么呢
原因:对于结构相似的物质(分子晶体)来说,分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变…
2.烷烃 烯烃的化学性质:(与甲烷、乙烯相似)
分子结构相似的物质在化学性质上也相似.
通常情况下,烷烃与高锰酸钾等强氧化剂不发生反应,不能与强酸和强碱溶液反应。
CnH2n+2 +(3n+1)/2 O2 nCO2 +(n+1)H2O
(1)烷烃与氧气反应
烷烃的化学性质
(2)烷烃的取代反应
(3)烷烃的受热分解
由于其它烷烃的碳原子多,所以分解比甲烷复杂。
一般甲烷高温分解,长链烷烃高温裂化、裂解。
其它烷烃与甲烷一样,一定条件下能发生取代反应。因为可以被取代的氢原子多,所以发生取代反应,其它烷烃比甲烷复杂。
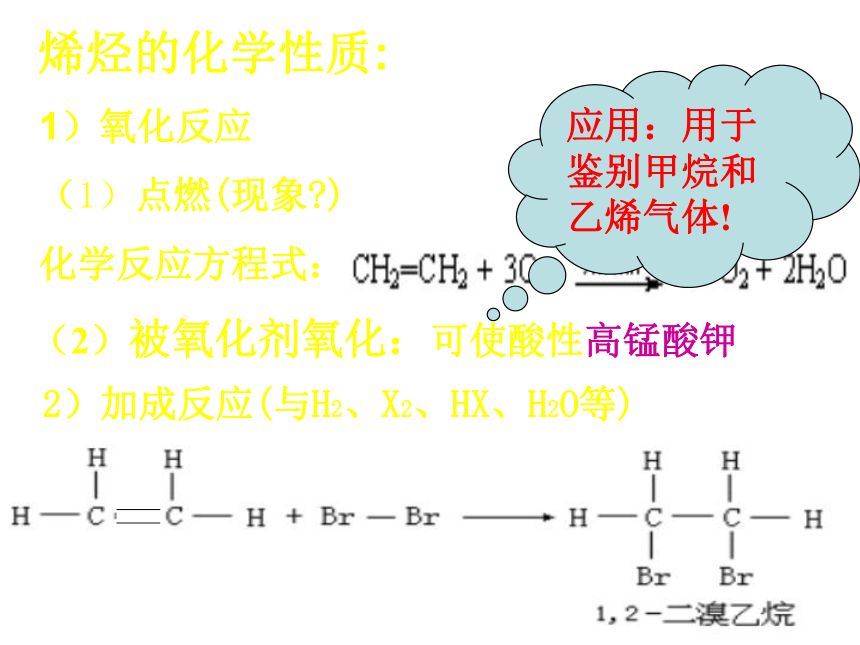
烯烃的化学性质:
1)氧化反应
(1)点燃(现象 )
化学反应方程式:
(2)被氧化剂氧化:可使酸性高锰酸钾褪色
2)加成反应(与H2、X2、HX、H2O等)
将乙烯气体通入溴水溶液中,可以见到溴的红棕色很快褪去,说明乙烯与溴发生反应。
应用:用于鉴别甲烷和乙烯气体!
CH2=CH2 + Br2 → CH2BrCH2Br
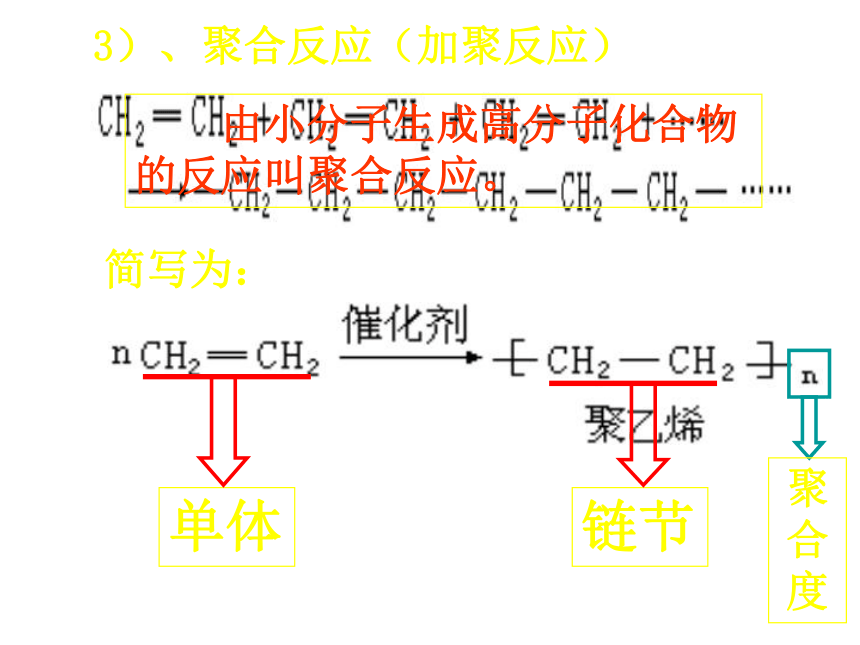
3)、聚合反应(加聚反应)
简写为:
单体
链节
聚合度
由小分子生成高分子化合物的反应叫聚合反应。
练习:请写出CH3CH=CH2分别与H2、Br2、HBr、H2O发生加成反应及加聚的化学方程式。
分别写出下列烯烃的名称及发生加聚反应的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
CnH2n-2 (n≧4)
代表物:
1,3-丁二烯 CH2=CH-CH=CH2
2、二烯烃的通式:
CH2=C-CH=CH2
CH3
2-甲基-1,3-丁二烯
也可叫作:异戊二烯
思考: 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个原子在同一平面上?
1、概念:含有两个碳碳双键(C=C)的不饱和链烃
二烯烃
3、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
CH2=CH-CH=CH2+2Br2
CH2=CH-CH=CH2+Br2
CH2-CH-CH-CH2
Br
Br
Br
Br
CH2-CH-CH=CH2
Br
Br
CH2-CH=CH-CH2
Br
Br
nCH2=CH-CH=CH2
[CH2-CH=CH-CH2]n
1,2 加成
1,4 加成
CH2-CH-CH-CH2
1,2 Br
1,4 Br
(主产物)
1,4 加聚
(中间体)
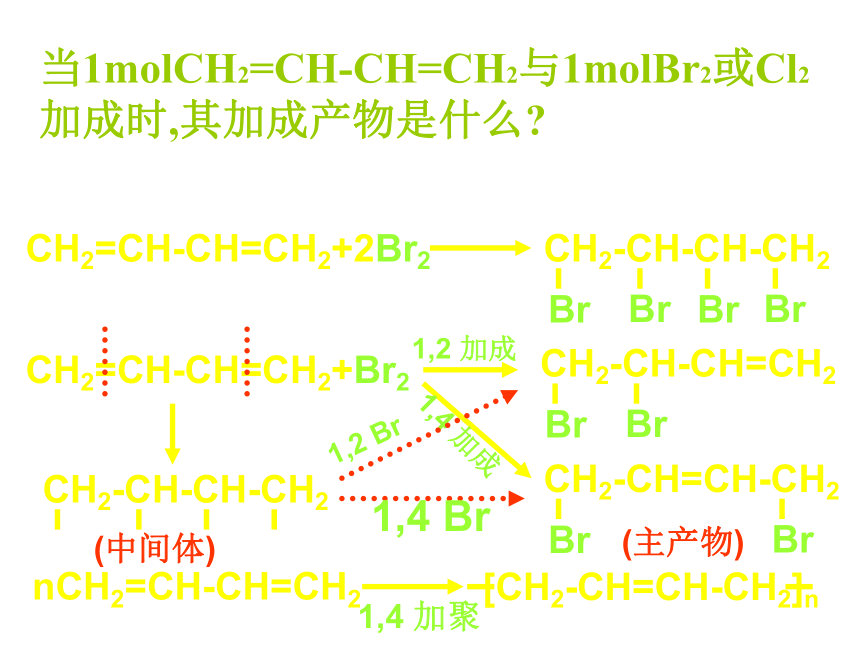
当1molCH2=CH-CH=CH2与1molBr2或Cl2
加成时,其加成产物是什么
CH2=CH-CH=CH2
+Br2
CH2-CH=CH-CH2
Br
Br
CH2=CH-CH=CH2
+Br2
CH2-CH-CH=CH2
Br
Br
1 2 3 4
1 2 3 4
1,2-加成
1,4-加成
加成
3,4-二溴-1-丁烯
4 3 2 1
1,4-二溴-2-丁烯
1 2 3 4
n CH2=CH-CH=CH2
催化剂
、P
1 2 3 4
(1,3-丁二烯)
聚1,3-丁二烯
—CH2-CH=CH-CH2 —
[ ]n
加聚
俗称:异戊二烯 聚异戊二烯
学名:2-甲基-1,3-丁二烯 (天然橡胶)
nCH2=C-CH=CH2 [CH2-C=CH-CH2]n
CH3
CH3
加聚
CH2=C-CH=CH2 和
|
CH3
CH2=C-CH=CH-CH3
|
CH3
写出下列物质发生加聚反应的化学方程式
nCH2=C-CH=CH [ CH2-C=CH-CH ]n
加聚
|
CH3
|
CH3
|
CH3
|
CH3
(2)1,3-丁二烯型
(3)混合型
加聚反应产物及单体
(1)乙烯型
CH2=CH2
-CH2-CH2-n
CH=CH2
CH3
聚合物:
-CH-CH2-n
CH3
单 体:
加聚反应产物及单体
(2)1,3-丁二烯型
(2)1,3-丁二烯型
(3)混合型
(1)乙烯型
CH2=CH-CH=CH2
-CH2-CH=CH-CH2- n
CH=CH-CH=CH2
CH3
-CH-CH=CH-CH2- n
CH3
单体:
单体:
加聚反应产物及单体
(3)混合型
(2)1,3-丁二烯型
(3)混合型
(1)乙烯型
[CH2-CH=CH-CH2-CH2-CH-CH2-CH]n
CH3
CH2=CH-CH=CH2
CH2=CH
CH2=CH
CH3
单 体:
混合型:
思考:
2-丁烯 中,与碳碳双键相连的两个碳原子、两个氢原子是否处于同一平面?
如处于同一平面,与碳碳双键相连的两个碳原子是处于双键的同侧还是异侧?
CH3CH=CHCH3
二、烯烃的顺反异构现象
C=C
C=C
H
H
CH3
CH3
CH3
CH3
H
H
反式异构
顺式异构
如果每个双键碳原子连接了两个不同的原子
或原子团,双键上的4个原子或原子团在空间就有两种不同的排列方式,产生两种不同的异构,
即顺反异构
该有机物能使溴水褪色,说明该有机物中含有不饱和键;
n(Br2) =
80g X 5%
160g/mol
该有机物:
n(C) :n(H)=
所以该有机物为烯烃
1.4g该有机物可与0.025molBr2反应
= 0.025mol
= 1:2
M=
1.4g
0.025mol
=56g/mol
85.7%
12
14.3%
1
:
分析:
分子式 :
C4H8
(2)结构简式:
CH3-CH=CH-CH3
或
CH3-C=CH2
CH3
解答(1)
通常,烷烃可以由相应的烯烃催化加氢得到。但是有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,却分别可由而且只能由1种自己相应的烯烃催化加氢得到。A、B1、B2、B3的结构简式分别 , ,
, 。
A: (CH3)3C-CH2-C(CH3)3
B1: (CH3)3C-C(CH3)2-CH2-CH3
B2: (CH3)2CH-C(CH3)2-CH(CH3)2
B3: C(CH2CH3)4
1、指分子中含有-C≡C-的不饱和烃
三、炔烃:
2、链状单炔烃的通式:CnH2n-2(n≥2)
物理性质:与烷烃和烯烃类似
化学性质:与乙炔相似
1.随碳原子数的增加,溶沸点逐渐升高,相对密度逐渐增大
2.碳原子数小于等于4时,常温常压下为气态
3.炔烃的相对密度小于水的密度
4.炔烃不溶于水,但易溶于有机溶剂
3、乙炔
分子式
电子式
结构式
结构简式
空间结构特点
C2H2
H C C H
直线型
CH≡CH
1)分子结构特点:
H C C H
为避免反应速率过快,用饱和食盐水代替水!!
2)乙炔的实验室制法:
实验装置: P.32图2-6
注意事项:
a、检查气密性;
b、怎样除去杂质气体?
c、气体收集方法
原理:CaC2+2H2O Ca(OH)2+C2H2↑
将气体通过装有CuSO4溶液的洗气瓶
灰白色固体颗粒
C:
C:
Ca2+
+
HO H
HO H
C
C
H
H
+ Ca(OH)2
2-
(1)因电石中含有 CaS、Ca3P2等,也会与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;
(2)如何去除乙炔的臭味呢?
乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?
(3)H2S对本实验有影响吗?为什么?
H2S具有较强还原性,能与溴反应,易被酸性高锰酸钾溶液氧化,使其褪色,因而会对该实验造成干扰。
NaOH和CuSO4溶液
1、 因为碳化钙与水反应剧烈,启普发生器不易控制反应;
4、关闭导气阀后,水蒸气仍与电石作用,不能达到“关之即停”的目的.
3、生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗的下口;
2、反应放出大量热,启普发生器是厚玻璃壁仪器,容易因胀缩不均,引起破碎 ;
为什么不能用启普发生器制取乙炔?
C
C
Ca2+
2
拓展:
电石的主要成分是一种离子化合物CaC2
电子式为
结构式为
与水反应方程式为:
CaC2 + 2H2O C2H2 + Ca(OH)2
反应过程分析:
C
C
Ca
C
C
Ca
+
HO H
HO H
C
C
H
H
+ Ca(OH)2
实验探究
①将乙炔气体点燃,观察火焰颜色及燃烧情况
②将乙炔气体通入溴水中
③将乙炔气体通入酸性高锰酸钾中
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
a. 氧化反应
(1) 在空气或在氧气中燃烧—完全氧化
2C2H2 + 5O2 4CO2 + 2H2O
点燃
3)乙炔的化学性质:
在空气中的爆炸极限为2.5%~80%
发生爆炸的乙炔气罐
2005年10月7日,广州某地一乙炔气厂发生爆炸。事故原因是乙炔装运补给点出现意外,引发了乙炔仓库爆炸,厂房严重受损,多人伤亡,爆炸产生的火苗还导致周边山林起火,所幸抢险得力,山火被及时扑灭。
氧炔焰:乙炔燃烧放出大量的热,在O2中燃烧,产生的氧炔焰温度高达3000℃以上,可用于切割、焊接金属。
氧炔焰切割金属
焊 枪
(2)被氧化剂氧化:将乙炔气体通往酸性高锰酸钾溶液中,可使酸性高锰酸钾褪色
b、加成反应
将乙炔气体通入溴水溶液中,可以见到溴的红棕色褪去,说明乙炔与溴发生反应。(比乙烯与溴的反应慢)
应用:用于鉴别乙炔和乙烯气体!
CH≡CH + 2Br2 → CHBr2CHBr2
加成反应过程分析
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
练习:写出乙炔与氢气、氯化氢气体发生加成反应的化学反应方程式
与H2加成
+ H2
CH2= CH2
CH CH
催化剂
CH2= CH2
CH3 -CH3
催化剂
+ H2
n CH2=CH -CH2-CH-n
催化剂
Cl
Cl
+ HCl
CH2= CHCl
CH CH
催化剂
与HCl加成
聚氯乙烯在使用的过程中,易发生老化,会变硬、发脆、开裂等,并释放出对人体有害的氯化氢,故不宜使用聚氯乙烯制品直接盛装食物。
聚氯乙烯是一种合成树脂,可用于制备塑料和合成纤维等。聚氯乙烯可由H2、Cl2和乙炔为原料制取。
我国市场上目前大量使用的塑料制品都是不可降解塑料,以发泡聚氯乙烯、聚乙烯或聚丙烯为原料,分子量达2万以上。只有分子量降低到2000以下,才能被自然环境中的微生物所利用,变成水和其它有机质,而这一过程需要200年;如果将其填埋,将会影响农作物吸收养分和水分,导致减产;对其焚烧会释放出多种化学有毒气体,其中有一种叫二恶英的化合物,毒性极大,即使在摄入很小量的情况下,也能使鸟类和鱼类出现畸形和死亡,对生态环境造成破坏,同时对人体有着很大危害。
白色警告
当前治理白色污染主要使用的可降解塑料、以纸代塑、生物全降解等新技术中,以纸代塑被认为是目前综合评价最好的替代技术。用这种方法制作的塑料袋、餐具因其无毒无害、易回收、可再生利用、可降解等优点而被冠以“环保产品”的称号
nCH CH
CH=CH
n
加温、加压
催化剂
(3)加聚反应:导电塑料——聚乙炔
—— 绝缘体变导体
一般在人们的印象中,塑料是不导电的,通常用于普通的电缆中作导电铜丝外面的绝缘层。但是,2000年3名诺贝尔化学奖获得者勇敢地向传统观念提出了挑战。他们通过长期精心地研究,经过对聚合物特殊的改性,使塑料能够表现得像金属一样,具有导电性。这不能不说是一种原创性的开发。
2000年的诺贝尔化学奖授予了美国加利福尼亚大学的物理学家黑格、美国宾夕法尼亚大学的化学家马克迪亚米德和日本筑波大学的化学家白川英树,因为他们发现了导电塑料。
乙
炔
氧化反应
加成反应
点燃
O2
CO2 + H2O
酸性
KMnO4溶液
褪色
H2
催化剂
CH3-CH3
H2
催化剂
CH2=CH2
HCl(HBr)
催化剂,
CH2=CHCl
Br2
(Cl2)
CH=CH
Br
Br
Br2
(Cl2)
CH CH
Br
Br
Br
Br
第二章 烃和卤代烃
第一节 脂肪烃
1.甲烷 乙烯结构 性质的相似点和不同点
化学性质:
分子式
电子式
结构式
结构简式
空间结构特点
复习
甲烷
乙烯
CH4 C2H4
‥
‥
H H
H : C : : C : H
CH2 CH2
CH4
正四面体 平面结构
取代 加成
2.什么叫同系物
一.烷烃和烯烃
1.同系物物性递变规律(P.28思考与交流)
沸点℃
分子中碳原子数
2 4 6 8 10 12 14 16
200
100
50
0
-100
分子中碳原子数
相对密度
2 4 6 8 10 12 14 16
0.6
0.4
0.2
0
烷烃
烷烃
烯烃
烯烃
结论:随着分子中碳原子数的递增,烷烃和烯烃同系物的沸点逐渐升高,相对密度逐渐增大,常温下状态由气态到液态到固态.
为什么呢
原因:对于结构相似的物质(分子晶体)来说,分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变…
2.烷烃 烯烃的化学性质:(与甲烷、乙烯相似)
分子结构相似的物质在化学性质上也相似.
通常情况下,烷烃与高锰酸钾等强氧化剂不发生反应,不能与强酸和强碱溶液反应。
CnH2n+2 +(3n+1)/2 O2 nCO2 +(n+1)H2O
(1)烷烃与氧气反应
烷烃的化学性质
(2)烷烃的取代反应
(3)烷烃的受热分解
由于其它烷烃的碳原子多,所以分解比甲烷复杂。
一般甲烷高温分解,长链烷烃高温裂化、裂解。
其它烷烃与甲烷一样,一定条件下能发生取代反应。因为可以被取代的氢原子多,所以发生取代反应,其它烷烃比甲烷复杂。
烯烃的化学性质:
1)氧化反应
(1)点燃(现象 )
化学反应方程式:
(2)被氧化剂氧化:可使酸性高锰酸钾褪色
2)加成反应(与H2、X2、HX、H2O等)
将乙烯气体通入溴水溶液中,可以见到溴的红棕色很快褪去,说明乙烯与溴发生反应。
应用:用于鉴别甲烷和乙烯气体!
CH2=CH2 + Br2 → CH2BrCH2Br
3)、聚合反应(加聚反应)
简写为:
单体
链节
聚合度
由小分子生成高分子化合物的反应叫聚合反应。
练习:请写出CH3CH=CH2分别与H2、Br2、HBr、H2O发生加成反应及加聚的化学方程式。
分别写出下列烯烃的名称及发生加聚反应的化学方程式:
A、CH2=CHCH2CH3;
B、CH3CH=CHCH2CH3;
C、CH3C=CHCH3;
CH3
CnH2n-2 (n≧4)
代表物:
1,3-丁二烯 CH2=CH-CH=CH2
2、二烯烃的通式:
CH2=C-CH=CH2
CH3
2-甲基-1,3-丁二烯
也可叫作:异戊二烯
思考: 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个原子在同一平面上?
1、概念:含有两个碳碳双键(C=C)的不饱和链烃
二烯烃
3、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
CH2=CH-CH=CH2+2Br2
CH2=CH-CH=CH2+Br2
CH2-CH-CH-CH2
Br
Br
Br
Br
CH2-CH-CH=CH2
Br
Br
CH2-CH=CH-CH2
Br
Br
nCH2=CH-CH=CH2
[CH2-CH=CH-CH2]n
1,2 加成
1,4 加成
CH2-CH-CH-CH2
1,2 Br
1,4 Br
(主产物)
1,4 加聚
(中间体)
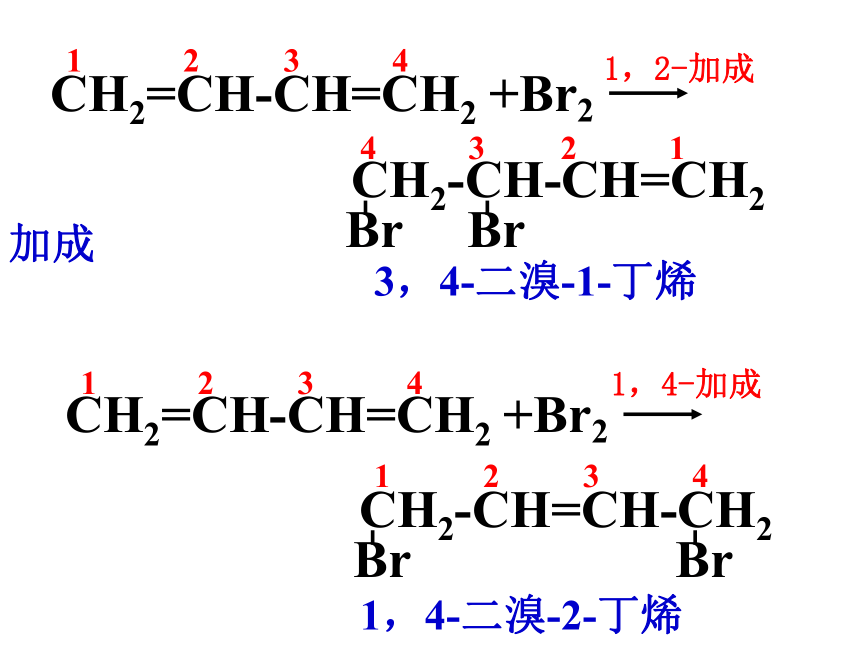
当1molCH2=CH-CH=CH2与1molBr2或Cl2
加成时,其加成产物是什么
CH2=CH-CH=CH2
+Br2
CH2-CH=CH-CH2
Br
Br
CH2=CH-CH=CH2
+Br2
CH2-CH-CH=CH2
Br
Br
1 2 3 4
1 2 3 4
1,2-加成
1,4-加成
加成
3,4-二溴-1-丁烯
4 3 2 1
1,4-二溴-2-丁烯
1 2 3 4
n CH2=CH-CH=CH2
催化剂
、P
1 2 3 4
(1,3-丁二烯)
聚1,3-丁二烯
—CH2-CH=CH-CH2 —
[ ]n
加聚
俗称:异戊二烯 聚异戊二烯
学名:2-甲基-1,3-丁二烯 (天然橡胶)
nCH2=C-CH=CH2 [CH2-C=CH-CH2]n
CH3
CH3
加聚
CH2=C-CH=CH2 和
|
CH3
CH2=C-CH=CH-CH3
|
CH3
写出下列物质发生加聚反应的化学方程式
nCH2=C-CH=CH [ CH2-C=CH-CH ]n
加聚
|
CH3
|
CH3
|
CH3
|
CH3
(2)1,3-丁二烯型
(3)混合型
加聚反应产物及单体
(1)乙烯型
CH2=CH2
-CH2-CH2-n
CH=CH2
CH3
聚合物:
-CH-CH2-n
CH3
单 体:
加聚反应产物及单体
(2)1,3-丁二烯型
(2)1,3-丁二烯型
(3)混合型
(1)乙烯型
CH2=CH-CH=CH2
-CH2-CH=CH-CH2- n
CH=CH-CH=CH2
CH3
-CH-CH=CH-CH2- n
CH3
单体:
单体:
加聚反应产物及单体
(3)混合型
(2)1,3-丁二烯型
(3)混合型
(1)乙烯型
[CH2-CH=CH-CH2-CH2-CH-CH2-CH]n
CH3
CH2=CH-CH=CH2
CH2=CH
CH2=CH
CH3
单 体:
混合型:
思考:
2-丁烯 中,与碳碳双键相连的两个碳原子、两个氢原子是否处于同一平面?
如处于同一平面,与碳碳双键相连的两个碳原子是处于双键的同侧还是异侧?
CH3CH=CHCH3
二、烯烃的顺反异构现象
C=C
C=C
H
H
CH3
CH3
CH3
CH3
H
H
反式异构
顺式异构
如果每个双键碳原子连接了两个不同的原子
或原子团,双键上的4个原子或原子团在空间就有两种不同的排列方式,产生两种不同的异构,
即顺反异构
该有机物能使溴水褪色,说明该有机物中含有不饱和键;
n(Br2) =
80g X 5%
160g/mol
该有机物:
n(C) :n(H)=
所以该有机物为烯烃
1.4g该有机物可与0.025molBr2反应
= 0.025mol
= 1:2
M=
1.4g
0.025mol
=56g/mol
85.7%
12
14.3%
1
:
分析:
分子式 :
C4H8
(2)结构简式:
CH3-CH=CH-CH3
或
CH3-C=CH2
CH3
解答(1)
通常,烷烃可以由相应的烯烃催化加氢得到。但是有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,却分别可由而且只能由1种自己相应的烯烃催化加氢得到。A、B1、B2、B3的结构简式分别 , ,
, 。
A: (CH3)3C-CH2-C(CH3)3
B1: (CH3)3C-C(CH3)2-CH2-CH3
B2: (CH3)2CH-C(CH3)2-CH(CH3)2
B3: C(CH2CH3)4
1、指分子中含有-C≡C-的不饱和烃
三、炔烃:
2、链状单炔烃的通式:CnH2n-2(n≥2)
物理性质:与烷烃和烯烃类似
化学性质:与乙炔相似
1.随碳原子数的增加,溶沸点逐渐升高,相对密度逐渐增大
2.碳原子数小于等于4时,常温常压下为气态
3.炔烃的相对密度小于水的密度
4.炔烃不溶于水,但易溶于有机溶剂
3、乙炔
分子式
电子式
结构式
结构简式
空间结构特点
C2H2
H C C H
直线型
CH≡CH
1)分子结构特点:
H C C H
为避免反应速率过快,用饱和食盐水代替水!!
2)乙炔的实验室制法:
实验装置: P.32图2-6
注意事项:
a、检查气密性;
b、怎样除去杂质气体?
c、气体收集方法
原理:CaC2+2H2O Ca(OH)2+C2H2↑
将气体通过装有CuSO4溶液的洗气瓶
灰白色固体颗粒
C:
C:
Ca2+
+
HO H
HO H
C
C
H
H
+ Ca(OH)2
2-
(1)因电石中含有 CaS、Ca3P2等,也会与水反应,产生H2S、PH3等气体,所以所制乙炔气体会有难闻的臭味;
(2)如何去除乙炔的臭味呢?
乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?
(3)H2S对本实验有影响吗?为什么?
H2S具有较强还原性,能与溴反应,易被酸性高锰酸钾溶液氧化,使其褪色,因而会对该实验造成干扰。
NaOH和CuSO4溶液
1、 因为碳化钙与水反应剧烈,启普发生器不易控制反应;
4、关闭导气阀后,水蒸气仍与电石作用,不能达到“关之即停”的目的.
3、生成物Ca(OH)2微溶于水,易形成糊状泡沫堵塞导气管和球形漏斗的下口;
2、反应放出大量热,启普发生器是厚玻璃壁仪器,容易因胀缩不均,引起破碎 ;
为什么不能用启普发生器制取乙炔?
C
C
Ca2+
2
拓展:
电石的主要成分是一种离子化合物CaC2
电子式为
结构式为
与水反应方程式为:
CaC2 + 2H2O C2H2 + Ca(OH)2
反应过程分析:
C
C
Ca
C
C
Ca
+
HO H
HO H
C
C
H
H
+ Ca(OH)2
实验探究
①将乙炔气体点燃,观察火焰颜色及燃烧情况
②将乙炔气体通入溴水中
③将乙炔气体通入酸性高锰酸钾中
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
注意
a. 氧化反应
(1) 在空气或在氧气中燃烧—完全氧化
2C2H2 + 5O2 4CO2 + 2H2O
点燃
3)乙炔的化学性质:
在空气中的爆炸极限为2.5%~80%
发生爆炸的乙炔气罐
2005年10月7日,广州某地一乙炔气厂发生爆炸。事故原因是乙炔装运补给点出现意外,引发了乙炔仓库爆炸,厂房严重受损,多人伤亡,爆炸产生的火苗还导致周边山林起火,所幸抢险得力,山火被及时扑灭。
氧炔焰:乙炔燃烧放出大量的热,在O2中燃烧,产生的氧炔焰温度高达3000℃以上,可用于切割、焊接金属。
氧炔焰切割金属
焊 枪
(2)被氧化剂氧化:将乙炔气体通往酸性高锰酸钾溶液中,可使酸性高锰酸钾褪色
b、加成反应
将乙炔气体通入溴水溶液中,可以见到溴的红棕色褪去,说明乙炔与溴发生反应。(比乙烯与溴的反应慢)
应用:用于鉴别乙炔和乙烯气体!
CH≡CH + 2Br2 → CHBr2CHBr2
加成反应过程分析
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
练习:写出乙炔与氢气、氯化氢气体发生加成反应的化学反应方程式
与H2加成
+ H2
CH2= CH2
CH CH
催化剂
CH2= CH2
CH3 -CH3
催化剂
+ H2
n CH2=CH -CH2-CH-n
催化剂
Cl
Cl
+ HCl
CH2= CHCl
CH CH
催化剂
与HCl加成
聚氯乙烯在使用的过程中,易发生老化,会变硬、发脆、开裂等,并释放出对人体有害的氯化氢,故不宜使用聚氯乙烯制品直接盛装食物。
聚氯乙烯是一种合成树脂,可用于制备塑料和合成纤维等。聚氯乙烯可由H2、Cl2和乙炔为原料制取。
我国市场上目前大量使用的塑料制品都是不可降解塑料,以发泡聚氯乙烯、聚乙烯或聚丙烯为原料,分子量达2万以上。只有分子量降低到2000以下,才能被自然环境中的微生物所利用,变成水和其它有机质,而这一过程需要200年;如果将其填埋,将会影响农作物吸收养分和水分,导致减产;对其焚烧会释放出多种化学有毒气体,其中有一种叫二恶英的化合物,毒性极大,即使在摄入很小量的情况下,也能使鸟类和鱼类出现畸形和死亡,对生态环境造成破坏,同时对人体有着很大危害。
白色警告
当前治理白色污染主要使用的可降解塑料、以纸代塑、生物全降解等新技术中,以纸代塑被认为是目前综合评价最好的替代技术。用这种方法制作的塑料袋、餐具因其无毒无害、易回收、可再生利用、可降解等优点而被冠以“环保产品”的称号
nCH CH
CH=CH
n
加温、加压
催化剂
(3)加聚反应:导电塑料——聚乙炔
—— 绝缘体变导体
一般在人们的印象中,塑料是不导电的,通常用于普通的电缆中作导电铜丝外面的绝缘层。但是,2000年3名诺贝尔化学奖获得者勇敢地向传统观念提出了挑战。他们通过长期精心地研究,经过对聚合物特殊的改性,使塑料能够表现得像金属一样,具有导电性。这不能不说是一种原创性的开发。
2000年的诺贝尔化学奖授予了美国加利福尼亚大学的物理学家黑格、美国宾夕法尼亚大学的化学家马克迪亚米德和日本筑波大学的化学家白川英树,因为他们发现了导电塑料。
乙
炔
氧化反应
加成反应
点燃
O2
CO2 + H2O
酸性
KMnO4溶液
褪色
H2
催化剂
CH3-CH3
H2
催化剂
CH2=CH2
HCl(HBr)
催化剂,
CH2=CHCl
Br2
(Cl2)
CH=CH
Br
Br
Br2
(Cl2)
CH CH
Br
Br
Br
Br
