4.1.2《海水资源的开发利用》PPT课件(新人教版-必修2)
文档属性
| 名称 | 4.1.2《海水资源的开发利用》PPT课件(新人教版-必修2) |

|
|
| 格式 | zip | ||
| 文件大小 | 630.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-06-02 00:00:00 | ||
图片预览










文档简介
(共32张PPT)
新课标人教版课件系列
《高中化学》
必修2
4.2.2《海水资源的
开发利用》
第四章 化学与可持续发展 第一节《开发利用金属矿物和海水资源 》 第2课时
教学目标
知识与技能
1、帮助学生认识和体会海水资源开发和利用中的意义和作用。
2、揭示化学与可持续发展的重要关系。
3、树立资源保护意识及合理开发意识。
4、初步培养自主查阅资料的能力
过程与方法:
活动动探究,通过了解海洋资源的类型;海水资源的开发及利用现状,培养学生归纳能力、比较能力。
情感态度与价值观:
帮助学生树立节约资源、爱护环境、变废为宝等意识,使学生热爱自然,热爱化学。
教学重点:
了解化学方法在海水资源开发中的作用。
教学难点:
海水资源合理开发综合应用
教具准备:
多媒体、投影仪、电教器材:视频展示台(包括录象),实物投影仪 挂图、标本等
海水资源的利用:
主要有:
1.海水中水资源的利用 海水的淡化(咸水 淡水)
2.直接利用海水进行循环冷却(作冷却用水)
海水的淡化:
(1)海水淡化的途径:
从海水中提取淡水
从海水中分离出盐
(2)海水淡化的方法:
蒸 馏 法(最先使用,技术成熟,但成本高)
电渗析法(成本低,但未能大量生产)
离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
进
冷却水 出
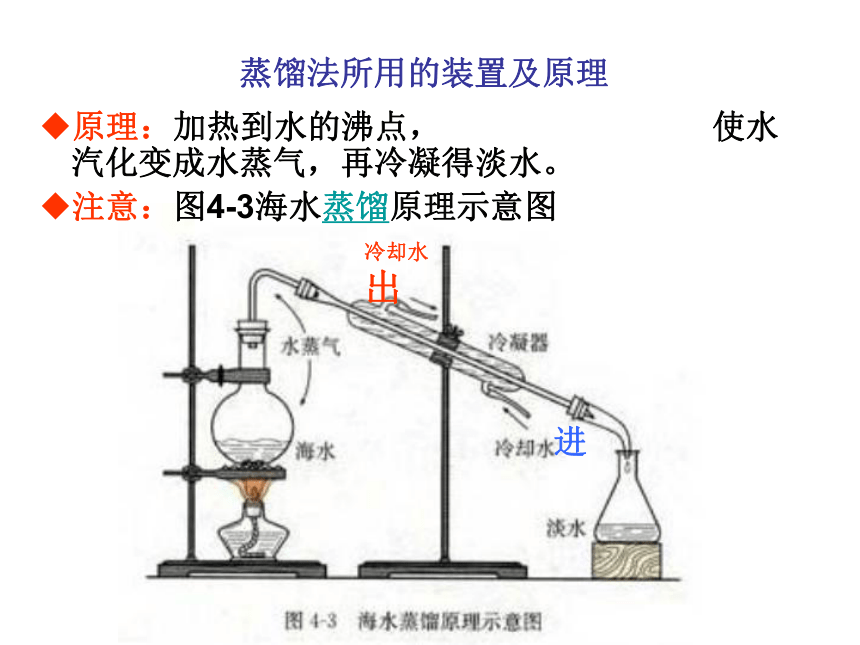
蒸馏法所用的装置及原理
原理:加热到水的沸点, 使水汽化变成水蒸气,再冷凝得淡水。
注意:图4-3海水蒸馏原理示意图
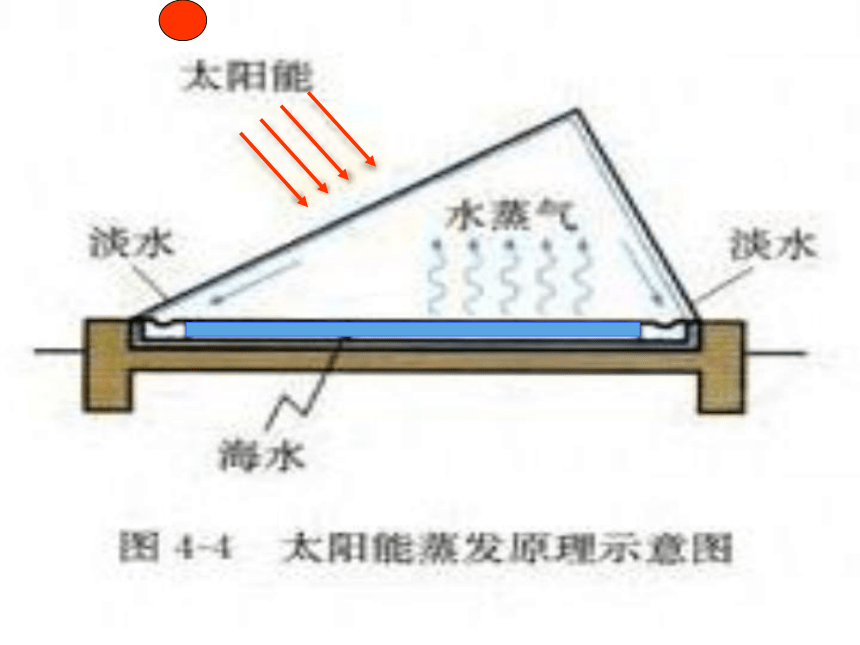
图4-4太阳能蒸发原理示意图
煮
海
为
盐
海水浓缩
过滤
HCl溶液,适量
蒸发结晶
NaOH溶液、 BaCl2溶液、 Na2CO3溶液
过量
食盐的提取
海水的综合利用
(1)海水制盐——生产NaCl
(2) NaCl的水溶液制NaOH
(3)制金属Na
(4)制Na2CO3
2NaCl + 2H2O 电解 H2 + Cl2 + 2NaOH
2NaCl(熔融)电解 2Na + Cl2
2 NaOH + CO2= Na2CO3 + H2O
从海水中制金属镁
海水
蒸发
粗盐 水、重结晶 精盐
母液
Mg(OH)2
盐酸、浓缩 MgCl2 H2O 脱水 MgCl2 电解 Mg
MgCl2 + Ca(OH)2 = Mg(OH)2 ↓ + CaCl2
Mg(OH)2 + 2HCl = MgCl2 + H2O
石灰乳 水 CaO 煅烧 贝壳
MgCl2 通电 Mg + Cl2
从海水中提取溴
(写出有关的化学方程式)
课本P85从海水中提取溴
2 NaBr + Cl2 =2 NaCl + Br2
Br2 + SO2 + 2H2O = 2HBr + H2SO4
2HBr + Cl2 = 2HCl + Br2
海水中提取溴的实验
实验方法:
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的
海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴
离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸
气,将溴单质吹入盛有二氧化硫溶液的吸收
塔内。
(4)向吸收塔中溶液内通入适量的氯气。
(5)用CCl4萃取吸收塔中溶液里的溴单质。
2.如何证明海带中存在碘元素实验4-2
实验方法:
1、取约3克的干海带,用刷子去净其表面上的附着物,把海带剪碎后,用适量酒精浸湿,放入坩埚中
2、把泥三角放在铁三脚架上,将坩埚放在泥三角上,点燃酒精灯将海带灼烧至完全成灰,停止加热,使海带冷却至室温。
3、将海带灰转移到小烧杯中,加入约10mg蒸馏水,搅拌,煮沸2-3min,过滤
4、在滤液中滴入几滴3mol/ L的稀硫酸再加入约1ml3%的H2O2 ,观察现象
5、再向溶液中加入几滴淀粉溶液,再观察现象
实验现象:加入H2O2后,溶液由无色变为深黄色,再加入淀粉溶液后,溶液又变为深蓝色
化学方程式:2KI+ H2O2+H2SO4=I2 +K2SO4+2H2O
图4-5 海水综合利用联合工业体系一例
练习
1.镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气的是( )
(1)空气 (2)CO2 (3) Ar
(4) H2 (5) N2
A.(1)(2) B.(2)(3)
C.(3)(4) D.(4)(5)
由于镁很活泼,是还原性很强的金属,所以加热时能与许多气体物质反应。如空气、二氧化碳、氮气等,但不与氢气和稀有气体反应。镁与氮气的反应化学方程式为:
3Mg + N2 Mg3N2
C
2.稀硫酸中加入铜片,无现象,再加入下列某物质后,见铜片逐渐溶解,溶液呈蓝色。该物质为( )
A.NaCl B.KNO3
C.Ca(OH)2 D.Fe
3.下列叙述中所描述的物质一定是金属元素的是( )
A.易失去电子的物质
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有2个电子的元素
B
D
4.铝加入下列物质中会产生气体的是( )
A.熔融NaOH B.KOH溶液
C.Na2O2 固体 D.Na2O2和水
5.铝热剂中铝的作用是( )
A.催化剂 B.氧化剂
C.还原剂 D.填充剂
B D
C
6.下列金属氧化物,不能用碳还原制得金属单质的是( )
A.氧化铁 B.氧化铝
C.氧化镁 D.氧化铜
7.列说法中不正确的是( )
A.金属的冶炼原理,就是利用氧化还原反应原理,用还原剂在一定条件下将金属从矿石中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一般较弱
B C
B C
8.下列冶炼金属的反应,一定是置换反应的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁
9.下列冶炼金属的反应,一定是分解反应的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁
C
A B
10.冶炼下列金属时,常用还原剂把它从化合物中还原出来的是( )
A.钠 B.镁
C.铝 D.铁
11.列金属冶炼方法与其他三种不同的是( )
A.Fe B.K
C.Mg D.Al
D
A
12.电解法炼铝时,冰晶石的作用是 ( )
A. 熔剂 B. 溶剂
C. 还原剂 D.氧化剂
13.下列海洋资源中属于可再生资源的是( )
A. 海底石油、天然气
B. 潮汐能
C. 滨海砂矿
D.锰结核
A
B
14.下列哪种方法不能实现海水的淡化( )
A.蒸馏法 B.电渗析法
C.离子交换法 D.电解法
15.用铝热剂冶炼金属,是利用了铝的( )
(1)具有还原性 (2)即能与酸反应又能与碱反应
(3)具有导电性 (4)被氧化过程放出大量热
A.(1) B.(1)(3)(4)
C.(1)(4) D.(1)(2)(3)(4)
D
C
16.下列说法正确的是( )
A.有些活泼金属如铝可作还原法的还原剂
B.用电解氯化钠溶液的方法可冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收废旧金属,可以重新制成金属或它们的化合物
17.下列金属中,即可用热分解法又可用电解法制备的是( )
A.Fe B.Cu
C.Al D.Ag
A D
D
18.通入氯气,把海水中的溴化物氧化成单质溴,该反应的离子方程式为:
19.把生成的溴从溶液中吹出,用纯碱(Na2CO3)溶液吸收(生成NaBr、NaBrO3、CO2),这一过程的化学方程式为
Cl2+2Br-=2Cl-+Br2
3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2
20.下列属于海水化学资源利用的是( )
A.海水淡化 B.海水提盐
C.海水提溴 D.海水发电
21.冶炼金属一般有下列四种方法(1)焦炭法;(2)水煤气(或氢气、一氧化碳)法;(3)活泼金属置换法;(4)电解法。四种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜;(II)湿法炼铜;(III)铝热法炼铬;(IV)从光卤石中炼镁,对他们的冶炼方法分析不正确的是( )
A.I用(1) B.II用(2) C.III用(3) D.IV用(4)
B C
选择金属的冶炼方法与金属在自然界中存在的状态、金属活泼性有关,光卤石中炼镁是指:先从光卤石中提取MgCl2,再电解MgCl2。
B
22.将吸收溴单质的溶液加入过量的硫酸酸化,即可得溴单质,该反应的离子方程式为
23.根据金属在金属活动性顺序中的位置及性质,推测制取下列金属最适宜的方法。
(1)Na: ;
(2)Zn: ;
(3)Hg: ;
(4)Fe: 。
5Br-+BrO3-+6H+ =Br2+3H2O
电解法
热还原法
热分解法
热还原法
24.铁是在地壳中含量很丰富的元素,也是生物体内所必需的元素。自然界中的铁矿石主要有赤铁矿和磁铁矿。金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还须加入焦炭和石灰石,请填空:
(1)写出磁铁矿的主要成分的化学式
(2)写出赤铁矿被还原成铁的化学方程式
(3)写出焦炭在高炉中参与反应的两个化学方程式
(4)写出石灰石所参与的两个化学方程式
Fe3O4
Fe2O3+3CO 2Fe+3CO2
C+O2 CO2 C O2+C 2CO
CaCO3 CaO+CO2↑ CaO+SiO2 CaSiO3
25.试用化学方程式表示制取硝酸铜的四种方式
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
②Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③Cu+2AgNO3=Cu(NO3)2+2Ag
④2Cu+O2 2CuO,
CuO+2HNO3=Cu(NO3)2+H2O
因为方案①、②均有污染大气的有毒气体NO、NO2生成,方案③中AgNO3的价格比HNO3昂贵。故从环境保护和经济效益角度考虑,大量制取硝酸铜时,应选用方案④。
26.用H2做还原剂和用金属做还原剂相比较,所得金属的纯度( )
A.用H2高 B.用金属的高
C.二者相同 D.无法比较
用H2还原的产物是金属和水,水受热挥发,只得到金属;用金属还原所得的是混合物(金属与金属的化合物)。
A
27.下列有关热分解冶炼金属的说法不正确的是 ( )
A.Ag2O受热就能分解,Ag用热分解法制得
B.Ag2O受热分解的反应中,Ag2O既是氧化剂又是还原剂
C.ZnCO3高温下可分解,Zn可用热分解法制得
D.工业上制汞既可用热分解法也可用热还原法
热分解法用于冶炼不活泼的金属,不活泼金属的阳离子氧化性较强,可被还原剂还原。
C
新课标人教版课件系列
《高中化学》
必修2
4.2.2《海水资源的
开发利用》
第四章 化学与可持续发展 第一节《开发利用金属矿物和海水资源 》 第2课时
教学目标
知识与技能
1、帮助学生认识和体会海水资源开发和利用中的意义和作用。
2、揭示化学与可持续发展的重要关系。
3、树立资源保护意识及合理开发意识。
4、初步培养自主查阅资料的能力
过程与方法:
活动动探究,通过了解海洋资源的类型;海水资源的开发及利用现状,培养学生归纳能力、比较能力。
情感态度与价值观:
帮助学生树立节约资源、爱护环境、变废为宝等意识,使学生热爱自然,热爱化学。
教学重点:
了解化学方法在海水资源开发中的作用。
教学难点:
海水资源合理开发综合应用
教具准备:
多媒体、投影仪、电教器材:视频展示台(包括录象),实物投影仪 挂图、标本等
海水资源的利用:
主要有:
1.海水中水资源的利用 海水的淡化(咸水 淡水)
2.直接利用海水进行循环冷却(作冷却用水)
海水的淡化:
(1)海水淡化的途径:
从海水中提取淡水
从海水中分离出盐
(2)海水淡化的方法:
蒸 馏 法(最先使用,技术成熟,但成本高)
电渗析法(成本低,但未能大量生产)
离子交换法(目前正迅速发展,但需要不断更新离子交换树脂)
进
冷却水 出
蒸馏法所用的装置及原理
原理:加热到水的沸点, 使水汽化变成水蒸气,再冷凝得淡水。
注意:图4-3海水蒸馏原理示意图
图4-4太阳能蒸发原理示意图
煮
海
为
盐
海水浓缩
过滤
HCl溶液,适量
蒸发结晶
NaOH溶液、 BaCl2溶液、 Na2CO3溶液
过量
食盐的提取
海水的综合利用
(1)海水制盐——生产NaCl
(2) NaCl的水溶液制NaOH
(3)制金属Na
(4)制Na2CO3
2NaCl + 2H2O 电解 H2 + Cl2 + 2NaOH
2NaCl(熔融)电解 2Na + Cl2
2 NaOH + CO2= Na2CO3 + H2O
从海水中制金属镁
海水
蒸发
粗盐 水、重结晶 精盐
母液
Mg(OH)2
盐酸、浓缩 MgCl2 H2O 脱水 MgCl2 电解 Mg
MgCl2 + Ca(OH)2 = Mg(OH)2 ↓ + CaCl2
Mg(OH)2 + 2HCl = MgCl2 + H2O
石灰乳 水 CaO 煅烧 贝壳
MgCl2 通电 Mg + Cl2
从海水中提取溴
(写出有关的化学方程式)
课本P85从海水中提取溴
2 NaBr + Cl2 =2 NaCl + Br2
Br2 + SO2 + 2H2O = 2HBr + H2SO4
2HBr + Cl2 = 2HCl + Br2
海水中提取溴的实验
实验方法:
(1)用蒸馏法将海水浓缩。用硫酸将浓缩的
海水酸化。
(2)向酸化的海水中通入适量的氯气,使溴
离子转化为溴单质。
(3)向含溴单质的水溶液中通入空气和水蒸
气,将溴单质吹入盛有二氧化硫溶液的吸收
塔内。
(4)向吸收塔中溶液内通入适量的氯气。
(5)用CCl4萃取吸收塔中溶液里的溴单质。
2.如何证明海带中存在碘元素实验4-2
实验方法:
1、取约3克的干海带,用刷子去净其表面上的附着物,把海带剪碎后,用适量酒精浸湿,放入坩埚中
2、把泥三角放在铁三脚架上,将坩埚放在泥三角上,点燃酒精灯将海带灼烧至完全成灰,停止加热,使海带冷却至室温。
3、将海带灰转移到小烧杯中,加入约10mg蒸馏水,搅拌,煮沸2-3min,过滤
4、在滤液中滴入几滴3mol/ L的稀硫酸再加入约1ml3%的H2O2 ,观察现象
5、再向溶液中加入几滴淀粉溶液,再观察现象
实验现象:加入H2O2后,溶液由无色变为深黄色,再加入淀粉溶液后,溶液又变为深蓝色
化学方程式:2KI+ H2O2+H2SO4=I2 +K2SO4+2H2O
图4-5 海水综合利用联合工业体系一例
练习
1.镁粉是焰火、闪光粉中不可缺少的原料,工业制造镁粉是将镁蒸气在气体中冷却,下列可作为冷却气的是( )
(1)空气 (2)CO2 (3) Ar
(4) H2 (5) N2
A.(1)(2) B.(2)(3)
C.(3)(4) D.(4)(5)
由于镁很活泼,是还原性很强的金属,所以加热时能与许多气体物质反应。如空气、二氧化碳、氮气等,但不与氢气和稀有气体反应。镁与氮气的反应化学方程式为:
3Mg + N2 Mg3N2
C
2.稀硫酸中加入铜片,无现象,再加入下列某物质后,见铜片逐渐溶解,溶液呈蓝色。该物质为( )
A.NaCl B.KNO3
C.Ca(OH)2 D.Fe
3.下列叙述中所描述的物质一定是金属元素的是( )
A.易失去电子的物质
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有2个电子的元素
B
D
4.铝加入下列物质中会产生气体的是( )
A.熔融NaOH B.KOH溶液
C.Na2O2 固体 D.Na2O2和水
5.铝热剂中铝的作用是( )
A.催化剂 B.氧化剂
C.还原剂 D.填充剂
B D
C
6.下列金属氧化物,不能用碳还原制得金属单质的是( )
A.氧化铁 B.氧化铝
C.氧化镁 D.氧化铜
7.列说法中不正确的是( )
A.金属的冶炼原理,就是利用氧化还原反应原理,用还原剂在一定条件下将金属从矿石中还原出来
B.冶炼金属时,必须加入一种物质作为还原剂
C.金属由化合态变为游离态,都是被还原
D.金属单质被发现和应用得越早,其活动性一般较弱
B C
B C
8.下列冶炼金属的反应,一定是置换反应的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁
9.下列冶炼金属的反应,一定是分解反应的是( )
A.热分解法 B.电解法
C.铝热法炼铁 D.高炉炼铁
C
A B
10.冶炼下列金属时,常用还原剂把它从化合物中还原出来的是( )
A.钠 B.镁
C.铝 D.铁
11.列金属冶炼方法与其他三种不同的是( )
A.Fe B.K
C.Mg D.Al
D
A
12.电解法炼铝时,冰晶石的作用是 ( )
A. 熔剂 B. 溶剂
C. 还原剂 D.氧化剂
13.下列海洋资源中属于可再生资源的是( )
A. 海底石油、天然气
B. 潮汐能
C. 滨海砂矿
D.锰结核
A
B
14.下列哪种方法不能实现海水的淡化( )
A.蒸馏法 B.电渗析法
C.离子交换法 D.电解法
15.用铝热剂冶炼金属,是利用了铝的( )
(1)具有还原性 (2)即能与酸反应又能与碱反应
(3)具有导电性 (4)被氧化过程放出大量热
A.(1) B.(1)(3)(4)
C.(1)(4) D.(1)(2)(3)(4)
D
C
16.下列说法正确的是( )
A.有些活泼金属如铝可作还原法的还原剂
B.用电解氯化钠溶液的方法可冶炼金属钠
C.可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D.回收废旧金属,可以重新制成金属或它们的化合物
17.下列金属中,即可用热分解法又可用电解法制备的是( )
A.Fe B.Cu
C.Al D.Ag
A D
D
18.通入氯气,把海水中的溴化物氧化成单质溴,该反应的离子方程式为:
19.把生成的溴从溶液中吹出,用纯碱(Na2CO3)溶液吸收(生成NaBr、NaBrO3、CO2),这一过程的化学方程式为
Cl2+2Br-=2Cl-+Br2
3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2
20.下列属于海水化学资源利用的是( )
A.海水淡化 B.海水提盐
C.海水提溴 D.海水发电
21.冶炼金属一般有下列四种方法(1)焦炭法;(2)水煤气(或氢气、一氧化碳)法;(3)活泼金属置换法;(4)电解法。四种方法在工业上均有应用。古代有(I)火烧孔雀石炼铜;(II)湿法炼铜;(III)铝热法炼铬;(IV)从光卤石中炼镁,对他们的冶炼方法分析不正确的是( )
A.I用(1) B.II用(2) C.III用(3) D.IV用(4)
B C
选择金属的冶炼方法与金属在自然界中存在的状态、金属活泼性有关,光卤石中炼镁是指:先从光卤石中提取MgCl2,再电解MgCl2。
B
22.将吸收溴单质的溶液加入过量的硫酸酸化,即可得溴单质,该反应的离子方程式为
23.根据金属在金属活动性顺序中的位置及性质,推测制取下列金属最适宜的方法。
(1)Na: ;
(2)Zn: ;
(3)Hg: ;
(4)Fe: 。
5Br-+BrO3-+6H+ =Br2+3H2O
电解法
热还原法
热分解法
热还原法
24.铁是在地壳中含量很丰富的元素,也是生物体内所必需的元素。自然界中的铁矿石主要有赤铁矿和磁铁矿。金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还须加入焦炭和石灰石,请填空:
(1)写出磁铁矿的主要成分的化学式
(2)写出赤铁矿被还原成铁的化学方程式
(3)写出焦炭在高炉中参与反应的两个化学方程式
(4)写出石灰石所参与的两个化学方程式
Fe3O4
Fe2O3+3CO 2Fe+3CO2
C+O2 CO2 C O2+C 2CO
CaCO3 CaO+CO2↑ CaO+SiO2 CaSiO3
25.试用化学方程式表示制取硝酸铜的四种方式
①3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
②Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
③Cu+2AgNO3=Cu(NO3)2+2Ag
④2Cu+O2 2CuO,
CuO+2HNO3=Cu(NO3)2+H2O
因为方案①、②均有污染大气的有毒气体NO、NO2生成,方案③中AgNO3的价格比HNO3昂贵。故从环境保护和经济效益角度考虑,大量制取硝酸铜时,应选用方案④。
26.用H2做还原剂和用金属做还原剂相比较,所得金属的纯度( )
A.用H2高 B.用金属的高
C.二者相同 D.无法比较
用H2还原的产物是金属和水,水受热挥发,只得到金属;用金属还原所得的是混合物(金属与金属的化合物)。
A
27.下列有关热分解冶炼金属的说法不正确的是 ( )
A.Ag2O受热就能分解,Ag用热分解法制得
B.Ag2O受热分解的反应中,Ag2O既是氧化剂又是还原剂
C.ZnCO3高温下可分解,Zn可用热分解法制得
D.工业上制汞既可用热分解法也可用热还原法
热分解法用于冶炼不活泼的金属,不活泼金属的阳离子氧化性较强,可被还原剂还原。
C
