第七章 第三节 几种重要的盐 第二课时:复分解反应及其应用 课件—2020-2021学年九年级化学沪教版下册(19张PPT)
文档属性
| 名称 | 第七章 第三节 几种重要的盐 第二课时:复分解反应及其应用 课件—2020-2021学年九年级化学沪教版下册(19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 265.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-24 06:45:00 | ||
图片预览






文档简介
(共19张PPT)
7.3几种重要的盐
第二课时:复分解反应及其应用
掌握复分解反应发生的条件
学习目标
运用复分解反应解决物质的共存问题
理解复分解反应的实质
化学反应的基本类型
木炭在空气中燃烧
电解水
锌粒加入稀硫酸中
氢氧化钠和稀盐酸
化合反应
分解反应
置换反应
复分解反应
一、复分解反应的发生条件
1、在溶液中
(反应物:有酸溶于酸,无酸均可溶)
2、
(交换成分,化合价不变)
3、有沉淀、气体或水生成
常见的生成气体:CO2
NH3
常见的生成沉淀:
CaCO3
BaCO3
BaSO4
AgCl
等
Cu(OH)2
Fe(OH)3
Mg(OH)2
Al(OH)3
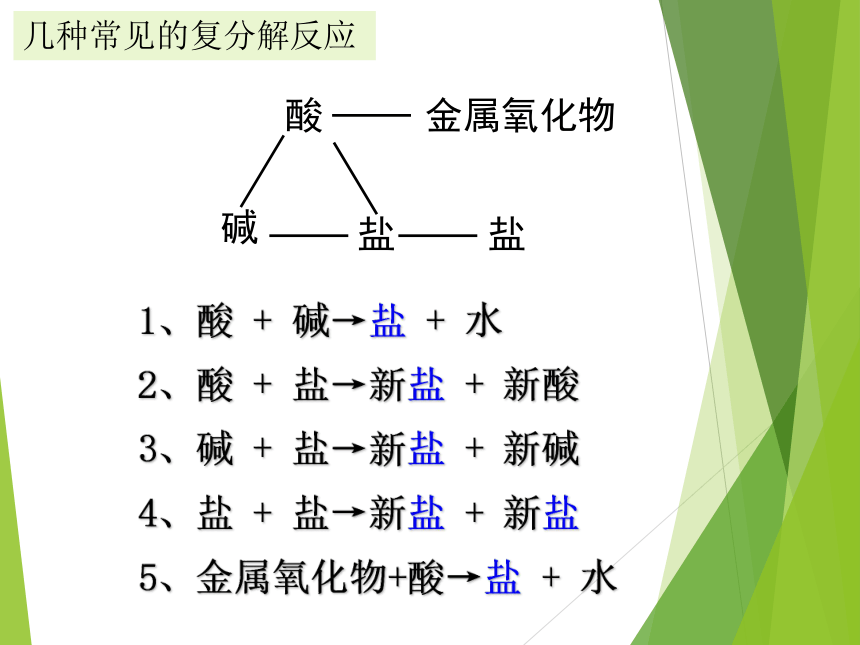
酸
碱
盐
盐
1、酸
+
碱→盐
+
水
2、酸
+
盐→新盐
+
新酸
3、碱
+
盐→新盐
+
新碱
4、盐
+
盐→新盐
+
新盐
5、金属氧化物+酸→盐
+
水
金属氧化物
几种常见的复分解反应
1、酸
+
碱→盐
+
水(条件:一般都能发生)
2、酸
+
盐→新盐
+
新酸
(条件:盐为碳酸盐或盐都可溶,且生成物有沉淀或气体)
3、碱
+
盐→新盐
+
新碱
(条件:反应物二者均可溶,且生成中至少一种为沉淀)
4、盐
+
盐→新盐1
+
新盐2
(条件:反应物二者均可溶,且生成中至少一种为沉淀)
碱
Cu(OH)2
蓝色沉淀
难溶于水,可溶于酸
Fe(OH)3
红褐色沉淀
难溶于水,可溶于酸
Mg(OH)2
白色沉淀
难溶于水,可溶于酸
Al(OH)3
白色沉淀
难溶于水,可溶于酸
盐
CaCO3
白色沉淀
难溶于水,
可溶于酸,与酸反应产生气泡
BaCO3
白色沉淀
难溶于水,
可溶于酸,与酸反应产生气泡
★AgCl
白色沉淀
既不溶于水,也不溶于酸
★BaSO4
白色沉淀
既不溶于水,也不溶于酸
几种常见的沉淀
1、分别将下列各组物质同时放入水中,能发生复分解反应的是(
)
A.氯化钠和硫酸钾
B.硫酸铜和氢氧化铁
C.碳酸钠和氯化钡
D.碳酸钙和氢氧化铜
NaCl
+
K2SO4—
CuSO4+Fe(OH)3
—
Na2CO3
+BaCl2=
CaCO3
+
Cu(OH)2—
溶
溶
溶
不溶
溶
溶
不溶
不溶
不反应
不反应
不反应
2NaCl+BaCO3↓
C
2、下列物质能在水溶液中大量共存的是(
)
A.CuSO4
和
NaOH
B.Ba(NO3)2和Na2SO4
C.Na2CO3
和
HCl
D.CaCl2和KNO3
D
交流讨论
1、KNO3和NaNO3一般不会与其他物质发生复分解反应,为什么?
钾盐、钠盐和硝酸盐都是可溶的,不存在发生复分解反应的条件(有气体、水或沉淀生成),所以KNO3和NaNO3一般不与其他物质发生复分解反应。
2、有哪些反应可以得到MgSO4?试写出反应的化学方程式。
置换反应
置换反应
复分解反应
复分解反应
酸碱中和反应的实质是:
二、复分解反应的微观实质
Ba2+
Cl-
H+
SO42-
H+
Cl-
反应前
反应后
BaSO4
Na+
CO32-
H+
Cl-
Na+
Cl-
H20
反应前
反应后
本质:两种物质在水溶液中交换离子,结合生成沉淀、气体或水。使溶液中离子的浓度减小。
三、复分解反应的应用
1、判断物质或离子能否在溶液中大量共存
物质相互间不反应或离子间不能结合生成
沉淀、气体、水就
能在溶液中大量共存
①生成水不能大量共存:H+与OH-
②生成气体不能大量共存:H+与CO32-
OH-与NH4+
③生成沉淀不能大量共存:OH-与Cu2+
、Fe3+
、Mg2+等;
CO32-与Ca2+、
Ba2+
、Ag+等;
Cl-与Ag+
SO42-与Ba2+
例2:下列各组离子在溶液中会发生反应的是(
)
A、Ca2+
Cl-
B、H+
OH-
C、H+
SO42-
D、
Na+
SO42-
B
例1、下列同组物质在水溶液中能大量共存的是(
)
A、
Na2CO3
NaHCO3
HCl
B、
NaCl
AgNO3
HNO3
C、KNO3
KCl
NaOH
D、NaOH
BaCl2
H2SO4
C
例3、以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是(
)
Fe3+
SO42-
H+
Cl-
Mg2+
Cl-
OH-
Na+
C.
H+
Ba2+
NO3-
SO42-
D.
H+
Na+
K+
NO3-
D
2、物质的鉴别
实验操作
现象与结论
方法1
方法2
方法3
溶液中Cl-的检验方法:
如何区分NaCl溶液和
Na2CO3溶液?
取少量溶液于试管中,滴加硝酸银溶液,产生白色沉淀,再滴加稀硝酸,若沉淀不溶解,则原溶液中含有Cl-
实验操作
现象与结论
方法1
方法2
方法3
如何区分Na2CO3溶液和Na2SO4溶液?
(查资料得硫酸钠溶液为中性)
溶液中SO42-的检验方法:
取少量溶液于试管中,滴加稀盐酸,无明显想象,再滴加氯化钡溶液,若产生白色沉淀,则原溶液中含有SO42-。
7.3几种重要的盐
第二课时:复分解反应及其应用
掌握复分解反应发生的条件
学习目标
运用复分解反应解决物质的共存问题
理解复分解反应的实质
化学反应的基本类型
木炭在空气中燃烧
电解水
锌粒加入稀硫酸中
氢氧化钠和稀盐酸
化合反应
分解反应
置换反应
复分解反应
一、复分解反应的发生条件
1、在溶液中
(反应物:有酸溶于酸,无酸均可溶)
2、
(交换成分,化合价不变)
3、有沉淀、气体或水生成
常见的生成气体:CO2
NH3
常见的生成沉淀:
CaCO3
BaCO3
BaSO4
AgCl
等
Cu(OH)2
Fe(OH)3
Mg(OH)2
Al(OH)3
酸
碱
盐
盐
1、酸
+
碱→盐
+
水
2、酸
+
盐→新盐
+
新酸
3、碱
+
盐→新盐
+
新碱
4、盐
+
盐→新盐
+
新盐
5、金属氧化物+酸→盐
+
水
金属氧化物
几种常见的复分解反应
1、酸
+
碱→盐
+
水(条件:一般都能发生)
2、酸
+
盐→新盐
+
新酸
(条件:盐为碳酸盐或盐都可溶,且生成物有沉淀或气体)
3、碱
+
盐→新盐
+
新碱
(条件:反应物二者均可溶,且生成中至少一种为沉淀)
4、盐
+
盐→新盐1
+
新盐2
(条件:反应物二者均可溶,且生成中至少一种为沉淀)
碱
Cu(OH)2
蓝色沉淀
难溶于水,可溶于酸
Fe(OH)3
红褐色沉淀
难溶于水,可溶于酸
Mg(OH)2
白色沉淀
难溶于水,可溶于酸
Al(OH)3
白色沉淀
难溶于水,可溶于酸
盐
CaCO3
白色沉淀
难溶于水,
可溶于酸,与酸反应产生气泡
BaCO3
白色沉淀
难溶于水,
可溶于酸,与酸反应产生气泡
★AgCl
白色沉淀
既不溶于水,也不溶于酸
★BaSO4
白色沉淀
既不溶于水,也不溶于酸
几种常见的沉淀
1、分别将下列各组物质同时放入水中,能发生复分解反应的是(
)
A.氯化钠和硫酸钾
B.硫酸铜和氢氧化铁
C.碳酸钠和氯化钡
D.碳酸钙和氢氧化铜
NaCl
+
K2SO4—
CuSO4+Fe(OH)3
—
Na2CO3
+BaCl2=
CaCO3
+
Cu(OH)2—
溶
溶
溶
不溶
溶
溶
不溶
不溶
不反应
不反应
不反应
2NaCl+BaCO3↓
C
2、下列物质能在水溶液中大量共存的是(
)
A.CuSO4
和
NaOH
B.Ba(NO3)2和Na2SO4
C.Na2CO3
和
HCl
D.CaCl2和KNO3
D
交流讨论
1、KNO3和NaNO3一般不会与其他物质发生复分解反应,为什么?
钾盐、钠盐和硝酸盐都是可溶的,不存在发生复分解反应的条件(有气体、水或沉淀生成),所以KNO3和NaNO3一般不与其他物质发生复分解反应。
2、有哪些反应可以得到MgSO4?试写出反应的化学方程式。
置换反应
置换反应
复分解反应
复分解反应
酸碱中和反应的实质是:
二、复分解反应的微观实质
Ba2+
Cl-
H+
SO42-
H+
Cl-
反应前
反应后
BaSO4
Na+
CO32-
H+
Cl-
Na+
Cl-
H20
反应前
反应后
本质:两种物质在水溶液中交换离子,结合生成沉淀、气体或水。使溶液中离子的浓度减小。
三、复分解反应的应用
1、判断物质或离子能否在溶液中大量共存
物质相互间不反应或离子间不能结合生成
沉淀、气体、水就
能在溶液中大量共存
①生成水不能大量共存:H+与OH-
②生成气体不能大量共存:H+与CO32-
OH-与NH4+
③生成沉淀不能大量共存:OH-与Cu2+
、Fe3+
、Mg2+等;
CO32-与Ca2+、
Ba2+
、Ag+等;
Cl-与Ag+
SO42-与Ba2+
例2:下列各组离子在溶液中会发生反应的是(
)
A、Ca2+
Cl-
B、H+
OH-
C、H+
SO42-
D、
Na+
SO42-
B
例1、下列同组物质在水溶液中能大量共存的是(
)
A、
Na2CO3
NaHCO3
HCl
B、
NaCl
AgNO3
HNO3
C、KNO3
KCl
NaOH
D、NaOH
BaCl2
H2SO4
C
例3、以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是(
)
Fe3+
SO42-
H+
Cl-
Mg2+
Cl-
OH-
Na+
C.
H+
Ba2+
NO3-
SO42-
D.
H+
Na+
K+
NO3-
D
2、物质的鉴别
实验操作
现象与结论
方法1
方法2
方法3
溶液中Cl-的检验方法:
如何区分NaCl溶液和
Na2CO3溶液?
取少量溶液于试管中,滴加硝酸银溶液,产生白色沉淀,再滴加稀硝酸,若沉淀不溶解,则原溶液中含有Cl-
实验操作
现象与结论
方法1
方法2
方法3
如何区分Na2CO3溶液和Na2SO4溶液?
(查资料得硫酸钠溶液为中性)
溶液中SO42-的检验方法:
取少量溶液于试管中,滴加稀盐酸,无明显想象,再滴加氯化钡溶液,若产生白色沉淀,则原溶液中含有SO42-。
