2.7元素符号表示的量(1)教学课件(共16张PPT)
文档属性
| 名称 | 2.7元素符号表示的量(1)教学课件(共16张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 426.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-09-15 09:55:30 | ||
图片预览


文档简介
(共16张PPT)
第七节
元素符号表示的量(1)
已知一个氢原子的质量为1.674×10-27kg,一个氧原子的质量为2.657×10-26kg,分别计算H2O和H2O2中的氢元素和氧元素的质量比(取整数)。
1.知道相对原子质量和相对分子质量的概念。(a)
2.查阅相对原子质量。(b)
3.根据化学式计算物质的相对分子质量。(b)
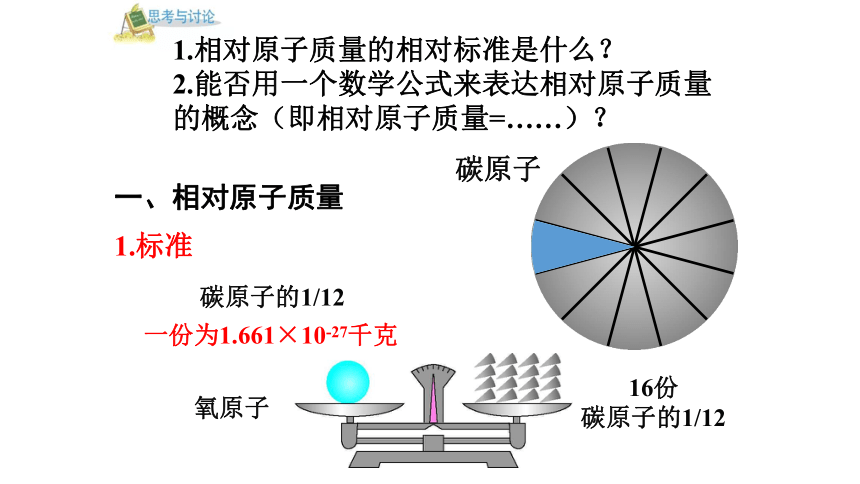
氧原子
16份
碳原子的1/12
1.标准
1.相对原子质量的相对标准是什么?
2.能否用一个数学公式来表达相对原子质量的概念(即相对原子质量=……)?
一、相对原子质量
一份为1.661×10-27千克
碳原子
碳原子的1/12
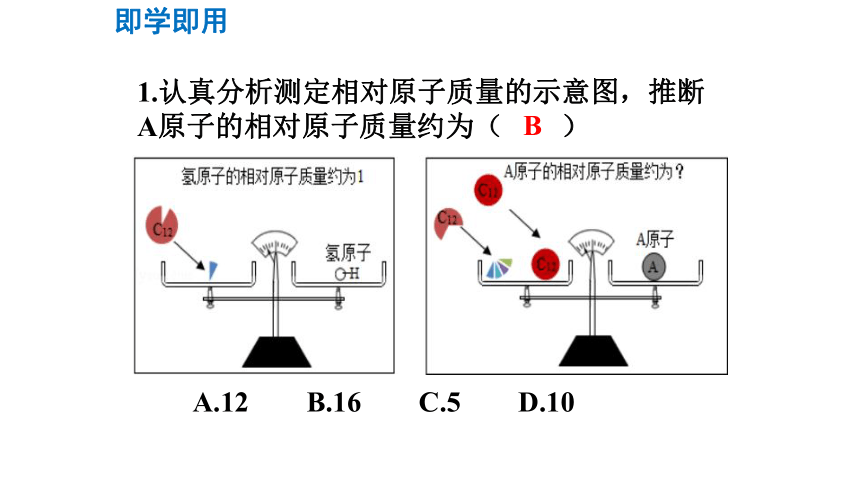
1.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.12
B.16
C.5
D.10
即学即用
B
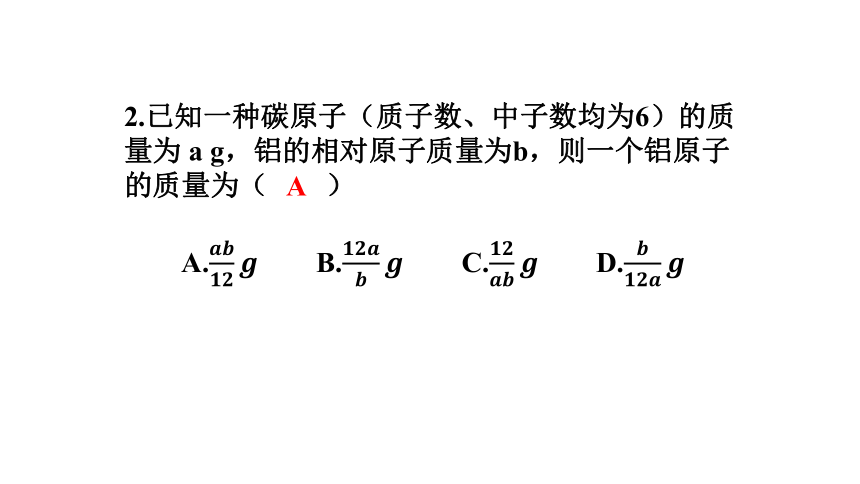
2.已知一种碳原子(质子数、中子数均为6)的质量为
a
g,铝的相对原子质量为b,则一个铝原子的质量为( )
A.
B.
C.
D.
A
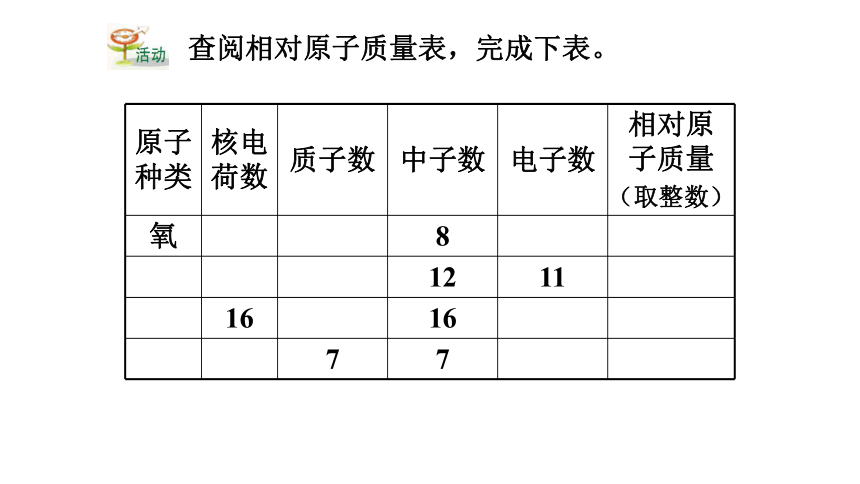
原子
种类
核电
荷数
质子数
中子数
电子数
相对原子质量
(取整数)
氧
8
12
11
16
16
7
7
查阅相对原子质量表,完成下表。
原子
种类
核电
荷数
质子数
中子数
电子数
相对原子质量
(取整数)
氧
8
8
8
8
16
钠
11
11
12
11
23
硫
16
16
16
16
32
氮
7
7
7
7
14
查阅相对原子质量表,完成下表。
微
粒
质量/千克
相对质量
说
明
碳原子
1.993×10-26
12
6个质子,6个中子
质子
1.6726×10-27
1
质子质量≈中子质量
中子
1.6748×10-27
1
电子
9.1176×10-31
1/1834
电子质量是质子质量的1/1834
相对原子质量
质子数
中子数
≈
+
2.近似计算公式
3.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为( )
A.x+y
B.x+y+n
C.x-n+y
D.x+n-y
即学即用
B
5.为什么元素的相对原子质量会有小数?
元素的相对原子质量是其各种同位素相对原子质量的加权平均值。
原子
质子数
中子数
丰度
C-12
6
6
0.9893
C-13
6
7
0.0107
已知C的相对原子质量12,O的相对原子质量16,求CO2的相对分子质量。
CO2(二氧化碳分子)的相对分子质量
=
12
×
+
1
16
×
2
=
44
二、相对分子质量
4.已知各元素的相对原子质量为:C—12
O—16
H—1
N—14
Na—23
S—32
Cu—64
求下列物质的相对分子质量:
CH4_____
NaOH_____
CO(NH2)2_____
CuSO4·5H2O
______
16
40
60
250
即学即用
小结
1.相对原子质量的相对标准是什么?
2.为什么要用相对质量,而不用绝对质量?
3.能否用一个数学公式来表达相对原子质量(即相对原子质量=……)?
4.为什么要选用C-12质量的1/12作为标准,选用C-12质量的1/10作为标准可以吗?
5.为什么元素的相对原子质量会有小数?
6.相对分子质量如何计算?
元素的相对原子质量基准的变革
基准
建议人
采用年代
Ar(H)=1
道尔顿
1803
Ar(O)=100
贝采里乌斯
1826
Ar(O)=16
斯塔斯
1860
Ar(O-16)=16
阿斯通
1929
Ar(C-12)=12
马陶赫
1961
CO2
1.表示二氧化碳这种物质;
2.表示二氧化碳由碳元素和氧元素组成;
3.表示1个二氧化碳分子;
4.表示二氧化碳分子由碳原子和氧原子构成;
5.表示1个二氧化碳分子由1个碳原子和2个氧原子构成;
6.表示二氧化碳中碳原子和氧原子的个数比为1∶2;
7.表示二氧化碳分子的相对分子质量为44。
2.下列相对分子质量计算正确的是(
)
A.
NO2:14×16×2=448
B.
2NH3:2×14+1×3=31
C.
O2:16×2=32克
D.
2Ca(OH)
2:2[40+(16+1)×2]
=148
随堂练习
1.甲原子与乙原子的质量比为a∶b,而乙原子与碳原子的质量比为c∶d,则甲原子的相对原子质量为( )
A.
B.
C.
D.
A
D
3.下列各种原子各
l
g,所含原子个数最多的是(括号内是该原子的相对原子质量)( )
A.氧原子(32)
B.铁原子(56)
C.氢原子(1)
D.碳原子(12)
C
第七节
元素符号表示的量(1)
已知一个氢原子的质量为1.674×10-27kg,一个氧原子的质量为2.657×10-26kg,分别计算H2O和H2O2中的氢元素和氧元素的质量比(取整数)。
1.知道相对原子质量和相对分子质量的概念。(a)
2.查阅相对原子质量。(b)
3.根据化学式计算物质的相对分子质量。(b)
氧原子
16份
碳原子的1/12
1.标准
1.相对原子质量的相对标准是什么?
2.能否用一个数学公式来表达相对原子质量的概念(即相对原子质量=……)?
一、相对原子质量
一份为1.661×10-27千克
碳原子
碳原子的1/12
1.认真分析测定相对原子质量的示意图,推断A原子的相对原子质量约为( )
A.12
B.16
C.5
D.10
即学即用
B
2.已知一种碳原子(质子数、中子数均为6)的质量为
a
g,铝的相对原子质量为b,则一个铝原子的质量为( )
A.
B.
C.
D.
A
原子
种类
核电
荷数
质子数
中子数
电子数
相对原子质量
(取整数)
氧
8
12
11
16
16
7
7
查阅相对原子质量表,完成下表。
原子
种类
核电
荷数
质子数
中子数
电子数
相对原子质量
(取整数)
氧
8
8
8
8
16
钠
11
11
12
11
23
硫
16
16
16
16
32
氮
7
7
7
7
14
查阅相对原子质量表,完成下表。
微
粒
质量/千克
相对质量
说
明
碳原子
1.993×10-26
12
6个质子,6个中子
质子
1.6726×10-27
1
质子质量≈中子质量
中子
1.6748×10-27
1
电子
9.1176×10-31
1/1834
电子质量是质子质量的1/1834
相对原子质量
质子数
中子数
≈
+
2.近似计算公式
3.某阳离子Mn+的核外电子共有x个电子,核内有y个中子,则M的相对原子质量约为( )
A.x+y
B.x+y+n
C.x-n+y
D.x+n-y
即学即用
B
5.为什么元素的相对原子质量会有小数?
元素的相对原子质量是其各种同位素相对原子质量的加权平均值。
原子
质子数
中子数
丰度
C-12
6
6
0.9893
C-13
6
7
0.0107
已知C的相对原子质量12,O的相对原子质量16,求CO2的相对分子质量。
CO2(二氧化碳分子)的相对分子质量
=
12
×
+
1
16
×
2
=
44
二、相对分子质量
4.已知各元素的相对原子质量为:C—12
O—16
H—1
N—14
Na—23
S—32
Cu—64
求下列物质的相对分子质量:
CH4_____
NaOH_____
CO(NH2)2_____
CuSO4·5H2O
______
16
40
60
250
即学即用
小结
1.相对原子质量的相对标准是什么?
2.为什么要用相对质量,而不用绝对质量?
3.能否用一个数学公式来表达相对原子质量(即相对原子质量=……)?
4.为什么要选用C-12质量的1/12作为标准,选用C-12质量的1/10作为标准可以吗?
5.为什么元素的相对原子质量会有小数?
6.相对分子质量如何计算?
元素的相对原子质量基准的变革
基准
建议人
采用年代
Ar(H)=1
道尔顿
1803
Ar(O)=100
贝采里乌斯
1826
Ar(O)=16
斯塔斯
1860
Ar(O-16)=16
阿斯通
1929
Ar(C-12)=12
马陶赫
1961
CO2
1.表示二氧化碳这种物质;
2.表示二氧化碳由碳元素和氧元素组成;
3.表示1个二氧化碳分子;
4.表示二氧化碳分子由碳原子和氧原子构成;
5.表示1个二氧化碳分子由1个碳原子和2个氧原子构成;
6.表示二氧化碳中碳原子和氧原子的个数比为1∶2;
7.表示二氧化碳分子的相对分子质量为44。
2.下列相对分子质量计算正确的是(
)
A.
NO2:14×16×2=448
B.
2NH3:2×14+1×3=31
C.
O2:16×2=32克
D.
2Ca(OH)
2:2[40+(16+1)×2]
=148
随堂练习
1.甲原子与乙原子的质量比为a∶b,而乙原子与碳原子的质量比为c∶d,则甲原子的相对原子质量为( )
A.
B.
C.
D.
A
D
3.下列各种原子各
l
g,所含原子个数最多的是(括号内是该原子的相对原子质量)( )
A.氧原子(32)
B.铁原子(56)
C.氢原子(1)
D.碳原子(12)
C
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
