3.3.1化学方程式 教学课件 (16张PPT)
文档属性
| 名称 | 3.3.1化学方程式 教学课件 (16张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 780.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-09-15 11:37:04 | ||
图片预览





文档简介
(共16张PPT)
第3节
化学方程式
(第一课时)
教学目标:
1、通过对化学反应中反应物及生成物质量的实验测定,了解质量守恒定律,通过对化学反应的实质分析,认识在化学反应中各反应物质量总和与各生成物质量总和相等的原因,培养分析推理能力。
2、通过具体化学反应分析,了解化学方程式包含的意义。了解书写化学方程式要遵循的原则,初步学会化学方程式的书写和配平(最小公倍数法)。
3、在了解化学方程式意义的基础上,能根据化学方程式进行反应物质量和生成物质量之间的计算。通过有关化学方程式的计算练习,规范解题格式。
教学重难点:
重点:化合反应和分解反应的区别;质量守恒定律;化学方程式的意义、书写和配平;化学方程式的计算练习。
难点:质量守恒定律;化学方程式的意义、书写和配平;化学方程式的计算练习。
一、质量守恒定律:
【思考】食盐溶于水形成盐水属于化合反应吗?
溶解前后物质之间的质量存在怎样的关系呢?
【思考】在化学反应中,反应前物质的质量总和与反应后物质的质量总和存在怎样的规律呢?
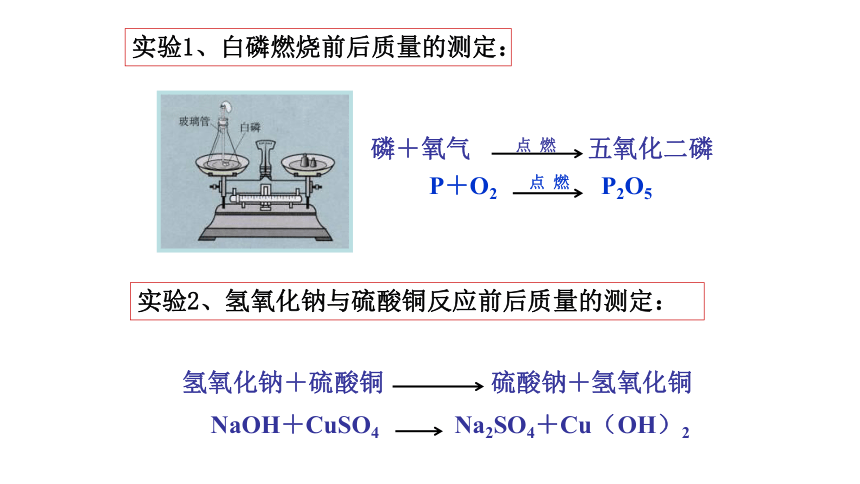
实验1、白磷燃烧前后质量的测定:
实验2、氢氧化钠与硫酸铜反应前后质量的测定:
磷+氧气
点
燃
五氧化二磷
P+O2
点
燃
P2O5
氢氧化钠+硫酸铜
硫酸钠+氢氧化铜
NaOH+CuSO4
Na2SO4+Cu(OH)2
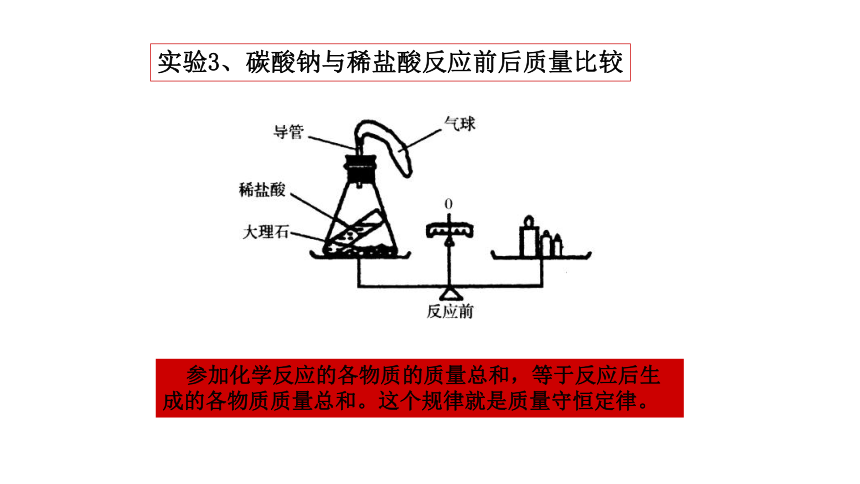
实验3、碳酸钠与稀盐酸反应前后质量比较
参加化学反应的各物质的质量总和,等于反应后生成的各物质质量总和。这个规律就是质量守恒定律。
水的电解:
二、质量守恒定律的微观解释:
H2O
O2+H2
通电
不变
改变
质量守恒定律
原子数目
原子质量
原子种类
微观
分子的种类
物质的总质量
元素质量
元素种类
物质的种类
宏观
六
二
下列事实是否违背质量守恒定律
纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
高锰酸钾受热分解后,固体的质量变小
蜡烛燃烧后消失
三、运用质量守恒定律应注意:
1.
质量守恒定律只适用化学变化,不适用物理变化。
2.
“参加化学反应”是指真正参加反应了的那部分物质质量,不算没参加反应的质量。
3.
质量守恒定律的内容是指”质量”,
不能推广到其他物理量。
解决问题:
1.
某可燃物燃烧后的产物中有CO2和H2O,根据质量守恒定律可知,该物质的组成中一定含有______元素,可能含有_____元素。
2.一氧化氮是大气的主要污染物之一,近几年来又发现生物体内存在少量一氧化氮,它有扩张血管、增加记忆的功能,成为当前生命科学研究的热点。工业上制得一氧化氮的化学方程式为4x
+
5O2
==
4NO
+
6H2O,
则
x的化学式为______。
C、H
O
NH3
【口诀】左反应,右生成;化学式、须正确;
系数平,原子等;等号连,条件清;
生成气体和沉淀,上下箭头来表明。
【练习】
1.下列化学方程式是否正确?为什么?
(1)C2H2+O2
CO2+H2O
(2)2HgO
2Hg+O2↑
(3)KMnO4===K2MnO4+MnO2+O2
(4)Zn+CuSO4===Cu↓+ZnSO4
2、试写出下列反应的化学方程式:
①硫在氧气中燃烧生成二氧化硫
②磷在氧气中燃烧生成五氧化二磷
③铁在氧气中燃烧生成四氧化三铁
④氢气与灼热的氧化铜反应生成铜和水
.写出下列反应的化学方程式,并计算各物质的质量比。
①实验室用加热氯酸钾和二氧化锰混合物的方法制氧气
②实验室用锌与稀硫酸反应制氢气
第3节
化学方程式
(第一课时)
教学目标:
1、通过对化学反应中反应物及生成物质量的实验测定,了解质量守恒定律,通过对化学反应的实质分析,认识在化学反应中各反应物质量总和与各生成物质量总和相等的原因,培养分析推理能力。
2、通过具体化学反应分析,了解化学方程式包含的意义。了解书写化学方程式要遵循的原则,初步学会化学方程式的书写和配平(最小公倍数法)。
3、在了解化学方程式意义的基础上,能根据化学方程式进行反应物质量和生成物质量之间的计算。通过有关化学方程式的计算练习,规范解题格式。
教学重难点:
重点:化合反应和分解反应的区别;质量守恒定律;化学方程式的意义、书写和配平;化学方程式的计算练习。
难点:质量守恒定律;化学方程式的意义、书写和配平;化学方程式的计算练习。
一、质量守恒定律:
【思考】食盐溶于水形成盐水属于化合反应吗?
溶解前后物质之间的质量存在怎样的关系呢?
【思考】在化学反应中,反应前物质的质量总和与反应后物质的质量总和存在怎样的规律呢?
实验1、白磷燃烧前后质量的测定:
实验2、氢氧化钠与硫酸铜反应前后质量的测定:
磷+氧气
点
燃
五氧化二磷
P+O2
点
燃
P2O5
氢氧化钠+硫酸铜
硫酸钠+氢氧化铜
NaOH+CuSO4
Na2SO4+Cu(OH)2
实验3、碳酸钠与稀盐酸反应前后质量比较
参加化学反应的各物质的质量总和,等于反应后生成的各物质质量总和。这个规律就是质量守恒定律。
水的电解:
二、质量守恒定律的微观解释:
H2O
O2+H2
通电
不变
改变
质量守恒定律
原子数目
原子质量
原子种类
微观
分子的种类
物质的总质量
元素质量
元素种类
物质的种类
宏观
六
二
下列事实是否违背质量守恒定律
纸在空气中燃烧后化为灰烬,灰烬的质量比纸的质量小
高锰酸钾受热分解后,固体的质量变小
蜡烛燃烧后消失
三、运用质量守恒定律应注意:
1.
质量守恒定律只适用化学变化,不适用物理变化。
2.
“参加化学反应”是指真正参加反应了的那部分物质质量,不算没参加反应的质量。
3.
质量守恒定律的内容是指”质量”,
不能推广到其他物理量。
解决问题:
1.
某可燃物燃烧后的产物中有CO2和H2O,根据质量守恒定律可知,该物质的组成中一定含有______元素,可能含有_____元素。
2.一氧化氮是大气的主要污染物之一,近几年来又发现生物体内存在少量一氧化氮,它有扩张血管、增加记忆的功能,成为当前生命科学研究的热点。工业上制得一氧化氮的化学方程式为4x
+
5O2
==
4NO
+
6H2O,
则
x的化学式为______。
C、H
O
NH3
【口诀】左反应,右生成;化学式、须正确;
系数平,原子等;等号连,条件清;
生成气体和沉淀,上下箭头来表明。
【练习】
1.下列化学方程式是否正确?为什么?
(1)C2H2+O2
CO2+H2O
(2)2HgO
2Hg+O2↑
(3)KMnO4===K2MnO4+MnO2+O2
(4)Zn+CuSO4===Cu↓+ZnSO4
2、试写出下列反应的化学方程式:
①硫在氧气中燃烧生成二氧化硫
②磷在氧气中燃烧生成五氧化二磷
③铁在氧气中燃烧生成四氧化三铁
④氢气与灼热的氧化铜反应生成铜和水
.写出下列反应的化学方程式,并计算各物质的质量比。
①实验室用加热氯酸钾和二氧化锰混合物的方法制氧气
②实验室用锌与稀硫酸反应制氢气
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
