化学反应与质量守恒(化学方程式)复习
图片预览






文档简介
(共26张PPT)
知识目标 1、通过分析具体化学反应,掌握化学方程式的涵义; 2、能初步掌握化学方程式的书写原则和步骤。 能力目标 1、通过化学反应的具体分析,培养学生的逻辑思维能力; 2、通过化学方程式的书写步骤的练习,培养学生逻辑思维的有序性。 情感目标 结合化学方程式书写原则的教学,使学生体会到应具有尊重事实、实事求是的科学态度。
1、书写化学方程式的原则:
(1)以客观事实为依据
(2)要遵循质量守恒定律(即在式子左、右两边各原子的种类与数目必须相等。)
写出反应物生成物的化学式
配平(体现质量守恒定律)
注明反应条件及生成物状态
等号代替短线
2、书写步骤:
Al + O2 Al2O3
点燃
Al + Fe3O4 Al2O3 + Fe
高温
Al + H2SO4 Al2(SO4)3 + H2
↑
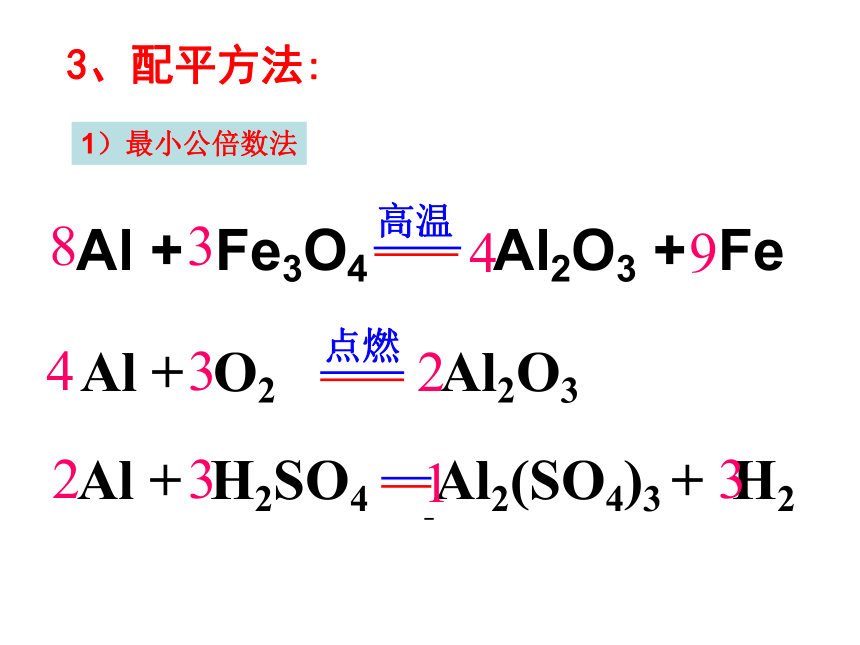
3、配平方法:
4
2
2
8
3
4
9
3
3
3
1
1)最小公倍数法
2)奇数化偶法
FeS2 + O2高温 Fe2O3 + SO2
C2H4+ O2 点燃 CO2 + H2O
C6H6 + O2 点燃 CO2 + H2O
4
11
2
8
3
2
2
2
15
12
6
1
CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
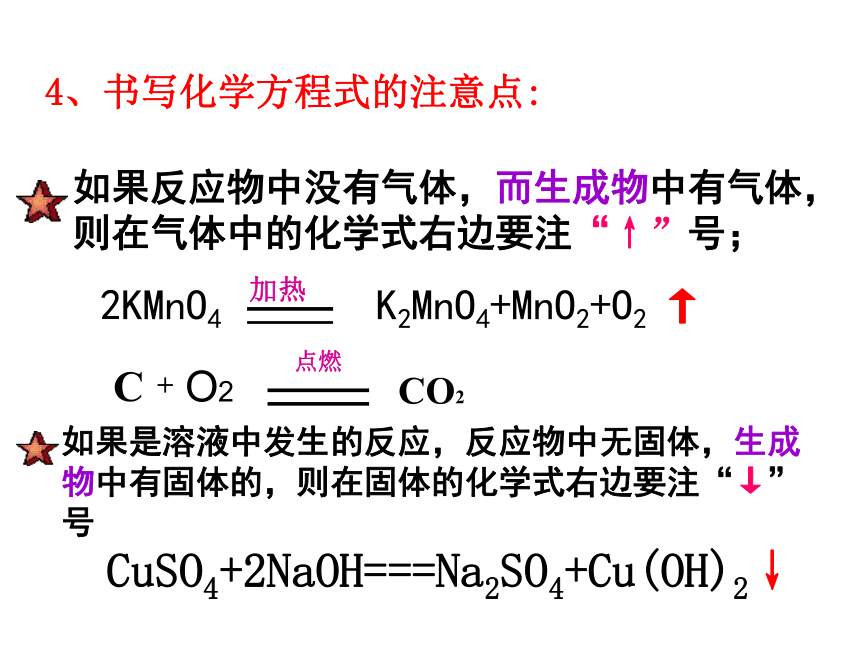
如果反应物中没有气体,而生成物中有气体,则在气体中的化学式右边要注“↑”号;
2KMnO4 K2MnO4+MnO2+O2 ↑
加热
4、书写化学方程式的注意点:
如果是溶液中发生的反应,反应物中无固体,生成物中有固体的,则在固体的化学式右边要注“↓”号
点燃
C
CO2
++
O2
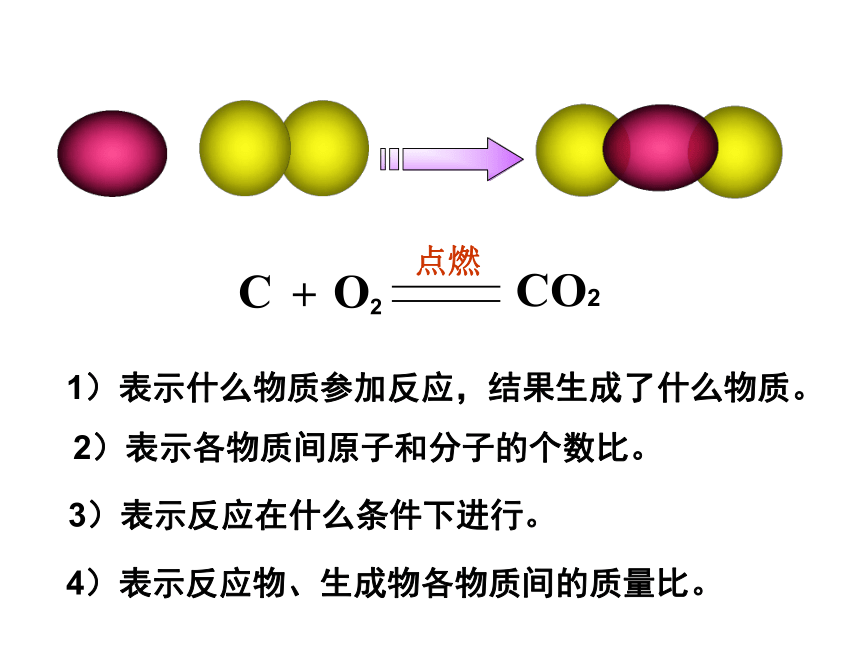
二、化学方程式的读法
在点燃的条件下,碳和氧气反应生成二氧化碳。
在点燃的条件下,每一个碳原子和一个氧分子反应,生成一个二氧化碳分子。
宏观上:
微观上:
C
CO2
+
点燃
O2
在点燃的条件下,每12份质量的碳和32份质量的氧气反应生成44份质量的二氧化碳。
质量上:
点燃
C
CO2
+
O2
1)表示什么物质参加反应,结果生成了什么物质。
4)表示反应物、生成物各物质间的质量比。
2)表示各物质间原子和分子的个数比。
3)表示反应在什么条件下进行。
A、宏观上:表示什么物质参加反应,结果生成了什么物质。
B、表示反应在什么条件下进行。
C、微观上:表示各物质间原子和分子的个数比。
D、质量上:表示反应物、生成物各物质间的质量比。
三、化学方程式的意义
说一说:S+O2 SO2
点燃
1)表示什么物质参加反应,结果生成了什么物质。
4)表示反应物、生成物各物质间的质量比。
2)表示各物质间原子和分子的个数比。
3)表示反应在什么条件下进行。
指出下列化学方程式的错误
1. P2+O5 P2O5
2. Fe+O2 Fe3O4
3. C+O2↑ CO2
4. S+O2 SO2↑
5. 2KMnO4↓ K2MnO4+MnO2↓+O2↑
点燃
点燃
点燃
点燃
△
练习1:配平下列化学方程式
H2 + O2 —— H2O
Na + Cl2 —— NaCl
KMnO4 —— K2MnO4 + MnO2 + O2
Fe2O3 + HCl —— FeCl3 + H2O
Fe2O3 + H2SO4—— Fe2(SO4)3 + H2O
Ca(OH)2 + K2CO3 —— CaCO3 + KOH
Fe2O3 + CO —— Fe + CO2
点燃
高温
点燃
练习2:写出下列反应的化学方程式
镁在氧气中燃烧,生成氧化镁
电解水,生成氢气和氧气
细铁丝在氧气中燃烧,生成四氧化三铁
氧化汞受热分解成汞和氧气
铝与稀硫酸反应,生成硫酸铝和氢气
乙炔(C2H2)在氧气中燃烧,生成二氧化碳和水
2004年4月15日,重庆天元化工厂发生氯气(Cl2)泄漏事故,继而发生氯气罐爆炸,周围十五万群众紧急撤离。氯气是一种黄绿色、有毒、有剧烈刺激性气味的气体,相同情况下密度比空气大,能溶于水,并与水反应生成盐酸(HCl)和次氯酸(HClO)。
(1)根据以上信息,氯气的物理性质有______________________________________________________
(2)消防队员用高压水枪溶解弥漫空气中的氯气,写出氯气与水反应的化学方程式:
______________________________________________________
(3)将氯气通入含氢氧化钙Ca(OH)2的水池中,使氯气不再对周围居民造成伤害。已知氯气与Ca(OH)2的反应方程式为:Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2X
则X的化学式为:______________
(4)请为现场居民提出自救的建议:_________________________________________
黄绿色、有剧烈刺激性气味的气体,密度比空气大,能溶于水
Cl2 +H2O=HCl +HClO
H2O
用湿毛巾捂住口鼻
2Mg + O2 ====== 2 Mg O
2×24 :16×2 : (24+16)×2
48 : 32 : 80
即: 48克 : ( )克 : ( )克
若: 96克 : ( )克 : ( )克
若: ( )克 : 128克 : ( )克
写出镁在氧气中燃烧生成氧化镁的化学方程式,并求出反应物、生成物各物质间的质量比
点燃
若: ( )克 : ( )克 : 40克
32
80
64
160
192
320
24
64
例1:加热分解12.25克氯酸钾,可得到多少克的氧气?同时生成氯化钾多少克?
解:设可得到氧气的质量为X。
2KCIO3
======
MnO2
△
2KCI
+3O2
↑
245
96
12.25克
X
245
-------
96
=
12.25克
-------
X
X =
2.3 克
答:解5.8克氯酸钾可得到氧气 2.3克。
……………...……….方
…………….…………设
}
…………...………….关
……………….……….. 比
…………………...……算
……………………….…..答
149
y
245 12.25克
------- = ----------
149 y
y = ---------------
245
149×12.25克
= 7.45克
可生成氯化钾7.45克.
生成氯化钾的质量为Y
例2:实验室里用分解过氧化氢的方法制取氧气。现要制得2克氧气,需要多少克过氧化氢?
68
2g
=4.3g
x
=
x
解:设需要过氧化氢质量为x。
答:需要过氧化氢4.3g。
2H2O + O2↑
2H2O2
MnO2
32
2g
32
68
x
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
7、6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有 克氧气 参加了反应。
16
练习
8、某同学实验前称得42.5g过氧化氢溶液,加入1g二氧化锰,完全反应后称得剩余物的质量为41.9g。计算:反应中放出氧气的质量
(1)122.5克氯酸钾在40克二氧化锰作催化剂的条件下完全分解能得到多少克氧气?如改用电解水的方法,需要多少克水?
(2)将7克铁粉与足量的盐酸反应,产生的氢气在标准状况下的体积是多少升?(标准状况下氢气的密度为0.0899g/L)
Fe + 2HCl == FeCl2 + H2↑
(3)将9.48克高锰酸钾充分加热后,试管中剩余固体的质量是多少?
(4)在2A + B == 3C + D反应中已知25克A与10克
B恰好完全反应,生成5克C,当反应有6克D生成
时,参加反应的A是多少克?
(5)在2A + B == 2C反应中,1.2克A完全反应生
成2克C,B的相对分子质量是32,则C的相对分
子质量为多少?
(6)把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
①这三次实验,从数据看,哪几次符合质量守恒定律?
②第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
③第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
第一次 第二次 第三次
氧气质量/克 8 16 24
碳质量/克 3 12 6
生成的CO2的质量/克 11 22 22
(7)在一个密闭的容器内有X、Y、Z、Q四种物质,一定
条件下反应一段时间后,测得反应前后各物质的质量如
下,试推断容器中的反应式有可能是( )
A、X+Y→Z+Q B、Z+Q→X+Y
C、Y→Z+Q D、Z+Q→Y
物质 X Y Z Q
反应前质量/g 20 20 20 20
反应后质量/g 20 30 16 14
D
将氯酸钾和二氧化锰的混合物32.5g加热,完全反应后,冷却称得剩余固体为22.9 g , 求:
(1)制得氧气多少克
(2)剩余固体物质里含有哪些物质,各多少克
(3)原混合物中氯酸钾的质量为多少克
思考:
参考答案: (1)9.6g
(2)KCl: 14.9g MnO2:8g
(3)24.5g
知识目标 1、通过分析具体化学反应,掌握化学方程式的涵义; 2、能初步掌握化学方程式的书写原则和步骤。 能力目标 1、通过化学反应的具体分析,培养学生的逻辑思维能力; 2、通过化学方程式的书写步骤的练习,培养学生逻辑思维的有序性。 情感目标 结合化学方程式书写原则的教学,使学生体会到应具有尊重事实、实事求是的科学态度。
1、书写化学方程式的原则:
(1)以客观事实为依据
(2)要遵循质量守恒定律(即在式子左、右两边各原子的种类与数目必须相等。)
写出反应物生成物的化学式
配平(体现质量守恒定律)
注明反应条件及生成物状态
等号代替短线
2、书写步骤:
Al + O2 Al2O3
点燃
Al + Fe3O4 Al2O3 + Fe
高温
Al + H2SO4 Al2(SO4)3 + H2
↑
3、配平方法:
4
2
2
8
3
4
9
3
3
3
1
1)最小公倍数法
2)奇数化偶法
FeS2 + O2高温 Fe2O3 + SO2
C2H4+ O2 点燃 CO2 + H2O
C6H6 + O2 点燃 CO2 + H2O
4
11
2
8
3
2
2
2
15
12
6
1
CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
如果反应物中没有气体,而生成物中有气体,则在气体中的化学式右边要注“↑”号;
2KMnO4 K2MnO4+MnO2+O2 ↑
加热
4、书写化学方程式的注意点:
如果是溶液中发生的反应,反应物中无固体,生成物中有固体的,则在固体的化学式右边要注“↓”号
点燃
C
CO2
++
O2
二、化学方程式的读法
在点燃的条件下,碳和氧气反应生成二氧化碳。
在点燃的条件下,每一个碳原子和一个氧分子反应,生成一个二氧化碳分子。
宏观上:
微观上:
C
CO2
+
点燃
O2
在点燃的条件下,每12份质量的碳和32份质量的氧气反应生成44份质量的二氧化碳。
质量上:
点燃
C
CO2
+
O2
1)表示什么物质参加反应,结果生成了什么物质。
4)表示反应物、生成物各物质间的质量比。
2)表示各物质间原子和分子的个数比。
3)表示反应在什么条件下进行。
A、宏观上:表示什么物质参加反应,结果生成了什么物质。
B、表示反应在什么条件下进行。
C、微观上:表示各物质间原子和分子的个数比。
D、质量上:表示反应物、生成物各物质间的质量比。
三、化学方程式的意义
说一说:S+O2 SO2
点燃
1)表示什么物质参加反应,结果生成了什么物质。
4)表示反应物、生成物各物质间的质量比。
2)表示各物质间原子和分子的个数比。
3)表示反应在什么条件下进行。
指出下列化学方程式的错误
1. P2+O5 P2O5
2. Fe+O2 Fe3O4
3. C+O2↑ CO2
4. S+O2 SO2↑
5. 2KMnO4↓ K2MnO4+MnO2↓+O2↑
点燃
点燃
点燃
点燃
△
练习1:配平下列化学方程式
H2 + O2 —— H2O
Na + Cl2 —— NaCl
KMnO4 —— K2MnO4 + MnO2 + O2
Fe2O3 + HCl —— FeCl3 + H2O
Fe2O3 + H2SO4—— Fe2(SO4)3 + H2O
Ca(OH)2 + K2CO3 —— CaCO3 + KOH
Fe2O3 + CO —— Fe + CO2
点燃
高温
点燃
练习2:写出下列反应的化学方程式
镁在氧气中燃烧,生成氧化镁
电解水,生成氢气和氧气
细铁丝在氧气中燃烧,生成四氧化三铁
氧化汞受热分解成汞和氧气
铝与稀硫酸反应,生成硫酸铝和氢气
乙炔(C2H2)在氧气中燃烧,生成二氧化碳和水
2004年4月15日,重庆天元化工厂发生氯气(Cl2)泄漏事故,继而发生氯气罐爆炸,周围十五万群众紧急撤离。氯气是一种黄绿色、有毒、有剧烈刺激性气味的气体,相同情况下密度比空气大,能溶于水,并与水反应生成盐酸(HCl)和次氯酸(HClO)。
(1)根据以上信息,氯气的物理性质有______________________________________________________
(2)消防队员用高压水枪溶解弥漫空气中的氯气,写出氯气与水反应的化学方程式:
______________________________________________________
(3)将氯气通入含氢氧化钙Ca(OH)2的水池中,使氯气不再对周围居民造成伤害。已知氯气与Ca(OH)2的反应方程式为:Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2X
则X的化学式为:______________
(4)请为现场居民提出自救的建议:_________________________________________
黄绿色、有剧烈刺激性气味的气体,密度比空气大,能溶于水
Cl2 +H2O=HCl +HClO
H2O
用湿毛巾捂住口鼻
2Mg + O2 ====== 2 Mg O
2×24 :16×2 : (24+16)×2
48 : 32 : 80
即: 48克 : ( )克 : ( )克
若: 96克 : ( )克 : ( )克
若: ( )克 : 128克 : ( )克
写出镁在氧气中燃烧生成氧化镁的化学方程式,并求出反应物、生成物各物质间的质量比
点燃
若: ( )克 : ( )克 : 40克
32
80
64
160
192
320
24
64
例1:加热分解12.25克氯酸钾,可得到多少克的氧气?同时生成氯化钾多少克?
解:设可得到氧气的质量为X。
2KCIO3
======
MnO2
△
2KCI
+3O2
↑
245
96
12.25克
X
245
-------
96
=
12.25克
-------
X
X =
2.3 克
答:解5.8克氯酸钾可得到氧气 2.3克。
……………...……….方
…………….…………设
}
…………...………….关
……………….……….. 比
…………………...……算
……………………….…..答
149
y
245 12.25克
------- = ----------
149 y
y = ---------------
245
149×12.25克
= 7.45克
可生成氯化钾7.45克.
生成氯化钾的质量为Y
例2:实验室里用分解过氧化氢的方法制取氧气。现要制得2克氧气,需要多少克过氧化氢?
68
2g
=4.3g
x
=
x
解:设需要过氧化氢质量为x。
答:需要过氧化氢4.3g。
2H2O + O2↑
2H2O2
MnO2
32
2g
32
68
x
则生成氧化镁
的质量为____克
24克镁与16克氧气恰好完全反应,
40
7、6克碳与一定量的氧气恰好完全反应,生成二氧化碳22克,有 克氧气 参加了反应。
16
练习
8、某同学实验前称得42.5g过氧化氢溶液,加入1g二氧化锰,完全反应后称得剩余物的质量为41.9g。计算:反应中放出氧气的质量
(1)122.5克氯酸钾在40克二氧化锰作催化剂的条件下完全分解能得到多少克氧气?如改用电解水的方法,需要多少克水?
(2)将7克铁粉与足量的盐酸反应,产生的氢气在标准状况下的体积是多少升?(标准状况下氢气的密度为0.0899g/L)
Fe + 2HCl == FeCl2 + H2↑
(3)将9.48克高锰酸钾充分加热后,试管中剩余固体的质量是多少?
(4)在2A + B == 3C + D反应中已知25克A与10克
B恰好完全反应,生成5克C,当反应有6克D生成
时,参加反应的A是多少克?
(5)在2A + B == 2C反应中,1.2克A完全反应生
成2克C,B的相对分子质量是32,则C的相对分
子质量为多少?
(6)把一定质量的碳放在一定质量的氧气中燃烧。实验数据如下表:
①这三次实验,从数据看,哪几次符合质量守恒定律?
②第二次实验为什么不生成28克CO2?哪种物质有剩余?余下多少克?
③第三次实验为什么不生成30克CO2?哪种物质有剩余?余下多少克?
第一次 第二次 第三次
氧气质量/克 8 16 24
碳质量/克 3 12 6
生成的CO2的质量/克 11 22 22
(7)在一个密闭的容器内有X、Y、Z、Q四种物质,一定
条件下反应一段时间后,测得反应前后各物质的质量如
下,试推断容器中的反应式有可能是( )
A、X+Y→Z+Q B、Z+Q→X+Y
C、Y→Z+Q D、Z+Q→Y
物质 X Y Z Q
反应前质量/g 20 20 20 20
反应后质量/g 20 30 16 14
D
将氯酸钾和二氧化锰的混合物32.5g加热,完全反应后,冷却称得剩余固体为22.9 g , 求:
(1)制得氧气多少克
(2)剩余固体物质里含有哪些物质,各多少克
(3)原混合物中氯酸钾的质量为多少克
思考:
参考答案: (1)9.6g
(2)KCl: 14.9g MnO2:8g
(3)24.5g
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
