第1章 第3节 1 认识同周期元素性质的递变规律
文档属性
| 名称 | 第1章 第3节 1 认识同周期元素性质的递变规律 |  | |
| 格式 | zip | ||
| 文件大小 | 211.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 21:34:56 | ||
图片预览






文档简介
(共19张PPT)
第 3 节 元素周期表的应用
元素周期律的发现和元素周期表的诞生,开创了化学科学
的新纪元。从此,人们对千变万化的物质世界的认识再也不是
支离破碎的了。那么,元素周期表中的元素种类是否有限呢?
学习元素周期律和元素周期表对我们学习化学有什么作用呢?
元素周期表还有哪些应用呢?
1
认识同周期元素性质的递变规律
1.Na、Mg、Al 原子半径由大到小的顺序为____________,
失电子能力由强到弱的顺序为____________。
Na>Mg>Al
根据所学知识,你能解释 Na、Mg、Al 失电子能力由强到
弱的原因吗?
答案:Na、Mg、Al 电子层数相同,原子序数依次增大,
核电荷数依次增大,原子半径依次减小,导致原子核对核外电
子吸引能力依次增强,因此失电子能力减弱。
Na>Mg>Al
2.Si、P、S、Cl原子半径逐渐_____,得电子能力逐渐_____,
与氢气化合越来越_____,最高价氧化物对应的水化物的酸性逐
渐_____。
减小
增强
容易
增强
根据所学知识解释 Si、P、S、Cl 得电子能力逐渐增强的原
因是什么?
答案:Si、P、S、Cl 电子层数相同,原子序数依次增大,
核电荷数依次增大,原子半径依次减小,导致原子核对核外电
子吸引能力依次增强,因此得电子能力逐渐增强。
3.在同一周期中,各元素原子的核外电子层数相同,但从
左到右核电荷数依次增多,原子半径逐渐_____,原子失电子能
力逐渐_____、得电子能力逐渐_____。因此,元素周期表清楚
地体现了元素的性质随着原子序数的递增呈现周期性的变化。
减小
减弱
增强
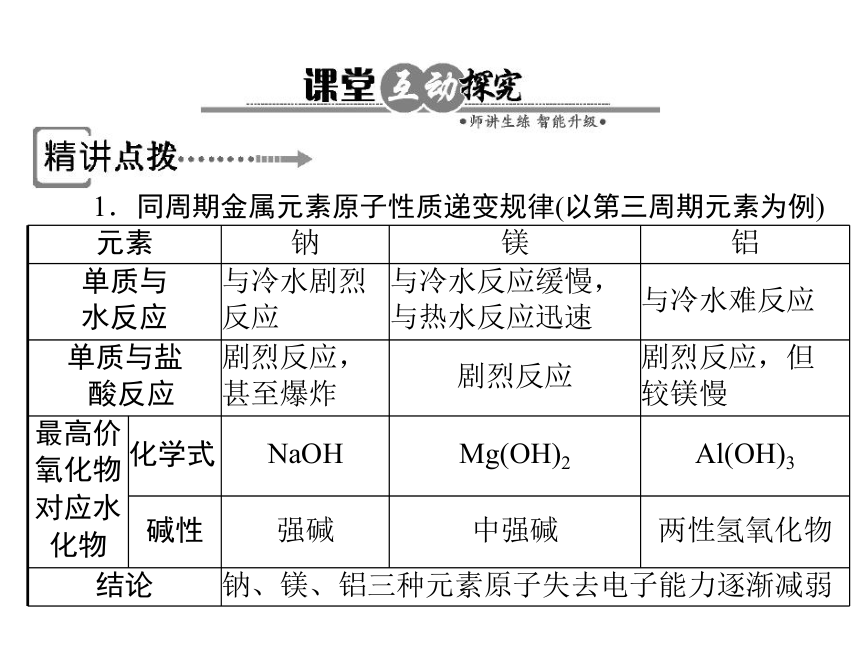
元素 钠 镁 铝
单质与
水反应 与冷水剧烈
反应 与冷水反应缓慢,
与热水反应迅速 与冷水难反应
单质与盐
酸反应 剧烈反应,
甚至爆炸 剧烈反应 剧烈反应,但
较镁慢
最高价
氧化物
对应水
化物 化学式 NaOH Mg(OH)2 Al(OH)3
碱性 强碱 中强碱 两性氢氧化物
结论 钠、镁、铝三种元素原子失去电子能力逐渐减弱
1.同周期金属元素原子性质递变规律(以第三周期元素为例)
元素 硅 磷 硫 氯
与 H2 反应难易 高温 蒸气 加热 光照
气态氢
化物 化学式 SiH4 PH3 H2S HCl
稳定性 极不稳定 不稳定 300 ℃分解 稳定
最高价
含氧酸 化学式 H4SiO4 H3PO4 H2SO4 HClO4
酸性 弱酸 中强酸 强酸 比硫酸强
结论 Si、P、S、Cl 四种元素原子的得电子能力从
左到右依次增强
2.同周期非金属元素原子性质递变规律(以第三周期元素为
例)
3.比较元素原子失电子能力强弱的方法
(1)依据金属单质与水(或酸)反应置换出 H2 的难易程度,越
容易置换出 H2,元素原子失电子能力越强;(2)根据最高价氧化
物对应的水化物的碱性,碱性越强,原子失电子能力越强;(3)
根据元素周期表,同周期从左到右,原子失电子逐渐减弱;同
主族从上到下,原子失电子能力逐渐增强;(4)根据与同一氧化
剂发生氧化还原反应的难易,越容易反应的原子失电子能力越
强;(5)根据阳离子(主族元素)的氧化性,氧化性越强原子失电
子能力越弱;(6)根据金属与盐溶液的置换反应,越容易被置换
出的金属元素的原子失电子能力越弱。
4.比较元素原子得电子能力强弱的方法
(1)单质与氢气越容易化合或者生成的气态氢化物越稳定,
元素的原子越容易得电子;(2)气态氢化物(或者阴离子)的还原
性越强,相应元素的原子得电子能力越弱;(3)非金属单质在水
溶液中进行置换反应,且反应物中的非金属单质作氧化剂,被
置换出的单质对应元素的原子的得电子能力弱;(4)与同一金属
反应,若反应越难发生,则非金属元素原子得电子能力越弱;(5)
最高价氧化物对应的水化物的酸性越强,元素原子得电子能力
越强;(6)在元素周期表同一周期中,自左到右,元素原子得电
子能力增强;同一主族中,自上而下,元素原子得电子能力减
弱。
例 1.下列叙述不正确的是(
)。
D
A.Na、Mg、Al 最外层电子数依次增多
B.Na、Mg、Al 失电子能力依次减弱
C.Na、Mg、Al 对应的氢氧化物的碱性依次减弱
D.Na 可以从 AlCl3 溶液中置换出金属 Al
解析:根据同周期元素的原子性质递变规律可知A、B、C
正确;Na 还原性比Al 强,但由于与水剧烈反应,故不能从AlCl3
溶液中置换出金属Al。
例 2.同周期的 X、Y、Z 三种元素的最高价氧化物对应水化
物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判
断正确的是(
)。
C
①阴离子的还原性按 X、Y、Z 顺序减弱
②单质的氧化性
按 X、Y、Z 顺序增强
③元素的原子半径按 X、Y、Z 顺序减
小
④气态氢化物的稳定性按 X、Y、Z 顺序减弱
A.①②
B.②③
C.①②③
D.①②③④
解析:根据同周期非金属元素原子性质递变规律可知:原
子的得电子能力 X<Y<Z,三种元素在周期表中的排列顺序为
X、Y、Z,结合元素周期律知识可知原子半径 X>Y>Z,则
①②③正确;气态氢化物的稳定性顺序应按 X、Y、Z 顺序增强。
例 3.下列叙述中,能肯定 A 金属比 B 金属活泼性强的是
(
)。
A.A 原子的最外层电子数比 B 原子的最外层电子数少
B.A 原子的电子层数比 B 原子的电子层数多
C.1 mol A 从酸中置换出的 H2 比 1 mol B 从酸中置换出的
氢气多
D.常温时,A 能从水中置换出氢气而 B 不能
解析:A 中,只指出 A、B 两种元素原子的最外层电子数
的多少,而不能确定A、B 的金属性强弱,如Be 比Al 的最外
层电子数少,但Al 更活泼些;B 中,电子层数的多少也不能作
为判断金属活泼的依据,如钠比铜的电子层数少,但更活泼些;
C 中,应根据置换出 H2 的难易而不是置换出的H2 的多少;D
中,只有很活泼的金属在常温下与冷水反应,而较活泼的金属
在常温下不与冷水发生反应。
答案:D
B
例4.(2011广东揭阳检测)已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )。
A.质子数:c>b
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X 解析:四种离子都具有相同的电子层结构,即核外电子数相同,故有a-3=b-1=c+2=d+1,得质子数:b>c;具有相同电子层结构,W与X处于同一周期,X在W的前面,Y与Z处于同一周期,Y在Z的前面,故有离子的还原性:Y2->Z-,氢化物的稳定性:H2Y<HZ,原子半径:X>W。
1.下列各元素的最高价氧化物对应水化物的酸性最弱的是
(
A
)。
A.Si
C.S
B.P
D.Cl
解析:电子层数相同的元素,随着原子序数的递增,非金
属性逐渐增强,最高价氧化物对应的水化物的酸性逐渐增强。
因为原子序数Cl>S>P>Si,所以最高价氧化物对应水化物的
酸性HClO4>H2SO4>H3PO4>H2SiO3。
2.(2011 广东学业水平)下列判断正确的是(
)。
B
A.核电荷数:AlC.原子序数:Na>Cl
B.金属性:Na>Al
D.原子半径:Cl>Na
3 在第 3 周期元素及其单质和化合物中,原子半径最小的
元素是____;氧化性最强的单质是____;还原性最强的单质是
_____;最高价氧化物对应水化物中,酸性最强的是_______;
最高价氧化物对应水化物中,碱性最强的是_______;形成的两
性氢氧化物是__________。
Al(OH)3
解析:根据同周期元素的结构和性质的递变规律来分析。
Cl
Cl2
Na
HClO4
NaOH
4.提供下列试剂与仪器,设计一个简单实验证明钠、镁、
铝三种金属得失电子能力的大小。
提供的试剂:钠粒、镁带、铝片、蒸馏水、稀盐酸、酚酞
试液、石蕊试剂、NaOH 溶液
提供的仪器:试管、小烧杯、镊子、滤纸、酒精灯、试管
夹、小刀、砂布
(1)实验中必须用到的仪器有:________________________
__________________,试剂有:____________________________
______________________。
试管、酒精灯、试管夹、镊子、
滤纸、小刀、砂布
钠粒、镁带、铝片、蒸馏水、
稀盐酸、酚酞试液
(2)简单的实验步骤:________________________________
①切一小块钠,用滤纸吸干表面上的
煤油,放入试管中。向试管中加入 3 mL 蒸馏水,并滴 2 滴酚酞
试液,观察现象。②取两小段镁带,用砂布擦去表面的氧化膜,
放入试管中。向试管中加入 3 mL 水,并往水中滴 2 滴酚酞试液,
观察现象。然后,加热试管至沸腾,观察现象。③取一小片铝
和一小段镁带,用砂布擦去表面的氧化膜,分别放入两支试管,
再加入 2 mL 1 mol·L-1 盐酸,观察发生的现象
(3)结论:_________________________________________。
。
金属失电子的能力由大到小的顺序:钠>镁>铝
第 3 节 元素周期表的应用
元素周期律的发现和元素周期表的诞生,开创了化学科学
的新纪元。从此,人们对千变万化的物质世界的认识再也不是
支离破碎的了。那么,元素周期表中的元素种类是否有限呢?
学习元素周期律和元素周期表对我们学习化学有什么作用呢?
元素周期表还有哪些应用呢?
1
认识同周期元素性质的递变规律
1.Na、Mg、Al 原子半径由大到小的顺序为____________,
失电子能力由强到弱的顺序为____________。
Na>Mg>Al
根据所学知识,你能解释 Na、Mg、Al 失电子能力由强到
弱的原因吗?
答案:Na、Mg、Al 电子层数相同,原子序数依次增大,
核电荷数依次增大,原子半径依次减小,导致原子核对核外电
子吸引能力依次增强,因此失电子能力减弱。
Na>Mg>Al
2.Si、P、S、Cl原子半径逐渐_____,得电子能力逐渐_____,
与氢气化合越来越_____,最高价氧化物对应的水化物的酸性逐
渐_____。
减小
增强
容易
增强
根据所学知识解释 Si、P、S、Cl 得电子能力逐渐增强的原
因是什么?
答案:Si、P、S、Cl 电子层数相同,原子序数依次增大,
核电荷数依次增大,原子半径依次减小,导致原子核对核外电
子吸引能力依次增强,因此得电子能力逐渐增强。
3.在同一周期中,各元素原子的核外电子层数相同,但从
左到右核电荷数依次增多,原子半径逐渐_____,原子失电子能
力逐渐_____、得电子能力逐渐_____。因此,元素周期表清楚
地体现了元素的性质随着原子序数的递增呈现周期性的变化。
减小
减弱
增强
元素 钠 镁 铝
单质与
水反应 与冷水剧烈
反应 与冷水反应缓慢,
与热水反应迅速 与冷水难反应
单质与盐
酸反应 剧烈反应,
甚至爆炸 剧烈反应 剧烈反应,但
较镁慢
最高价
氧化物
对应水
化物 化学式 NaOH Mg(OH)2 Al(OH)3
碱性 强碱 中强碱 两性氢氧化物
结论 钠、镁、铝三种元素原子失去电子能力逐渐减弱
1.同周期金属元素原子性质递变规律(以第三周期元素为例)
元素 硅 磷 硫 氯
与 H2 反应难易 高温 蒸气 加热 光照
气态氢
化物 化学式 SiH4 PH3 H2S HCl
稳定性 极不稳定 不稳定 300 ℃分解 稳定
最高价
含氧酸 化学式 H4SiO4 H3PO4 H2SO4 HClO4
酸性 弱酸 中强酸 强酸 比硫酸强
结论 Si、P、S、Cl 四种元素原子的得电子能力从
左到右依次增强
2.同周期非金属元素原子性质递变规律(以第三周期元素为
例)
3.比较元素原子失电子能力强弱的方法
(1)依据金属单质与水(或酸)反应置换出 H2 的难易程度,越
容易置换出 H2,元素原子失电子能力越强;(2)根据最高价氧化
物对应的水化物的碱性,碱性越强,原子失电子能力越强;(3)
根据元素周期表,同周期从左到右,原子失电子逐渐减弱;同
主族从上到下,原子失电子能力逐渐增强;(4)根据与同一氧化
剂发生氧化还原反应的难易,越容易反应的原子失电子能力越
强;(5)根据阳离子(主族元素)的氧化性,氧化性越强原子失电
子能力越弱;(6)根据金属与盐溶液的置换反应,越容易被置换
出的金属元素的原子失电子能力越弱。
4.比较元素原子得电子能力强弱的方法
(1)单质与氢气越容易化合或者生成的气态氢化物越稳定,
元素的原子越容易得电子;(2)气态氢化物(或者阴离子)的还原
性越强,相应元素的原子得电子能力越弱;(3)非金属单质在水
溶液中进行置换反应,且反应物中的非金属单质作氧化剂,被
置换出的单质对应元素的原子的得电子能力弱;(4)与同一金属
反应,若反应越难发生,则非金属元素原子得电子能力越弱;(5)
最高价氧化物对应的水化物的酸性越强,元素原子得电子能力
越强;(6)在元素周期表同一周期中,自左到右,元素原子得电
子能力增强;同一主族中,自上而下,元素原子得电子能力减
弱。
例 1.下列叙述不正确的是(
)。
D
A.Na、Mg、Al 最外层电子数依次增多
B.Na、Mg、Al 失电子能力依次减弱
C.Na、Mg、Al 对应的氢氧化物的碱性依次减弱
D.Na 可以从 AlCl3 溶液中置换出金属 Al
解析:根据同周期元素的原子性质递变规律可知A、B、C
正确;Na 还原性比Al 强,但由于与水剧烈反应,故不能从AlCl3
溶液中置换出金属Al。
例 2.同周期的 X、Y、Z 三种元素的最高价氧化物对应水化
物的酸性由强到弱的顺序是:HZO4>H2YO4>H3XO4,下列判
断正确的是(
)。
C
①阴离子的还原性按 X、Y、Z 顺序减弱
②单质的氧化性
按 X、Y、Z 顺序增强
③元素的原子半径按 X、Y、Z 顺序减
小
④气态氢化物的稳定性按 X、Y、Z 顺序减弱
A.①②
B.②③
C.①②③
D.①②③④
解析:根据同周期非金属元素原子性质递变规律可知:原
子的得电子能力 X<Y<Z,三种元素在周期表中的排列顺序为
X、Y、Z,结合元素周期律知识可知原子半径 X>Y>Z,则
①②③正确;气态氢化物的稳定性顺序应按 X、Y、Z 顺序增强。
例 3.下列叙述中,能肯定 A 金属比 B 金属活泼性强的是
(
)。
A.A 原子的最外层电子数比 B 原子的最外层电子数少
B.A 原子的电子层数比 B 原子的电子层数多
C.1 mol A 从酸中置换出的 H2 比 1 mol B 从酸中置换出的
氢气多
D.常温时,A 能从水中置换出氢气而 B 不能
解析:A 中,只指出 A、B 两种元素原子的最外层电子数
的多少,而不能确定A、B 的金属性强弱,如Be 比Al 的最外
层电子数少,但Al 更活泼些;B 中,电子层数的多少也不能作
为判断金属活泼的依据,如钠比铜的电子层数少,但更活泼些;
C 中,应根据置换出 H2 的难易而不是置换出的H2 的多少;D
中,只有很活泼的金属在常温下与冷水反应,而较活泼的金属
在常温下不与冷水发生反应。
答案:D
B
例4.(2011广东揭阳检测)已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )。
A.质子数:c>b
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X
1.下列各元素的最高价氧化物对应水化物的酸性最弱的是
(
A
)。
A.Si
C.S
B.P
D.Cl
解析:电子层数相同的元素,随着原子序数的递增,非金
属性逐渐增强,最高价氧化物对应的水化物的酸性逐渐增强。
因为原子序数Cl>S>P>Si,所以最高价氧化物对应水化物的
酸性HClO4>H2SO4>H3PO4>H2SiO3。
2.(2011 广东学业水平)下列判断正确的是(
)。
B
A.核电荷数:Al
B.金属性:Na>Al
D.原子半径:Cl>Na
3 在第 3 周期元素及其单质和化合物中,原子半径最小的
元素是____;氧化性最强的单质是____;还原性最强的单质是
_____;最高价氧化物对应水化物中,酸性最强的是_______;
最高价氧化物对应水化物中,碱性最强的是_______;形成的两
性氢氧化物是__________。
Al(OH)3
解析:根据同周期元素的结构和性质的递变规律来分析。
Cl
Cl2
Na
HClO4
NaOH
4.提供下列试剂与仪器,设计一个简单实验证明钠、镁、
铝三种金属得失电子能力的大小。
提供的试剂:钠粒、镁带、铝片、蒸馏水、稀盐酸、酚酞
试液、石蕊试剂、NaOH 溶液
提供的仪器:试管、小烧杯、镊子、滤纸、酒精灯、试管
夹、小刀、砂布
(1)实验中必须用到的仪器有:________________________
__________________,试剂有:____________________________
______________________。
试管、酒精灯、试管夹、镊子、
滤纸、小刀、砂布
钠粒、镁带、铝片、蒸馏水、
稀盐酸、酚酞试液
(2)简单的实验步骤:________________________________
①切一小块钠,用滤纸吸干表面上的
煤油,放入试管中。向试管中加入 3 mL 蒸馏水,并滴 2 滴酚酞
试液,观察现象。②取两小段镁带,用砂布擦去表面的氧化膜,
放入试管中。向试管中加入 3 mL 水,并往水中滴 2 滴酚酞试液,
观察现象。然后,加热试管至沸腾,观察现象。③取一小片铝
和一小段镁带,用砂布擦去表面的氧化膜,分别放入两支试管,
再加入 2 mL 1 mol·L-1 盐酸,观察发生的现象
(3)结论:_________________________________________。
。
金属失电子的能力由大到小的顺序:钠>镁>铝
