第1章 第3节 2 预测同主族元素的性质
文档属性
| 名称 | 第1章 第3节 2 预测同主族元素的性质 |  | |
| 格式 | zip | ||
| 文件大小 | 326.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 21:35:50 | ||
图片预览







文档简介
(共22张PPT)
2
预测同主族元素的性质
ⅦA 族单质 F2 Cl2 Br2 I2
反应条件 暗处
反应程度 爆炸
氢化物的
稳定性 很稳定
1.根据卤素性质完成表格
光照或点燃
加热
不断加热
剧烈
缓慢
缓慢
稳定
较稳定
不稳定,
同时分解
根据所填表格内容,你能得出什么结论?
答案:同主族非金属元素原子(ⅦA 族 F、Cl、Br、I),从
上到下得电子能力逐渐减弱;同主族元素原子的最外层电子数
相同,因而化学性质具有相似性;同主族元素原子从上到下,
原子半径增大,得电子能力减弱,对应氢化物的稳定性逐渐减
弱。
碱金属元素符号 Li
原子结构 相同点 最外层电子数都为_____
不同点 电子层数依次________
化
学
性
质 相同点 都是活泼金属,失电子能力强,都与 O2、H2O 等剧
烈反应
不
同
点 与 O2 反应 加热燃烧
生成 Li2O 常温即反应,
加热燃烧生
成_______ 常温反应,加热
生成更复杂氧
化物 遇空气
立即燃
烧
与 H2O 反应 反应产生
H2 剧烈反应生
成 H2 剧烈反应,轻微
爆炸,产生 H2 立即爆
炸
失电子能力 失电子能力______________
最高价氧化
物对应水化
物的碱性 LiOH、NaOH、KOH、RbOH、CsOH 都为强碱,
并且碱性_____________
2.根据碱金属元素性质完成表格
Na
K
Rb
Cs
1
增多
越来越强
Na2O2
越来越强
根据所填内容,你得出什么结论?
答案:同主族金属元素,最外层电子数相同,化学性质相
似,但由于电子层数依次增多,原子半径依次增大,从上到下
失电子能力增强,最高价氧化物对应的水化物的碱性增强。
有关实验时要小心。
相似
半导体
催化剂
3.元素周期表中位置相近的元素性质______,据此可以利
用元素周期表寻找新材料,如在金属和非金属的交界处寻找
________材料,在过渡元素中寻找优良的_______。
碱金属元素都容易与氧气和水反应,取用药品要规范,做
项目 同主族(从上到下)
最外层电子数 相同
主要化合价 通常最高正价相同
核电荷数 依次增大
原子半径 依次增大
元素的原子得失电
子能力 失电子能力逐渐增强,得电子能力逐渐减弱
最高价氧化物对应
的水化物的酸碱性 酸性逐渐减弱,碱性逐渐增强
气态氢化物 越来越难与 H2 化合,稳定性减弱,还原性增强
1.同主族性质递变规律(从上到下)
2.元素周期表的应用
(1)合成特定性质的物质,指导科学研究和生产实践,如发
现新元素、寻找新材料、催化剂等;
(2)学习和研究化学的重要工具,如确定元素在周期表中的
位置、预测新元素的性质等;
(3)探矿方面有重要应用;
(4)论证了“量变质变规律”。
3.“位、构、性”之间的关系
4.“位、构、性”之特殊性总结
在“位、构、性”的规律中一些例外应引起足够的重视,
这对解题起到重要作用。
(1)元素周期表中一般每一周期都是从金属元素开始,但第
一周期从非金属元素 H 开始;
(2)密度最小的气体是 H2,原子核中只有质子没有中子的原
子是 H 原子;
(3)F、O 一般无正价;
(4)族序数是周期数 3 倍的元素是 O;
(5)周期数是族序数 2 倍的元素是 Li、Ca,周期数是族序数
3 倍的元素为 Na;
(6)最外层电子数是次外层电子数 3 倍的元素是 O,最外层
电子数是次外层电子数 2 倍的元素是 C,最外层电子数等于次
外层电子数的元素是 Be、Ar;
(7)常温下单质呈液态的非金属元素是 Br,金属元素是 Hg;
(8)最高价氧化物对应的水化物酸性最强的非金属元素 是
Cl;
(9)地壳中含量最大的元素是 O,其次为 Si,地壳中含量最
多的金属元素是 Al,其次为 Fe;
(10)形成化合物种类最多的元素是 C;
(11)气态氢化物与其最高价氧化物对应的水化物能起化合
反应的是 N。
例 1.(2011 广东广州检测)下列关于 F、Cl、Br、I 的比较,
说法正确的是(
)。
B
A.原子最外层的电子数随核电荷数的增加而增多
B.单质颜色随核电荷数的增加而加深
C.氢化物的稳定性随核电荷数的增加而增强
D.非金属性随核电荷数的增加而增强
解析:卤族元素最外层电子数都为 7,在化学反应中容易
得到电子,且从 F 到 I,元素的非金属性减弱,与氢气化合越困
难,对应氢化物的稳定性越差,对应单质的氧化性减弱,常温
下状态由气体到液体再到固体,颜色由浅黄绿色到红棕色再到
紫黑色,对应离子的还原性增强。
例 2. Ra(镭)是原子序数最大的第ⅡA 族元素,下列说法不
正确的是(
)。
D
A.原子半径是第ⅡA 族中最大的
B.遇冷水能剧烈反应
C.位于第 7 周期
D.Ra(OH)2 是两性氢氧化物
解析:Ra(镭)是原子序数最大的第ⅡA 族元素,则Ra 在第
7 周期。根据同主族元素性质递变规律可知,在第ⅡA 族中Ra
原子半径最大,Ra 性质活泼,与水可发生剧烈反应,生成的
Ra(OH)2 是强碱。
例 3.根据元素所在元素周期表中的位置,判断下列元素都
)。
C
能作为半导体材料的是(
A.Si、K
C.Si、Ge
B.C、Al
D.As、Se
解析:非金属区域中 F、Cl、P、S 常用来制造农药;过渡
金属制造催化剂,耐高温、耐腐蚀材料等;金属与非金属的分
界线附近能找到半导体材料。
例 4.某主族元素 R 的最高正化合价与最低负化合价的代数
和为 4,由此可以判断(
)。
D
A.R 一定是第四周期元素
B.R 一定是第ⅣA 族元素
C.R 的气态氢化物比同周期其他元素气态氢化物稳定
D.R 气态氢化物化学式为 H2R
解析:根据题意设元素R 的最外层电子数为 x,故其最高
正价为+x,最低负化合价为-(8-x),由+x-(8-x)=4,得x
=6,即元素R 的最外层电子数为6。R 一定是第ⅥA 族元素,
其气态氢化物化学式为 H2R。
1.下列元素都具有相同的最外层电子数,则它们形成的单
质中,最容易跟氢气反应生成气态氢化物的是(
)。
A
A.F
B.Cl
C.Br
D.I
解析:具有相同的最外层电子数的元素,随着原子序数的
递增,非金属性逐渐减弱,单质和氢气化合的条件越来越高,
越来越不易生成气态氢化物。
2.(2011 广东潮州检测)下列各组元素性质的递变情况中,错
误的是(
)。
C
A.Li、Be、B 原子的最高正价依次增大
B.P、S、Cl 元素的最高价氧化物对应水化物的酸性依次
增强
C.B、C、N、O、F 的原子半径依次增大
D.Li、Na、K、Rb 元素的金属性依次增强
3.某元素最高价氧化物对应水化物的化学式是 H2XO3,这
种元素的气态氢化物的分子式为(
)。
D
A.HX
B.H2X
C.XH3
D.XH4
4.下表是周期表中的一部分,根据 A~I 在周期表中的位置,
用元素符号或化学式回答下列问题。
(1)表中元素,化学性质最不活泼的是____,只有负价而无
正价的是____,可用于制半导体材料的元素是____。
(2)最高价氧化物的水化物碱性最强的是______,酸性最强
的是_______,呈两性的是________。
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的
是_____。
(4)在 B、C、D、J、E、F、G、H 中,原子半径最大的是
____。
解析:从表中可推出各种元素 A~J 分别为:H、Na、Al、
C、N、P、F、Cl、Ar、Si。化学性质最不活泼的元素是稀有气
体 Ar,只有负价而无正价的元素是F,可用于制半导体材料的元
素介于金属与非金属的分界线上,应为 Si;失电子能力越强,最
高价氧化物的水化物碱性也越强,应为NaOH;得电子能力越强,
最高价氧化物的水化物酸性也越强,应为HClO4;A 与D、E、F、
G、H 形成的化合物分别为:CH4、NH3、PH3、HF、HCl,由于
F 的得电子能力最强,故 HF 最稳定;根据电子层数越多且原子
序数越靠前的原子半径越大,故原子半径最大的是 Na。
答案:(1)Ar F
Si (2)NaOH
HClO4
Al(OH)3
(3)HF
(4)Na
内容特点
本节内容主要包括两部分:认识同周期元素性质的递变规
律、预测同主族元素的性质。在学过原子结构、元素周期律和
元素周期表之后,结合《化学 1(必修)》中学习的有关元素化合
物的知识,通过探究第 3 周期元素原子得失电子能力的强弱,
整合ⅦA 族元素及其化合物的性质,以及预测金属钾的性质等
一系列活动,归纳得出同周期、同主族元素性质的递变规律,
体会元素在周期表中的位置、元素的原子结构、元素性质即
“位、构、性”三者间的关系,学会运用元素周期律和元素周
期表来指导化学学习、科学研究和生产实践。
本节知识框架为:
教学指要
学习本节内容,可让学生复习第 3 周期和ⅦA 族的元素化
合物知识,复习元素周期律和元素周期表知识。本节内容根据
知识的内在联系可划分为两部分:同周期元素性质的递变规律;
预测同主族元素的性质。具体教学建议如下:
1.同周期元素性质的递变规律,本课时的重难点是探究第
3 周期元素原子得失电子的能力的递变规律,从而得出同周期
元素性质的递变规律。处理本模块时,要充分利用教材的“实
验探究”和“阅读探究”,设计实验,通过实验结论归纳出同
周期元素性质的递变规律。可将第 3 周期元素分为金属元素和
非金属元素来分别讨论,以分散难点。实验时要注意选择对比
性强、现象明显的实验,充分利用“方法导引”所提供的方法,
使实验更具有说服力。
2.预测同主族元素的性质,本课时的重难点是学习同主族
元素性质的递变规律。可以先引导学生分析同主族元素的原子
结构特点,后根据所学知识预测同主族元素性质递变的可能性,
最后结合ⅦA 族元素及其化合物的性质来验证,并进一步完善、
整合ⅦA 族元素及其化合物的知识。通过“观察·思考”来加深
对同主族元素性质的递变规律的认识,并整合ⅠA 族元素化合
物知识,要特别注意金属钾性质活泼,注意实验安全。
2
预测同主族元素的性质
ⅦA 族单质 F2 Cl2 Br2 I2
反应条件 暗处
反应程度 爆炸
氢化物的
稳定性 很稳定
1.根据卤素性质完成表格
光照或点燃
加热
不断加热
剧烈
缓慢
缓慢
稳定
较稳定
不稳定,
同时分解
根据所填表格内容,你能得出什么结论?
答案:同主族非金属元素原子(ⅦA 族 F、Cl、Br、I),从
上到下得电子能力逐渐减弱;同主族元素原子的最外层电子数
相同,因而化学性质具有相似性;同主族元素原子从上到下,
原子半径增大,得电子能力减弱,对应氢化物的稳定性逐渐减
弱。
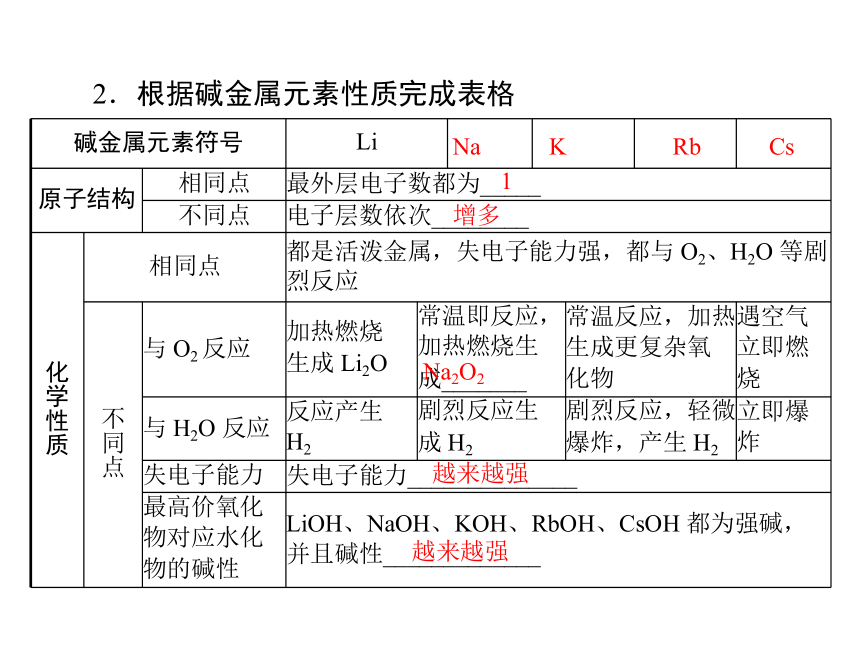
碱金属元素符号 Li
原子结构 相同点 最外层电子数都为_____
不同点 电子层数依次________
化
学
性
质 相同点 都是活泼金属,失电子能力强,都与 O2、H2O 等剧
烈反应
不
同
点 与 O2 反应 加热燃烧
生成 Li2O 常温即反应,
加热燃烧生
成_______ 常温反应,加热
生成更复杂氧
化物 遇空气
立即燃
烧
与 H2O 反应 反应产生
H2 剧烈反应生
成 H2 剧烈反应,轻微
爆炸,产生 H2 立即爆
炸
失电子能力 失电子能力______________
最高价氧化
物对应水化
物的碱性 LiOH、NaOH、KOH、RbOH、CsOH 都为强碱,
并且碱性_____________
2.根据碱金属元素性质完成表格
Na
K
Rb
Cs
1
增多
越来越强
Na2O2
越来越强
根据所填内容,你得出什么结论?
答案:同主族金属元素,最外层电子数相同,化学性质相
似,但由于电子层数依次增多,原子半径依次增大,从上到下
失电子能力增强,最高价氧化物对应的水化物的碱性增强。
有关实验时要小心。
相似
半导体
催化剂
3.元素周期表中位置相近的元素性质______,据此可以利
用元素周期表寻找新材料,如在金属和非金属的交界处寻找
________材料,在过渡元素中寻找优良的_______。
碱金属元素都容易与氧气和水反应,取用药品要规范,做
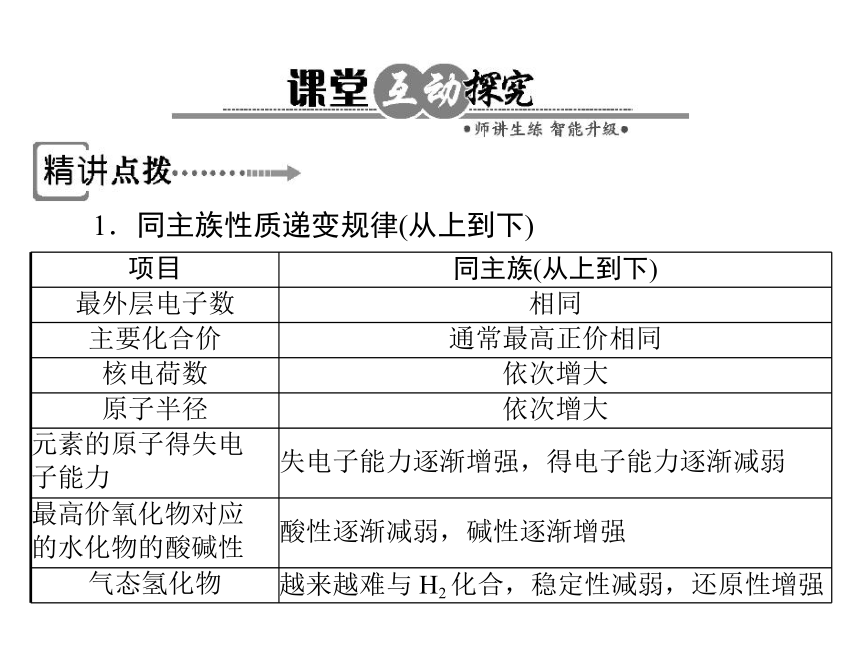
项目 同主族(从上到下)
最外层电子数 相同
主要化合价 通常最高正价相同
核电荷数 依次增大
原子半径 依次增大
元素的原子得失电
子能力 失电子能力逐渐增强,得电子能力逐渐减弱
最高价氧化物对应
的水化物的酸碱性 酸性逐渐减弱,碱性逐渐增强
气态氢化物 越来越难与 H2 化合,稳定性减弱,还原性增强
1.同主族性质递变规律(从上到下)
2.元素周期表的应用
(1)合成特定性质的物质,指导科学研究和生产实践,如发
现新元素、寻找新材料、催化剂等;
(2)学习和研究化学的重要工具,如确定元素在周期表中的
位置、预测新元素的性质等;
(3)探矿方面有重要应用;
(4)论证了“量变质变规律”。
3.“位、构、性”之间的关系
4.“位、构、性”之特殊性总结
在“位、构、性”的规律中一些例外应引起足够的重视,
这对解题起到重要作用。
(1)元素周期表中一般每一周期都是从金属元素开始,但第
一周期从非金属元素 H 开始;
(2)密度最小的气体是 H2,原子核中只有质子没有中子的原
子是 H 原子;
(3)F、O 一般无正价;
(4)族序数是周期数 3 倍的元素是 O;
(5)周期数是族序数 2 倍的元素是 Li、Ca,周期数是族序数
3 倍的元素为 Na;
(6)最外层电子数是次外层电子数 3 倍的元素是 O,最外层
电子数是次外层电子数 2 倍的元素是 C,最外层电子数等于次
外层电子数的元素是 Be、Ar;
(7)常温下单质呈液态的非金属元素是 Br,金属元素是 Hg;
(8)最高价氧化物对应的水化物酸性最强的非金属元素 是
Cl;
(9)地壳中含量最大的元素是 O,其次为 Si,地壳中含量最
多的金属元素是 Al,其次为 Fe;
(10)形成化合物种类最多的元素是 C;
(11)气态氢化物与其最高价氧化物对应的水化物能起化合
反应的是 N。
例 1.(2011 广东广州检测)下列关于 F、Cl、Br、I 的比较,
说法正确的是(
)。
B
A.原子最外层的电子数随核电荷数的增加而增多
B.单质颜色随核电荷数的增加而加深
C.氢化物的稳定性随核电荷数的增加而增强
D.非金属性随核电荷数的增加而增强
解析:卤族元素最外层电子数都为 7,在化学反应中容易
得到电子,且从 F 到 I,元素的非金属性减弱,与氢气化合越困
难,对应氢化物的稳定性越差,对应单质的氧化性减弱,常温
下状态由气体到液体再到固体,颜色由浅黄绿色到红棕色再到
紫黑色,对应离子的还原性增强。
例 2. Ra(镭)是原子序数最大的第ⅡA 族元素,下列说法不
正确的是(
)。
D
A.原子半径是第ⅡA 族中最大的
B.遇冷水能剧烈反应
C.位于第 7 周期
D.Ra(OH)2 是两性氢氧化物
解析:Ra(镭)是原子序数最大的第ⅡA 族元素,则Ra 在第
7 周期。根据同主族元素性质递变规律可知,在第ⅡA 族中Ra
原子半径最大,Ra 性质活泼,与水可发生剧烈反应,生成的
Ra(OH)2 是强碱。
例 3.根据元素所在元素周期表中的位置,判断下列元素都
)。
C
能作为半导体材料的是(
A.Si、K
C.Si、Ge
B.C、Al
D.As、Se
解析:非金属区域中 F、Cl、P、S 常用来制造农药;过渡
金属制造催化剂,耐高温、耐腐蚀材料等;金属与非金属的分
界线附近能找到半导体材料。
例 4.某主族元素 R 的最高正化合价与最低负化合价的代数
和为 4,由此可以判断(
)。
D
A.R 一定是第四周期元素
B.R 一定是第ⅣA 族元素
C.R 的气态氢化物比同周期其他元素气态氢化物稳定
D.R 气态氢化物化学式为 H2R
解析:根据题意设元素R 的最外层电子数为 x,故其最高
正价为+x,最低负化合价为-(8-x),由+x-(8-x)=4,得x
=6,即元素R 的最外层电子数为6。R 一定是第ⅥA 族元素,
其气态氢化物化学式为 H2R。
1.下列元素都具有相同的最外层电子数,则它们形成的单
质中,最容易跟氢气反应生成气态氢化物的是(
)。
A
A.F
B.Cl
C.Br
D.I
解析:具有相同的最外层电子数的元素,随着原子序数的
递增,非金属性逐渐减弱,单质和氢气化合的条件越来越高,
越来越不易生成气态氢化物。
2.(2011 广东潮州检测)下列各组元素性质的递变情况中,错
误的是(
)。
C
A.Li、Be、B 原子的最高正价依次增大
B.P、S、Cl 元素的最高价氧化物对应水化物的酸性依次
增强
C.B、C、N、O、F 的原子半径依次增大
D.Li、Na、K、Rb 元素的金属性依次增强
3.某元素最高价氧化物对应水化物的化学式是 H2XO3,这
种元素的气态氢化物的分子式为(
)。
D
A.HX
B.H2X
C.XH3
D.XH4
4.下表是周期表中的一部分,根据 A~I 在周期表中的位置,
用元素符号或化学式回答下列问题。
(1)表中元素,化学性质最不活泼的是____,只有负价而无
正价的是____,可用于制半导体材料的元素是____。
(2)最高价氧化物的水化物碱性最强的是______,酸性最强
的是_______,呈两性的是________。
(3)A 分别与 D、E、F、G、H 形成的化合物中,最稳定的
是_____。
(4)在 B、C、D、J、E、F、G、H 中,原子半径最大的是
____。
解析:从表中可推出各种元素 A~J 分别为:H、Na、Al、
C、N、P、F、Cl、Ar、Si。化学性质最不活泼的元素是稀有气
体 Ar,只有负价而无正价的元素是F,可用于制半导体材料的元
素介于金属与非金属的分界线上,应为 Si;失电子能力越强,最
高价氧化物的水化物碱性也越强,应为NaOH;得电子能力越强,
最高价氧化物的水化物酸性也越强,应为HClO4;A 与D、E、F、
G、H 形成的化合物分别为:CH4、NH3、PH3、HF、HCl,由于
F 的得电子能力最强,故 HF 最稳定;根据电子层数越多且原子
序数越靠前的原子半径越大,故原子半径最大的是 Na。
答案:(1)Ar F
Si (2)NaOH
HClO4
Al(OH)3
(3)HF
(4)Na
内容特点
本节内容主要包括两部分:认识同周期元素性质的递变规
律、预测同主族元素的性质。在学过原子结构、元素周期律和
元素周期表之后,结合《化学 1(必修)》中学习的有关元素化合
物的知识,通过探究第 3 周期元素原子得失电子能力的强弱,
整合ⅦA 族元素及其化合物的性质,以及预测金属钾的性质等
一系列活动,归纳得出同周期、同主族元素性质的递变规律,
体会元素在周期表中的位置、元素的原子结构、元素性质即
“位、构、性”三者间的关系,学会运用元素周期律和元素周
期表来指导化学学习、科学研究和生产实践。
本节知识框架为:
教学指要
学习本节内容,可让学生复习第 3 周期和ⅦA 族的元素化
合物知识,复习元素周期律和元素周期表知识。本节内容根据
知识的内在联系可划分为两部分:同周期元素性质的递变规律;
预测同主族元素的性质。具体教学建议如下:
1.同周期元素性质的递变规律,本课时的重难点是探究第
3 周期元素原子得失电子的能力的递变规律,从而得出同周期
元素性质的递变规律。处理本模块时,要充分利用教材的“实
验探究”和“阅读探究”,设计实验,通过实验结论归纳出同
周期元素性质的递变规律。可将第 3 周期元素分为金属元素和
非金属元素来分别讨论,以分散难点。实验时要注意选择对比
性强、现象明显的实验,充分利用“方法导引”所提供的方法,
使实验更具有说服力。
2.预测同主族元素的性质,本课时的重难点是学习同主族
元素性质的递变规律。可以先引导学生分析同主族元素的原子
结构特点,后根据所学知识预测同主族元素性质递变的可能性,
最后结合ⅦA 族元素及其化合物的性质来验证,并进一步完善、
整合ⅦA 族元素及其化合物的知识。通过“观察·思考”来加深
对同主族元素性质的递变规律的认识,并整合ⅠA 族元素化合
物知识,要特别注意金属钾性质活泼,注意实验安全。
