鲁科版必修二第一章 原子结构与元素周期律 本章整合.
文档属性
| 名称 | 鲁科版必修二第一章 原子结构与元素周期律 本章整合. |  | |
| 格式 | zip | ||
| 文件大小 | 327.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 21:36:42 | ||
图片预览





文档简介
(共17张PPT)
一、原子结构
原子组成
原子核
质子:决定元素种类
中子:决定元素的同位素
核外电子:决定元素的性质
三数关系:质量数(A)=质子数(Z)+中子数(N)
质子数=核外电子数=核电荷数=原子序数
阳离子核外电子数=核内质子数-电荷数
阴离子核外电子数=核内质子数+电荷数
二、元素周期表的结构
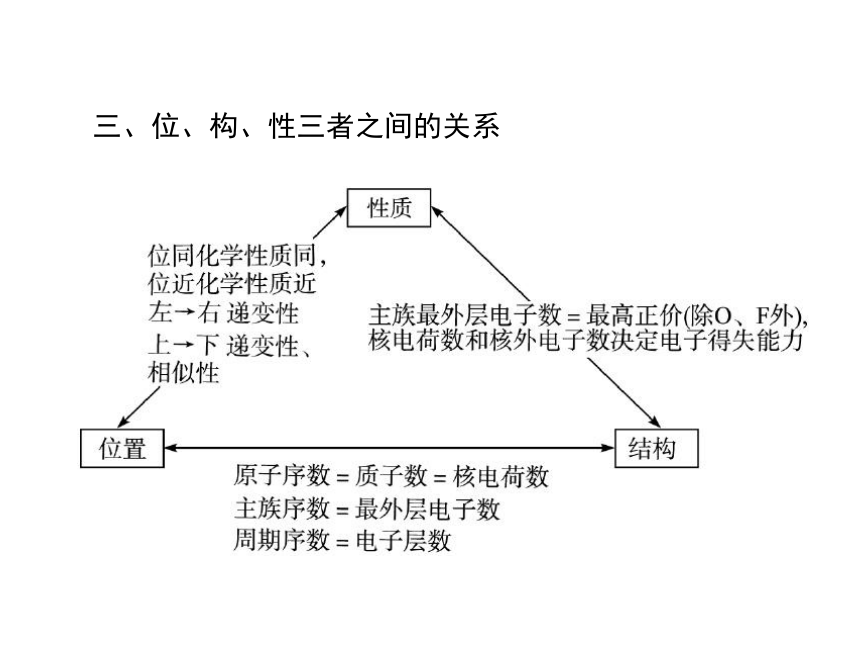
三、位、构、性三者之间的关系
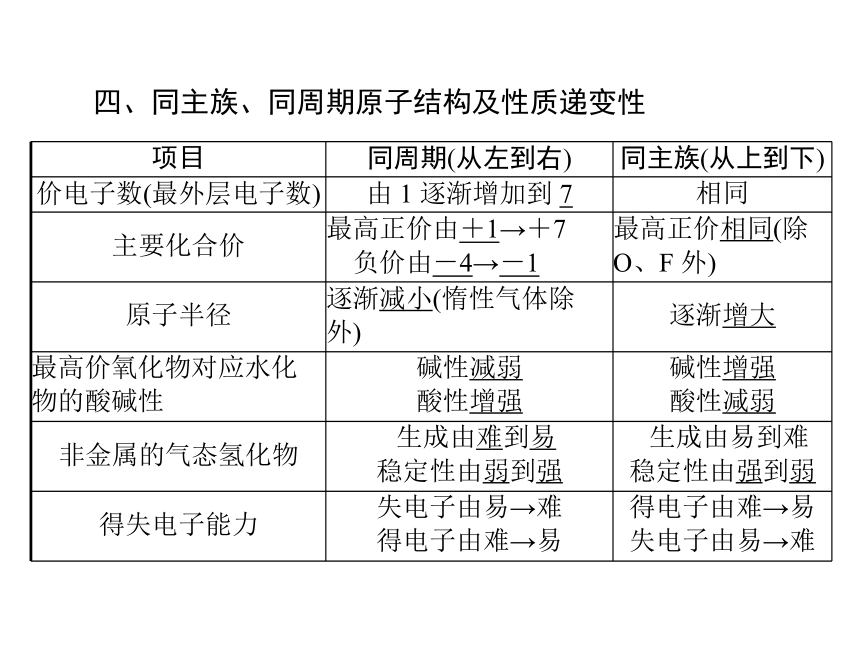
项目 同周期(从左到右) 同主族(从上到下)
价电子数(最外层电子数) 由 1 逐渐增加到 7 相同
主要化合价 最高正价由+1→+7
负价由-4→-1 最高正价相同(除
O、F 外)
原子半径 逐渐减小(惰性气体除
外) 逐渐增大
最高价氧化物对应水化
物的酸碱性 碱性减弱
酸性增强 碱性增强
酸性减弱
非金属的气态氢化物 生成由难到易
稳定性由弱到强 生成由易到难
稳定性由强到弱
得失电子能力 失电子由易→难
得电子由难→易 得电子由难→易
失电子由易→难
四、同主族、同周期原子结构及性质递变性
1.(2011 广东理综,双选,22)短周期元素甲、乙、丙、丁的
原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,
乙位于第 VA 族,甲和丙同主族,丁原子最外层电子数与电子
层数相等,则(
)。
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
解析:本题的突破口在于“甲和乙形成的气态化合物的水
溶液呈碱性”,在中学化学中只有氨气的水溶液才显碱性,由
于短周期元素甲、乙、丙、丁的原子序数依次增大,所以甲是
H,乙是 N;甲和丙同主族,因此丙只能是 Na,这说明丁属于
第三周期,根据丁原子最外层电子数与电子层数相等,所以丁
是 Al。同周期元素从左往右原子半径逐渐减小,金属性逐渐减
弱,所以选项 A 正确,B 不正确,还原性应该是 Na>Al>H;
Na 属于活泼金属,其氧化物 Na2O 属于离子化合物,C 不正确;
乙、丙、丁的最高价氧化物对应的水化物分别为 HNO3(强酸)、
NaOH(强碱)、Al(OH)3(两性氢氧化物),因此选项 D 也是正确的。
答案:AD
2.(2011 天津理综,2)以下有关原子结构及元素周期律的叙
述正确的是(
)。
B
A.第ⅠA 族元素铯的两种同位素 137Cs 比 133Cs 多 4 个质子
B.同周期元素(除 0 族元素外)从左到右,原子半径逐渐减小
C.第ⅦA 族元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
解析:同位素原子是由同种元素组成的,其质子数相同,
A 错误;同周期元素(除 0 族元素外)从左到右,原子半径逐渐减
小,B 正确;主族元素从上到下,其氢化物的稳定性逐渐减弱,
C 错误;第 ⅦA 族元素的单质其熔点是逐渐增大的,D 错误。
C
层数的 2 倍。下列说法 的是(
4.(2011 新课标全国理综,13)短周期元素 W、X、Y 和 Z
的原子序数依次增大。元素 W 是制备一种高效电池的重要材
料,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地
壳中含量最丰富的金属元素,Z 原子的最外层电子数是其电子
)。
A.元素 W、X 的氯化物中,各原子均满足 8 电子的稳定
结构
B.元素 X 与氢形成的原子比为 1∶1 的化合物有很多种
C.元素 Y 的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素 Z 可与元素 X 形成共价化合物 XZ2
解析:根据题意可以判断元素W、X、Y、Z 分别是H、C、
Al、S。A 不正确,因为HCl 中的氢原子满足 2 电子稳定结构;
B 正确,因为C 与H 元素形成的 1∶1 的化合物可以是 C2H2、
C6H6、C8H8 等;C 正确,因为单质铝与氢氧化钠或盐酸反应都
会生成氢气;D 正确,因为C 与S 可以形成共价化合物CS2。
答案:A
5.(2011 福建理综,7)依据元素周期表及元素周期律,下列
推断正确的是(
)。
A.H3BO3 的酸性比 H2CO3 的强
B.Mg(OH)2 的碱性比 Be(OH)2 的强
C.HCl、HBr、HI 的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同, 则原子序数: R>M
答案:B
解析:C、B属于同周期元素,从左往右,元素最高价氧化物对应水化物的酸性逐渐增强,所以H3BO3的酸性比H2CO3的弱,A项错误;Mg、Be属于同主族元素,从上往下,元素最高价氧化物对应水化物的碱性逐渐增强,故B项正确;Cl、Br、I属于同主族元素,自上而下,其气态氢化物的稳定性逐渐减弱,故HCl、HBr、HI的热稳定性依次减弱,C项错误;若M、R的原子序数分别为x和y,由M+和R2-的核外电子层结构相同可得:x-1=y+2,因此x>y,即原子序数:R<M,D项错误。
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
6.(2010 上海高考,20)几种短周期元素的原子半径及主要
化合价如下表:
下列叙述正确的是(
)。
A.X、Y 元素的金属性:XB.一定条件下,Z 单质与 W 的常见单质直接生成 ZW2
C.Y 的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W 单质可以将 Z 单质从其氢化物中置换
出来
解析:此题考查了物质结构与元素周期律知识。根据题给
数据,X、Y 的化合价不同,但原子半径相差较小,可知两者
位于同一周期相邻主族,故金属性X>Y,A 错误;根据Z、W
的原子半径相差不大,化合价不同,且W 只有负价,则其可能
是O,Z 是N,两者的单质直接生成NO,B 错误;据此判断可
知X 是 Mg,Y 是Al,Y 的最高价氧化物的水化物是氢氧化铝,
其不溶于氨水,C 错误;一定条件下,氧气可以和氨气反应生
成水和氮气,D 正确。
答案:D
X Y
Z W
7.(2011 海南化学,13)四种短周期元素在周期表中的相对位
置如下图所示,其中 Z 元素原子核外电子总数是其最外层电子
数的 3 倍。
请回答下列问题:
(1)元素 Z 位于周期表中第___周期,_____族;
(2)这些元素的氢化物中,水溶液碱性最强的是___(写化学式);
(3)XW2 的电子式为___________________;
(4)Y 的最高价氧化物的化学式为_______;
(5)W 和 Y 形成的一种二元化合物具有色温效应,其相对分
子质量在 170~190 之间,且 W 的质量分数约为 70%,该化合
物的化学式为_______。
解析:Z 元素原子核外电子总数是其最外层电子数的 3 倍,
则 Z 为 P 元素,可知 Y 为 N 元素,X、W 分别为 C、S 元素。
(1)P 元素位于周期表中第 3 周期ⅤA 族;(2)四种元素的氢化物
中,水溶液碱性最强的是NH3;(3)XW2 为CS2,其结构与CO2
类似,所以其电子式为
;(4)N 的最高价为+5
价,其氧化物的化学式为 N2O5;(5)讨论 S 原子的个数,只有当
该化合物中 S 原子数为 4 时其相对分子质量介于170~190 之
间。根据 S 的质量分数可求得该化合物的相对分子质量为 184,
则该化合物含有 4 个 N 原子,其化学式为N4S4。
(2)NH3 (3)
答案:(1)3 ⅤA
(4)N2O5 (5)N4S4
一、原子结构
原子组成
原子核
质子:决定元素种类
中子:决定元素的同位素
核外电子:决定元素的性质
三数关系:质量数(A)=质子数(Z)+中子数(N)
质子数=核外电子数=核电荷数=原子序数
阳离子核外电子数=核内质子数-电荷数
阴离子核外电子数=核内质子数+电荷数
二、元素周期表的结构
三、位、构、性三者之间的关系
项目 同周期(从左到右) 同主族(从上到下)
价电子数(最外层电子数) 由 1 逐渐增加到 7 相同
主要化合价 最高正价由+1→+7
负价由-4→-1 最高正价相同(除
O、F 外)
原子半径 逐渐减小(惰性气体除
外) 逐渐增大
最高价氧化物对应水化
物的酸碱性 碱性减弱
酸性增强 碱性增强
酸性减弱
非金属的气态氢化物 生成由难到易
稳定性由弱到强 生成由易到难
稳定性由强到弱
得失电子能力 失电子由易→难
得电子由难→易 得电子由难→易
失电子由易→难
四、同主族、同周期原子结构及性质递变性
1.(2011 广东理综,双选,22)短周期元素甲、乙、丙、丁的
原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,
乙位于第 VA 族,甲和丙同主族,丁原子最外层电子数与电子
层数相等,则(
)。
A.原子半径:丙>丁>乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
解析:本题的突破口在于“甲和乙形成的气态化合物的水
溶液呈碱性”,在中学化学中只有氨气的水溶液才显碱性,由
于短周期元素甲、乙、丙、丁的原子序数依次增大,所以甲是
H,乙是 N;甲和丙同主族,因此丙只能是 Na,这说明丁属于
第三周期,根据丁原子最外层电子数与电子层数相等,所以丁
是 Al。同周期元素从左往右原子半径逐渐减小,金属性逐渐减
弱,所以选项 A 正确,B 不正确,还原性应该是 Na>Al>H;
Na 属于活泼金属,其氧化物 Na2O 属于离子化合物,C 不正确;
乙、丙、丁的最高价氧化物对应的水化物分别为 HNO3(强酸)、
NaOH(强碱)、Al(OH)3(两性氢氧化物),因此选项 D 也是正确的。
答案:AD
2.(2011 天津理综,2)以下有关原子结构及元素周期律的叙
述正确的是(
)。
B
A.第ⅠA 族元素铯的两种同位素 137Cs 比 133Cs 多 4 个质子
B.同周期元素(除 0 族元素外)从左到右,原子半径逐渐减小
C.第ⅦA 族元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
解析:同位素原子是由同种元素组成的,其质子数相同,
A 错误;同周期元素(除 0 族元素外)从左到右,原子半径逐渐减
小,B 正确;主族元素从上到下,其氢化物的稳定性逐渐减弱,
C 错误;第 ⅦA 族元素的单质其熔点是逐渐增大的,D 错误。
C
层数的 2 倍。下列说法 的是(
4.(2011 新课标全国理综,13)短周期元素 W、X、Y 和 Z
的原子序数依次增大。元素 W 是制备一种高效电池的重要材
料,X 原子的最外层电子数是内层电子数的 2 倍,元素 Y 是地
壳中含量最丰富的金属元素,Z 原子的最外层电子数是其电子
)。
A.元素 W、X 的氯化物中,各原子均满足 8 电子的稳定
结构
B.元素 X 与氢形成的原子比为 1∶1 的化合物有很多种
C.元素 Y 的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素 Z 可与元素 X 形成共价化合物 XZ2
解析:根据题意可以判断元素W、X、Y、Z 分别是H、C、
Al、S。A 不正确,因为HCl 中的氢原子满足 2 电子稳定结构;
B 正确,因为C 与H 元素形成的 1∶1 的化合物可以是 C2H2、
C6H6、C8H8 等;C 正确,因为单质铝与氢氧化钠或盐酸反应都
会生成氢气;D 正确,因为C 与S 可以形成共价化合物CS2。
答案:A
5.(2011 福建理综,7)依据元素周期表及元素周期律,下列
推断正确的是(
)。
A.H3BO3 的酸性比 H2CO3 的强
B.Mg(OH)2 的碱性比 Be(OH)2 的强
C.HCl、HBr、HI 的热稳定性依次增强
D.若M+和R2-的核外电子层结构相同, 则原子序数: R>M
答案:B
解析:C、B属于同周期元素,从左往右,元素最高价氧化物对应水化物的酸性逐渐增强,所以H3BO3的酸性比H2CO3的弱,A项错误;Mg、Be属于同主族元素,从上往下,元素最高价氧化物对应水化物的碱性逐渐增强,故B项正确;Cl、Br、I属于同主族元素,自上而下,其气态氢化物的稳定性逐渐减弱,故HCl、HBr、HI的热稳定性依次减弱,C项错误;若M、R的原子序数分别为x和y,由M+和R2-的核外电子层结构相同可得:x-1=y+2,因此x>y,即原子序数:R<M,D项错误。
元素代号 X Y Z W
原子半径/pm 160 143 70 66
主要化合价 +2 +3 +5、+3、-3 -2
6.(2010 上海高考,20)几种短周期元素的原子半径及主要
化合价如下表:
下列叙述正确的是(
)。
A.X、Y 元素的金属性:X
C.Y 的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W 单质可以将 Z 单质从其氢化物中置换
出来
解析:此题考查了物质结构与元素周期律知识。根据题给
数据,X、Y 的化合价不同,但原子半径相差较小,可知两者
位于同一周期相邻主族,故金属性X>Y,A 错误;根据Z、W
的原子半径相差不大,化合价不同,且W 只有负价,则其可能
是O,Z 是N,两者的单质直接生成NO,B 错误;据此判断可
知X 是 Mg,Y 是Al,Y 的最高价氧化物的水化物是氢氧化铝,
其不溶于氨水,C 错误;一定条件下,氧气可以和氨气反应生
成水和氮气,D 正确。
答案:D
X Y
Z W
7.(2011 海南化学,13)四种短周期元素在周期表中的相对位
置如下图所示,其中 Z 元素原子核外电子总数是其最外层电子
数的 3 倍。
请回答下列问题:
(1)元素 Z 位于周期表中第___周期,_____族;
(2)这些元素的氢化物中,水溶液碱性最强的是___(写化学式);
(3)XW2 的电子式为___________________;
(4)Y 的最高价氧化物的化学式为_______;
(5)W 和 Y 形成的一种二元化合物具有色温效应,其相对分
子质量在 170~190 之间,且 W 的质量分数约为 70%,该化合
物的化学式为_______。
解析:Z 元素原子核外电子总数是其最外层电子数的 3 倍,
则 Z 为 P 元素,可知 Y 为 N 元素,X、W 分别为 C、S 元素。
(1)P 元素位于周期表中第 3 周期ⅤA 族;(2)四种元素的氢化物
中,水溶液碱性最强的是NH3;(3)XW2 为CS2,其结构与CO2
类似,所以其电子式为
;(4)N 的最高价为+5
价,其氧化物的化学式为 N2O5;(5)讨论 S 原子的个数,只有当
该化合物中 S 原子数为 4 时其相对分子质量介于170~190 之
间。根据 S 的质量分数可求得该化合物的相对分子质量为 184,
则该化合物含有 4 个 N 原子,其化学式为N4S4。
(2)NH3 (3)
答案:(1)3 ⅤA
(4)N2O5 (5)N4S4
