第2章 第1节 1 化学键与化学反应中的物质变化
文档属性
| 名称 | 第2章 第1节 1 化学键与化学反应中的物质变化 |

|
|
| 格式 | zip | ||
| 文件大小 | 247.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 21:37:35 | ||
图片预览








文档简介
(共28张PPT)
第2章
化学键
化学反应与能量
本章教材首先以“化学键”为桥梁,引导学生从物质变化
和能量变化两个角度认识化学反应的实质;然后再认识不同化
学反应的速率不同以及某些化学反应进行的程度是有限的;最
后以“化学反应的利用”为主题,对学过的元素化合物、基础
概念和基本理论进行回顾、总结,深化并提升对化学反应研究
的应用价值的认识。
通过本章的学习,认识组成物质的微粒种类及微粒之间的
作用,从实质上认识物质发生化学变化的过程和发生的能量变
化的原理;理解化学反应快慢和限度的简单原理以及控制化学
反应快慢和限度的措施;了解如何利用化学反应制备物质,如
何通过化学反应获取能量。本章的重难点是化学键的含义和对
化学反应实质的理解、影响化学反应速率的因素、化学平衡的
建立及影响平衡移动的因素、如何运用化学反应制造新物质及
化学能怎样转化为电能。本章内容是高考的热点,常以选择题
和综合题的形式出现。
第1节 化学键与化学反应
是什么产生的能量把火箭推向太空?
1
化学键与化学反应中的物质变化
1.化学键与物质变化
相邻
强相互作用
(1)化学键的含义:_____原子间的__________称为化学键。
①“相邻”是指原子间直接相邻而非间接相邻。
②“原子”是广义的原子,既包括中性原子,也包括离子。
③化学键是一种强烈的相互作用,而分子间的弱相互作用
不是化学键。
④“相互作用”是指相互吸引与相互排斥的平衡。
⑤并非所有的物质中都含有化学键,如稀有气体是单原子
分子无化学键。
水在通电条件下发生分解反应,为什么要通电?
答案:一个水分子是由两个氢原子和一个氧原子构成的,
氢原子和氧原子之间存在着很强的相互作用,要破坏这种相互
作用就需要消耗能量,通电正是为了提供使水分解所需要的能
量。
(2)化学反应中物质变化的实质:_____________________
_______________。
旧化学键的断裂和
新化学键的形成
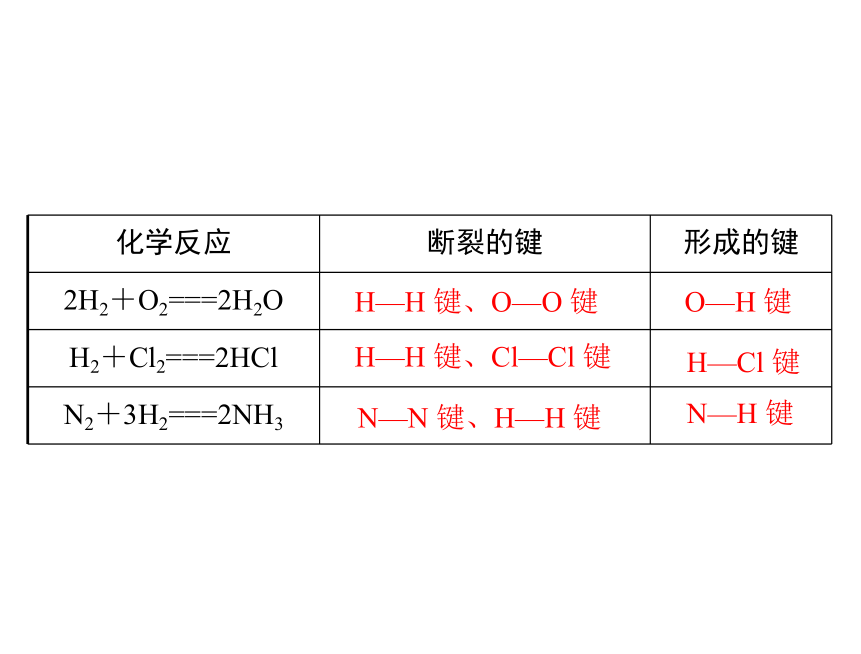
化学反应 断裂的键 形成的键
2H2+O2===2H2O
H2+Cl2===2HCl
N2+3H2===2NH3
H—H 键、O—O 键
O—H 键
H—H 键、Cl—Cl 键
N—N 键、H—H 键
H—Cl 键
N—H 键
2.共价键和离子键
(1)共价键
1
1
①共价键的形成过程(完成课本 P33 交流·研讨):
总结:氢原子最外层上有__个电子,只需得到___个电子就
可达到 2 个电子的稳定结构;而氯原子最外层上有___个电子,
只需得到___个电子便可达到 8 个电子的稳定结构。所以,在形
成氯化氢分子的过程中,氢原子和氯原子各提供一个电子组成
一对共用电子,使两者的最外电子层都达到稳定结构并产生强
烈的相互作用(化学键),从而形成氯化氢分子。
原子间
②共价键的定义:_______通过__________形成的化学键。
③成键微粒:______。
原子
其用电子对
7
1
哪些元素的原子相互结合时一般形成共价键?
答案:a.同种或不同种非金属元素原子间,如H2、Cl2、CO2
等。
b.少部分金属元素与非金属元素的原子间,如AlCl3、BeCl2
等。
(2)离子键
①离子键的形成过程(完成课本 P34 交流·研讨):
总结:钠原子最外层上有 1 个电子,易__________电子形
成 8 个电子稳定结构的 Na+;氯原子最外层上有 7 个电子,易
②离子键的定义:_________间通过_____作用形成的化学
键。一般存在于活泼金属和活泼非金属之间。
③成键微粒:___________。
阴、阳离子
___________电子形成8个电子稳定结构的Cl-,在氯化钠的形成过程中,钠原子最外层的一个电子转移到氯原子的最外电子层,形成带正电荷的Na+和带负电荷的Cl-,两种离子通过静电作用形成稳定化合物——氯化钠。
失去 1 个
得到 1 个
阴阳离子
静电
哪些元素的原子之间可能形成离子键?
答案:a.活泼的金属元素与活泼的非金属元素原子之间,
如 KCl、MgO 等。
b.全由非金属元素组成的化合物中也可能存在离子键,如
NH4Cl 等铵盐。
3.化学键与物质构成
人们根据化合物中所含化学键类型的不同,把化合物分为
______化合物和______化合物。
离子
共价
离子化合物:含有_______的化合物称为离子化合物,如
NaCl、KOH、CaO、MgCl2 等。
离子键
共价化合物:只含有_______的化合物称为共价化合物,如
HCl、H2O、CO2、CH4、NH3 等。
共价键
(1)当一种化合物中存在离子键时,该化合物是离子化合
物。
(2)当一种化合物中只. 存在共价键时,该化合物才称为共价
化合物。
1.化学键与物质变化
(1)定义:分子中相邻原子间的强相互作用称为化学键。
(2)化学反应中物质变化的实质
水在通电时分解成 H2 和 O2,在这个过程中首先水分子中
氢原子和氧原子间的化学键断裂,形成单个的氢原子和氧原子,
然后氢原子和氢原子间、氧原子和氧原子间分别又以新的化学
键结合成为氢分子和氧分子。结论:化学反应的实质——旧化
学键的断裂和新化学键的形成。
仅有旧化学键断裂而无新化学键的形成过程不是化学变
化,如氯化钠溶于水虽然有离子键的断裂,但无新化学键的形
成,故不属于化学变化。
2.离子键和共价键
离子键 共价键
定义 阴、阳离子间通过静电作用形成的化学键 原子间通过共用电子对形成的化学键
成键微粒 阴、阳离子 原子
成键方式 阴、阳离子间的静电作用 共用电子对
成键元素 活泼金属元素原子与活泼非金属元素原子之间容易形成 非金属元素原子之间
续表
离子键 共价键
典型代表 离子化合物中(大多数强碱、盐、金属氧化物中。例如:NaOH、BaSO4、Na2O) 多原子的非金属单质分子中、非金属元素形成的共价化合物中气态氢化物、非金属氧化物、酸、酸根、氢氧根(例如:HCl、CO2、H2SO4、CO 、OH-)
3.离子化合物与共价化合物的判断方法
(1)根据构成化合物的微粒间是以离子键还是共价键结合
判断。一般来说,活泼的金属元素原子和活泼的非金属元素原
子间易形成离子键,同种或不同种非金属原子间形成的是共价
键。
(2)根据化合物的类型来判断。大多数活泼金属氧化物、强
碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含
氧酸都属于共价化合物。
(3)根据化合物的性质来判断。熔、沸点较低的化合物(SiO2、
SiC 等除外),熔融状态下不能发生电离的化合物是共价化合物;
熔、沸点较高,熔融状态下能导电的化合物是离子化合物。
(2)共价化合物中只有共价键, 没有离子键。
4.物质类型与化学键类型的关系
(1) 离子化合物中一定有离子键,也可能有共价键, 如
NH4Cl。
(3)稀有气体是单原子分子,不含化学键;非金属单质中一
定只含共价键。
(4)离子化合物中一般既含金属元素又含非金属元素(铵盐
除外);共价化合物中一般只含非金属元素,但只含非金属元素
的化合物不一定是共价化合物,如(NH4)2SO4;含有金属元素的
化合物不一定是离子化合物,如 AlCl3 等。
例1.(双选)下列关于化学键的叙述正确的是(
)。
CD
A.化学键既存在于相邻原子之间,又存在于相邻分子之间
B.两个原子之间的相互作用叫化学键
C.化学键通常指的是相邻的两个或多个原子之间的强相
互作用
D.化学键包含离子键和共价键
解析:本题主要考查对化学键定义的掌握和理解情况。化
学键的定义强调两个方面:一是“相邻的两个或多个原子之
间”;二是“强相互作用”。选项 A、B 中都没有明确说明这
两点,所以不正确。
例 2.(2011 广东潮州检测)下列各组化合物中化学键类型不
同的是(
)。
A
A.NaCl 和 HNO3
B.H2O 和 NH3
C.MgF2 和 NaCl
D.H2O 和 CO2
解析:A 项NaCl 含有离子键,HNO3 中含有共价键;B 项
都只含有共价键;C 项都只含有离子键;D 项都只含有共价键。
)。
A
例3.下列物质中属于离子化合物的是(
A.苛性钾
B.氯化氢
C.硫酸
D.醋酸
解析:由阴、阳离子通过离子键结合而成的化合物为离子
化合物,包括大部分盐、可溶性强碱、活泼金属的氧化物等,
A 正确;不同原子间通过共价键所形成的化合物为共价化合物,
如酸、气态氢化物、非金属氧化物等,故B、C、D 项均为共价
化合物。
例4.下列关于化合物的叙述正确的是(
)。
D
A.离子化合物一定同时含有共价键
B.共价化合物可能含有离子键
C.离子化合物中只含离子键
D.共价化合物不含离子键
解析:离子键只存在于离子化合物中,但离子化合物中除
含离子键外还可能含有共价键;共价化合物中一定不存在离子
键,肯定只存在共价键。
1.(2011 广东潮州检测)下列叙述中正确的是(
)。
A.含有离子键的化合物一定是离子化合物
B.具有共价键的化合物一定是共价化合物
C.在化合物 CaCl2 中,两个氯离子之间也存在离子键
D.化学键是分子中多个原子之间强烈的相互吸引作用
A
2.下列叙述错误的是(
)。
D
A.带相反电荷的离子之间的相互作用称为离子键
B.某元素原子最外层只有一个电子,它与卤素结合时所
形成的化学键不一定是离子键
C.金属元素与非金属元素化合时,不一定形成离子键
D.非金属元素间不可能形成离子键
解析:相反电荷的离子之间即阴、阳离子之间形成离子键;
某元素最外层只有 1 个电子,可能是ⅠA 元素,若是氢元素,
与卤素化合时形成共价键,若是碱金属元素,与卤素化合时形
成离子键;金属元素与非金属元素间可能形成共价键如AlCl3;
非金属元素间可能形成离子键,如铵盐。
3.(2011 广东学业水平)下列物质中既含有共价键又含有离
)。
D
子键的是(
A.NaI
C.NO2
B.CaCl2
D.KNO3
解析:NaI、CaCl2 仅含离子键;NO2 只含共价键。
4.下列物质中含有共价键的离子化合物是(
)。
B
①MgF2
②Na2O2
③NaOH
④NH4Cl
⑤CO2
⑥H2O2
⑦N2
A.②③④⑤⑦
C.①②③④⑥
B.②③④
D.①③⑤⑥
解析:MgF2 只含离子键;H2O2 、CO2 是共价化合物;N2
不是化合物。
第2章
化学键
化学反应与能量
本章教材首先以“化学键”为桥梁,引导学生从物质变化
和能量变化两个角度认识化学反应的实质;然后再认识不同化
学反应的速率不同以及某些化学反应进行的程度是有限的;最
后以“化学反应的利用”为主题,对学过的元素化合物、基础
概念和基本理论进行回顾、总结,深化并提升对化学反应研究
的应用价值的认识。
通过本章的学习,认识组成物质的微粒种类及微粒之间的
作用,从实质上认识物质发生化学变化的过程和发生的能量变
化的原理;理解化学反应快慢和限度的简单原理以及控制化学
反应快慢和限度的措施;了解如何利用化学反应制备物质,如
何通过化学反应获取能量。本章的重难点是化学键的含义和对
化学反应实质的理解、影响化学反应速率的因素、化学平衡的
建立及影响平衡移动的因素、如何运用化学反应制造新物质及
化学能怎样转化为电能。本章内容是高考的热点,常以选择题
和综合题的形式出现。
第1节 化学键与化学反应
是什么产生的能量把火箭推向太空?
1
化学键与化学反应中的物质变化
1.化学键与物质变化
相邻
强相互作用
(1)化学键的含义:_____原子间的__________称为化学键。
①“相邻”是指原子间直接相邻而非间接相邻。
②“原子”是广义的原子,既包括中性原子,也包括离子。
③化学键是一种强烈的相互作用,而分子间的弱相互作用
不是化学键。
④“相互作用”是指相互吸引与相互排斥的平衡。
⑤并非所有的物质中都含有化学键,如稀有气体是单原子
分子无化学键。
水在通电条件下发生分解反应,为什么要通电?
答案:一个水分子是由两个氢原子和一个氧原子构成的,
氢原子和氧原子之间存在着很强的相互作用,要破坏这种相互
作用就需要消耗能量,通电正是为了提供使水分解所需要的能
量。
(2)化学反应中物质变化的实质:_____________________
_______________。
旧化学键的断裂和
新化学键的形成
化学反应 断裂的键 形成的键
2H2+O2===2H2O
H2+Cl2===2HCl
N2+3H2===2NH3
H—H 键、O—O 键
O—H 键
H—H 键、Cl—Cl 键
N—N 键、H—H 键
H—Cl 键
N—H 键
2.共价键和离子键
(1)共价键
1
1
①共价键的形成过程(完成课本 P33 交流·研讨):
总结:氢原子最外层上有__个电子,只需得到___个电子就
可达到 2 个电子的稳定结构;而氯原子最外层上有___个电子,
只需得到___个电子便可达到 8 个电子的稳定结构。所以,在形
成氯化氢分子的过程中,氢原子和氯原子各提供一个电子组成
一对共用电子,使两者的最外电子层都达到稳定结构并产生强
烈的相互作用(化学键),从而形成氯化氢分子。
原子间
②共价键的定义:_______通过__________形成的化学键。
③成键微粒:______。
原子
其用电子对
7
1
哪些元素的原子相互结合时一般形成共价键?
答案:a.同种或不同种非金属元素原子间,如H2、Cl2、CO2
等。
b.少部分金属元素与非金属元素的原子间,如AlCl3、BeCl2
等。
(2)离子键
①离子键的形成过程(完成课本 P34 交流·研讨):
总结:钠原子最外层上有 1 个电子,易__________电子形
成 8 个电子稳定结构的 Na+;氯原子最外层上有 7 个电子,易
②离子键的定义:_________间通过_____作用形成的化学
键。一般存在于活泼金属和活泼非金属之间。
③成键微粒:___________。
阴、阳离子
___________电子形成8个电子稳定结构的Cl-,在氯化钠的形成过程中,钠原子最外层的一个电子转移到氯原子的最外电子层,形成带正电荷的Na+和带负电荷的Cl-,两种离子通过静电作用形成稳定化合物——氯化钠。
失去 1 个
得到 1 个
阴阳离子
静电
哪些元素的原子之间可能形成离子键?
答案:a.活泼的金属元素与活泼的非金属元素原子之间,
如 KCl、MgO 等。
b.全由非金属元素组成的化合物中也可能存在离子键,如
NH4Cl 等铵盐。
3.化学键与物质构成
人们根据化合物中所含化学键类型的不同,把化合物分为
______化合物和______化合物。
离子
共价
离子化合物:含有_______的化合物称为离子化合物,如
NaCl、KOH、CaO、MgCl2 等。
离子键
共价化合物:只含有_______的化合物称为共价化合物,如
HCl、H2O、CO2、CH4、NH3 等。
共价键
(1)当一种化合物中存在离子键时,该化合物是离子化合
物。
(2)当一种化合物中只. 存在共价键时,该化合物才称为共价
化合物。
1.化学键与物质变化
(1)定义:分子中相邻原子间的强相互作用称为化学键。
(2)化学反应中物质变化的实质
水在通电时分解成 H2 和 O2,在这个过程中首先水分子中
氢原子和氧原子间的化学键断裂,形成单个的氢原子和氧原子,
然后氢原子和氢原子间、氧原子和氧原子间分别又以新的化学
键结合成为氢分子和氧分子。结论:化学反应的实质——旧化
学键的断裂和新化学键的形成。
仅有旧化学键断裂而无新化学键的形成过程不是化学变
化,如氯化钠溶于水虽然有离子键的断裂,但无新化学键的形
成,故不属于化学变化。
2.离子键和共价键
离子键 共价键
定义 阴、阳离子间通过静电作用形成的化学键 原子间通过共用电子对形成的化学键
成键微粒 阴、阳离子 原子
成键方式 阴、阳离子间的静电作用 共用电子对
成键元素 活泼金属元素原子与活泼非金属元素原子之间容易形成 非金属元素原子之间
续表
离子键 共价键
典型代表 离子化合物中(大多数强碱、盐、金属氧化物中。例如:NaOH、BaSO4、Na2O) 多原子的非金属单质分子中、非金属元素形成的共价化合物中气态氢化物、非金属氧化物、酸、酸根、氢氧根(例如:HCl、CO2、H2SO4、CO 、OH-)
3.离子化合物与共价化合物的判断方法
(1)根据构成化合物的微粒间是以离子键还是共价键结合
判断。一般来说,活泼的金属元素原子和活泼的非金属元素原
子间易形成离子键,同种或不同种非金属原子间形成的是共价
键。
(2)根据化合物的类型来判断。大多数活泼金属氧化物、强
碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含
氧酸都属于共价化合物。
(3)根据化合物的性质来判断。熔、沸点较低的化合物(SiO2、
SiC 等除外),熔融状态下不能发生电离的化合物是共价化合物;
熔、沸点较高,熔融状态下能导电的化合物是离子化合物。
(2)共价化合物中只有共价键, 没有离子键。
4.物质类型与化学键类型的关系
(1) 离子化合物中一定有离子键,也可能有共价键, 如
NH4Cl。
(3)稀有气体是单原子分子,不含化学键;非金属单质中一
定只含共价键。
(4)离子化合物中一般既含金属元素又含非金属元素(铵盐
除外);共价化合物中一般只含非金属元素,但只含非金属元素
的化合物不一定是共价化合物,如(NH4)2SO4;含有金属元素的
化合物不一定是离子化合物,如 AlCl3 等。
例1.(双选)下列关于化学键的叙述正确的是(
)。
CD
A.化学键既存在于相邻原子之间,又存在于相邻分子之间
B.两个原子之间的相互作用叫化学键
C.化学键通常指的是相邻的两个或多个原子之间的强相
互作用
D.化学键包含离子键和共价键
解析:本题主要考查对化学键定义的掌握和理解情况。化
学键的定义强调两个方面:一是“相邻的两个或多个原子之
间”;二是“强相互作用”。选项 A、B 中都没有明确说明这
两点,所以不正确。
例 2.(2011 广东潮州检测)下列各组化合物中化学键类型不
同的是(
)。
A
A.NaCl 和 HNO3
B.H2O 和 NH3
C.MgF2 和 NaCl
D.H2O 和 CO2
解析:A 项NaCl 含有离子键,HNO3 中含有共价键;B 项
都只含有共价键;C 项都只含有离子键;D 项都只含有共价键。
)。
A
例3.下列物质中属于离子化合物的是(
A.苛性钾
B.氯化氢
C.硫酸
D.醋酸
解析:由阴、阳离子通过离子键结合而成的化合物为离子
化合物,包括大部分盐、可溶性强碱、活泼金属的氧化物等,
A 正确;不同原子间通过共价键所形成的化合物为共价化合物,
如酸、气态氢化物、非金属氧化物等,故B、C、D 项均为共价
化合物。
例4.下列关于化合物的叙述正确的是(
)。
D
A.离子化合物一定同时含有共价键
B.共价化合物可能含有离子键
C.离子化合物中只含离子键
D.共价化合物不含离子键
解析:离子键只存在于离子化合物中,但离子化合物中除
含离子键外还可能含有共价键;共价化合物中一定不存在离子
键,肯定只存在共价键。
1.(2011 广东潮州检测)下列叙述中正确的是(
)。
A.含有离子键的化合物一定是离子化合物
B.具有共价键的化合物一定是共价化合物
C.在化合物 CaCl2 中,两个氯离子之间也存在离子键
D.化学键是分子中多个原子之间强烈的相互吸引作用
A
2.下列叙述错误的是(
)。
D
A.带相反电荷的离子之间的相互作用称为离子键
B.某元素原子最外层只有一个电子,它与卤素结合时所
形成的化学键不一定是离子键
C.金属元素与非金属元素化合时,不一定形成离子键
D.非金属元素间不可能形成离子键
解析:相反电荷的离子之间即阴、阳离子之间形成离子键;
某元素最外层只有 1 个电子,可能是ⅠA 元素,若是氢元素,
与卤素化合时形成共价键,若是碱金属元素,与卤素化合时形
成离子键;金属元素与非金属元素间可能形成共价键如AlCl3;
非金属元素间可能形成离子键,如铵盐。
3.(2011 广东学业水平)下列物质中既含有共价键又含有离
)。
D
子键的是(
A.NaI
C.NO2
B.CaCl2
D.KNO3
解析:NaI、CaCl2 仅含离子键;NO2 只含共价键。
4.下列物质中含有共价键的离子化合物是(
)。
B
①MgF2
②Na2O2
③NaOH
④NH4Cl
⑤CO2
⑥H2O2
⑦N2
A.②③④⑤⑦
C.①②③④⑥
B.②③④
D.①③⑤⑥
解析:MgF2 只含离子键;H2O2 、CO2 是共价化合物;N2
不是化合物。
