第2章 第3节 1 利用化学反应制备物质
文档属性
| 名称 | 第2章 第3节 1 利用化学反应制备物质 |

|
|
| 格式 | zip | ||
| 文件大小 | 502.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 00:00:00 | ||
图片预览










文档简介
(共30张PPT)
第3节 化学反应的利用
化学变化最重要的标志是有新物质的生
成,人类文明的发展历史也就是新物质不断
被合成的历史,现在广泛应用的漂白粉等物
质就是利用化学反应来合成的。那么,新物
质的合成对人类的发展起了什么重大的作
用?化学反应在人们的生活中还有哪些方面
的应用?
1
利用化学反应制备物质
1.氯气的制备及应用
舍勒
二氧化锰
盐酸
最早发现氯气的是瑞典化学家_____。他在研究软锰矿矿石
(主要成分是___________)时,把_____和软锰矿矿石混合在一
起加热,发现有一种令人窒息的_______气体生成。这种气体就
是氯气。至今,实验室中仍用这种方法制取氯气。
黄绿色
(1)实验室制法
MnCl2+Cl2↑+2H2O
实验室制氯气的化学方程式为_______________________
____________________,制取氯气的装置中的主要玻璃仪器有
_______________________________________________ ; 采 用
______________________________收集气体;尾气有毒,应该
用___________溶液吸收,吸收反应的化学方程式为_________
_______________________________________。
氢氧化钠
Cl2+2NaOH===NaCl+NaClO+H2O
MnO2+4HCl(浓)
圆底烧瓶、分液漏斗、酒精灯、集气瓶、烧杯
向上排空气法或排饱和食盐水法
实验室制氯气的反应是氧化还原反应吗?如果是,哪种物
质是氧化剂?哪种物质是还原剂?
答案:是
氧化剂是 MnO2
还原剂是 HCl
NaOH、H2
2NaCl+2H2O
H2O
NaCl
食盐水
(2)工业制法
工业上采用电解饱和______的方法制取____________ 和
该反应中氧化剂是______,还原剂是______。
Cl2。化学方程式为_____________ __________________;
离子方程式为____________ _____________________,
2NaOH+H2↑+Cl2↑
2Cl-+2H2O
2OH-+H2↑+Cl2↑
现代化学工业中用电解饱和食盐水的方法制备氯气,你能
找出氯气的实验室制法和工业制法的共同点吗?
答案:(1)都是通过氧化还原反应制取。(2)都是将-1价的
氯氧化为0价的氯。
物质 化学方程式
氢气 _______________________________(实验室)
高温 催化剂
C+H2O(g)=====CO+H2 或 CH4+H2O ===== CO+3H2(工
高温
业)
二氧化碳 __________________________________(实验室)
生铁
________________________________(工业)
硫酸
①___________________
②_____________________
③_____________________(工业)
2.其他物质的制备(填写下表)
Zn+H2SO4===ZnSO4+H2↑
CaCO3+2HCl===CaCl2+H2O+CO2↑
2SO2+O2 2SO3
SO3+H2O===H2SO4
物质 化学方程式
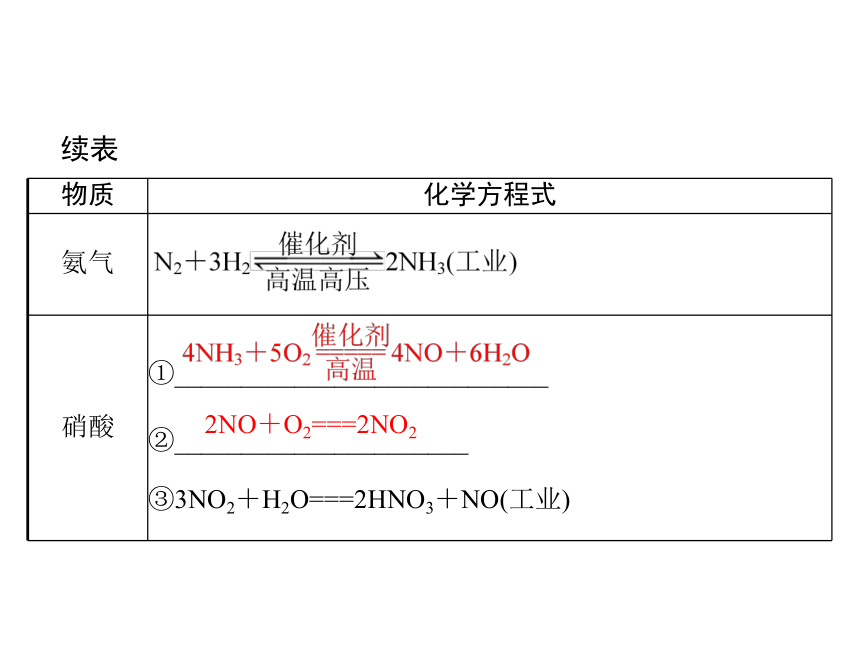
氨气
硝酸
①____________________________
②______________________
③3NO2+H2O===2HNO3+NO(工业)
2NO+O2===2NO2
续表
怎样利用化学反应来制备一种新物质呢?
答案:应该根据物质的性质,选择科学合理的实验原理,
合适的仪器和药品;根据实验的特点,设计安全可靠的实验装
置;实验室中制备物质还要考虑切实可行和简单易行。如果是
工业生产,还需考虑原料的用量、价格以及设备的承受能力等。
1.氯气的实验室制法
(1)反应的原理:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
注意:稀盐酸与 MnO2 作用不能制取 Cl2。
(2)制气类型:固体+液体
气体
(3)发生装置:(仪器名称)圆底烧瓶和分液漏斗
(4)收集方法:向上排空气或排饱和食盐水法
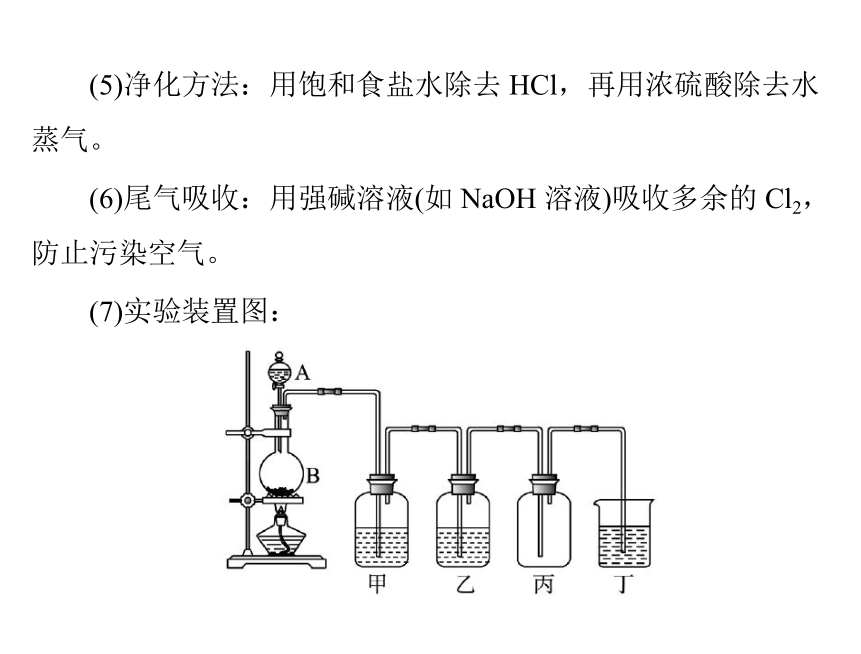
(5)净化方法:用饱和食盐水除去 HCl,再用浓硫酸除去水
蒸气。
(6)尾气吸收:用强碱溶液(如 NaOH 溶液)吸收多余的 Cl2,
防止污染空气。
(7)实验装置图:
反应
类型 制取装置 典型
气体 化学方程式(或离子方程式)
固体
反应物
(加热) O2 MnO2
2KClO3=====2KCl+3O2↑
△
NH3 2NH4Cl+Ca(OH)2 CaCl2+
2NH3↑+2H2O
2.实验室制备气体综述
(1)气体发生装置的类型
设计原则:根据制取气体所需的反应物状态(固体或液体)
及反应条件等因素来选择反应装置。
反应类型 制取装置 典型气体 化学方程式(或离子方程式)
固液
反应物
(不加热) H2
CO2
固液
反应物
(加热) Cl2 MnO2+4HCl(浓) MnCl2+
Cl2↑+2H2O
Zn+2H+===Zn2++H2↑
CaCO3+2H+===Ca2++
CO2↑+ H2O
续表
装置类型 装置示意图 适用范围
液体除杂
剂(不加热) 不溶于水
(或液体)的气体
固体除杂
剂(不加热) 常温下不与
除杂剂反应
固体除杂
剂(加热) 加热条件下不
与除杂剂反应
(2)净化与干燥装置
设计原则:根据净化药品的状态及性质
装置类型 装置示意图 适用范围 典型气体
排水(液
体)法 气体难溶于水或微溶
于水 H2、O2、
NO、CO
向下排
空气法 气体密度<空气(相对
分子质量<29) H2、NH3、
CH4 等
向上排
空气法 气体密度>空气(相对
分子质量>29) CO2、Cl2、
HCl、SO2 等
(3)收集装置
设计原则:根据气体的溶解性或密度
气体净化与干燥注意事项:一般情况下,若采用溶液作除
杂试剂,则是先除杂后干燥;若采用加热除去杂质,则是先干
燥后加热。
(4)尾气处理
①点燃法:如 CO、H2、CH4 等易燃气体,可用此法。
②吸收法:利用尾气易溶于烧杯中的液体或与其发生反应
吸收。如 Cl2、SO2、HCl、H2S 等可用水或碱液吸收。用碱液吸
收气体的两种常用方法如下图:(B 为防倒吸装置)
例1.在实验中用 MnO2 和浓盐酸反应制备纯净干燥的氯气。
(1)写出反应的化学方程式:________________________。
(2)下图是一个学生设计的实验装置图。
这个装置中有哪些错误?请分别指出。
①______________________;
②______________________;
③_______________________________________________;
④_______________________________________________;
(有几处填几处)
(3)在改正的装置中,①洗气瓶中的饱和食盐水,②浓硫酸,
③烧杯中的 NaOH 溶液各起什么作用?
解析:本题属于识图题,要求学生根据实验目的,对全套
实验装置中错误之处作出判断,学生必须对实验制取氯气的反
应原理和实验装置非常熟悉。首先应根据试题要求制得干燥、
纯净的氯气。用 MnO2 和浓盐酸共热制得的氯气中,有挥发出
来的 HCl 气体和水蒸气,这是两种要除掉的杂质。用饱和食盐
水是为了除去 HCl 气体,这个装置必须在前,用浓硫酸洗气是
为了除掉水蒸气,应该在后,图中两个洗气瓶的进出气导管都
装反了。
答案:(1)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(2)①烧瓶下面缺石棉网
②铁圈下面缺酒精灯
③盛浓
硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
④两个洗
气瓶中的进气管应插入液面下,而出气管口应靠近瓶塞
②吸收水蒸气
③吸收
(3)①吸收挥发出的氯化氢气体
多余的氯气
气体 A B C D
Cl2 浓盐酸 MnO2 NaOH 溶液 浓硫酸
NH3 饱和 NH4Cl 溶液 消石灰 H2O 固体 NaCl
NO 稀硝酸 铜屑 H2O P2O5
例2.拟用下图装置制取表中的三种干燥、纯净的气体(图中
铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加
热;A、B、C、D 表示相应仪器中加入的试剂)。
(1)上述方法中可以得到干燥、纯净的气体是_____。
(2)指出不能用上述制取的气体,并说明理由(可以不填满)。
①___,理由是_____________________________________。
②____,理由是____________________________________。
NH3
反应生成的 NH3 被 C 中的 H2O 吸收了
解析:制Cl2时反应生成的Cl2能与NaOH溶液反应,无法得到氯气;制NH3时反应生成的NH3能与H2O反应,无法得到NH3。
NO
Cl2
反应生成的 Cl2 被 C 中的 NaOH 溶液吸收了
物质的制备要考虑生成物质的反应原理和条件、物质的净
化和干燥,对于气体还要考虑气体的收集。
例3.实验室里用下图所示装置制取纯净的无水 CuCl2。试
回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的
吸收 HCl 气体
浓硫酸
干燥气体
方向和数目_________________________________________。
(2)B 处盛有饱和食盐水(或水),其作用是_____________。
(3)C 处盛放的试剂为_______(填名称),其作用是________。
(4)E 处盛有__________(填名称),发生反应的离子方程式
为__________________________________。
D
(5)实验结束时,应先熄灭_____处酒精灯。
氢氧化钠
2OH-+Cl2===Cl-+ClO-+H2O
例 4.下列各组气体在常温下能共存且能用向上排空气法收
集的是(
)。
D
A.NO 和 O2
C.H2 和 CO
B.HCl 和 NH3
D.SO2 和 CO2
解析:A 和 B 选项中的两组气体常温下会发生反应,不能
共存;C 选项中的 H2 用向下排空气法收集,而 CO 一般用排水
法收集;D 选项中的 SO2 和 CO2 常温下不发生反应,而且两者
的密度均比空气大,都可以用向上排空气法收集。
1.实验室用 MnO2 和浓盐酸制取纯净的氯气时,气体通过两
个洗气瓶,第二个洗气瓶应盛(
)。
A.稀盐酸
B
B.浓硫酸
C.水
D.饱和食盐水
解析:由于氯气中的杂质气体是 HCl 和水蒸气,首先要除
去 HCl,用饱和食盐水,然后用浓硫酸除去水蒸气。
2.(双选)已知在实验室用 KMnO4 和浓盐酸制取 Cl2 无需加
热,则下列说法正确的是(
)。
BD
A.Cl2 是还原产物
B.KMnO4 氧化性强于 MnO2
C.氧化产物与还原产物物质的量之比为 1∶8
是 10 mol
D.若2 mol KMnO4参加反应,则Cl-失去电子的物质的量
3.从氧化还原反应的角度看,在实验室制取①H2、②CO2、
③Cl2 三种气体的反应中,盐酸的作用(
)。
A
A.①②③互不相同
B.在①和②中相同
C.在②和③中相同
D.在①②③中均相同
解析:制取H2 时盐酸的作用是酸性和氧化性;制取CO2
时盐酸的作用只是酸性;制取Cl2 时,盐酸的作用是酸性和还
原性。
4.用排气法收集下列气体时,如何确定集气瓶内的气体已
收集满?请写出简单的操作步骤、现象及结论。
(1)O2:________________________________________
证明氧气已集满
(2)Cl2:___________________________________________
(3)HCl:_________________________________________
(4)NH3:________________________________________
将带火星的木条伸到集气瓶口,木条复燃,
_____________;
蓝,证明氯气已集满
将湿润的淀粉碘化钾试纸置于瓶口,试纸变
_________________;
红,证明氯化氢气体已集满
将湿润的蓝色石蕊试纸置于瓶口,试纸变
______________________;
蓝,证明氨气已集满
将湿润的红色石蕊试纸置于瓶口,试纸变
_________________。
第3节 化学反应的利用
化学变化最重要的标志是有新物质的生
成,人类文明的发展历史也就是新物质不断
被合成的历史,现在广泛应用的漂白粉等物
质就是利用化学反应来合成的。那么,新物
质的合成对人类的发展起了什么重大的作
用?化学反应在人们的生活中还有哪些方面
的应用?
1
利用化学反应制备物质
1.氯气的制备及应用
舍勒
二氧化锰
盐酸
最早发现氯气的是瑞典化学家_____。他在研究软锰矿矿石
(主要成分是___________)时,把_____和软锰矿矿石混合在一
起加热,发现有一种令人窒息的_______气体生成。这种气体就
是氯气。至今,实验室中仍用这种方法制取氯气。
黄绿色
(1)实验室制法
MnCl2+Cl2↑+2H2O
实验室制氯气的化学方程式为_______________________
____________________,制取氯气的装置中的主要玻璃仪器有
_______________________________________________ ; 采 用
______________________________收集气体;尾气有毒,应该
用___________溶液吸收,吸收反应的化学方程式为_________
_______________________________________。
氢氧化钠
Cl2+2NaOH===NaCl+NaClO+H2O
MnO2+4HCl(浓)
圆底烧瓶、分液漏斗、酒精灯、集气瓶、烧杯
向上排空气法或排饱和食盐水法
实验室制氯气的反应是氧化还原反应吗?如果是,哪种物
质是氧化剂?哪种物质是还原剂?
答案:是
氧化剂是 MnO2
还原剂是 HCl
NaOH、H2
2NaCl+2H2O
H2O
NaCl
食盐水
(2)工业制法
工业上采用电解饱和______的方法制取____________ 和
该反应中氧化剂是______,还原剂是______。
Cl2。化学方程式为_____________ __________________;
离子方程式为____________ _____________________,
2NaOH+H2↑+Cl2↑
2Cl-+2H2O
2OH-+H2↑+Cl2↑
现代化学工业中用电解饱和食盐水的方法制备氯气,你能
找出氯气的实验室制法和工业制法的共同点吗?
答案:(1)都是通过氧化还原反应制取。(2)都是将-1价的
氯氧化为0价的氯。
物质 化学方程式
氢气 _______________________________(实验室)
高温 催化剂
C+H2O(g)=====CO+H2 或 CH4+H2O ===== CO+3H2(工
高温
业)
二氧化碳 __________________________________(实验室)
生铁
________________________________(工业)
硫酸
①___________________
②_____________________
③_____________________(工业)
2.其他物质的制备(填写下表)
Zn+H2SO4===ZnSO4+H2↑
CaCO3+2HCl===CaCl2+H2O+CO2↑
2SO2+O2 2SO3
SO3+H2O===H2SO4
物质 化学方程式
氨气
硝酸
①____________________________
②______________________
③3NO2+H2O===2HNO3+NO(工业)
2NO+O2===2NO2
续表
怎样利用化学反应来制备一种新物质呢?
答案:应该根据物质的性质,选择科学合理的实验原理,
合适的仪器和药品;根据实验的特点,设计安全可靠的实验装
置;实验室中制备物质还要考虑切实可行和简单易行。如果是
工业生产,还需考虑原料的用量、价格以及设备的承受能力等。
1.氯气的实验室制法
(1)反应的原理:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
注意:稀盐酸与 MnO2 作用不能制取 Cl2。
(2)制气类型:固体+液体
气体
(3)发生装置:(仪器名称)圆底烧瓶和分液漏斗
(4)收集方法:向上排空气或排饱和食盐水法
(5)净化方法:用饱和食盐水除去 HCl,再用浓硫酸除去水
蒸气。
(6)尾气吸收:用强碱溶液(如 NaOH 溶液)吸收多余的 Cl2,
防止污染空气。
(7)实验装置图:
反应
类型 制取装置 典型
气体 化学方程式(或离子方程式)
固体
反应物
(加热) O2 MnO2
2KClO3=====2KCl+3O2↑
△
NH3 2NH4Cl+Ca(OH)2 CaCl2+
2NH3↑+2H2O
2.实验室制备气体综述
(1)气体发生装置的类型
设计原则:根据制取气体所需的反应物状态(固体或液体)
及反应条件等因素来选择反应装置。
反应类型 制取装置 典型气体 化学方程式(或离子方程式)
固液
反应物
(不加热) H2
CO2
固液
反应物
(加热) Cl2 MnO2+4HCl(浓) MnCl2+
Cl2↑+2H2O
Zn+2H+===Zn2++H2↑
CaCO3+2H+===Ca2++
CO2↑+ H2O
续表
装置类型 装置示意图 适用范围
液体除杂
剂(不加热) 不溶于水
(或液体)的气体
固体除杂
剂(不加热) 常温下不与
除杂剂反应
固体除杂
剂(加热) 加热条件下不
与除杂剂反应
(2)净化与干燥装置
设计原则:根据净化药品的状态及性质
装置类型 装置示意图 适用范围 典型气体
排水(液
体)法 气体难溶于水或微溶
于水 H2、O2、
NO、CO
向下排
空气法 气体密度<空气(相对
分子质量<29) H2、NH3、
CH4 等
向上排
空气法 气体密度>空气(相对
分子质量>29) CO2、Cl2、
HCl、SO2 等
(3)收集装置
设计原则:根据气体的溶解性或密度
气体净化与干燥注意事项:一般情况下,若采用溶液作除
杂试剂,则是先除杂后干燥;若采用加热除去杂质,则是先干
燥后加热。
(4)尾气处理
①点燃法:如 CO、H2、CH4 等易燃气体,可用此法。
②吸收法:利用尾气易溶于烧杯中的液体或与其发生反应
吸收。如 Cl2、SO2、HCl、H2S 等可用水或碱液吸收。用碱液吸
收气体的两种常用方法如下图:(B 为防倒吸装置)
例1.在实验中用 MnO2 和浓盐酸反应制备纯净干燥的氯气。
(1)写出反应的化学方程式:________________________。
(2)下图是一个学生设计的实验装置图。
这个装置中有哪些错误?请分别指出。
①______________________;
②______________________;
③_______________________________________________;
④_______________________________________________;
(有几处填几处)
(3)在改正的装置中,①洗气瓶中的饱和食盐水,②浓硫酸,
③烧杯中的 NaOH 溶液各起什么作用?
解析:本题属于识图题,要求学生根据实验目的,对全套
实验装置中错误之处作出判断,学生必须对实验制取氯气的反
应原理和实验装置非常熟悉。首先应根据试题要求制得干燥、
纯净的氯气。用 MnO2 和浓盐酸共热制得的氯气中,有挥发出
来的 HCl 气体和水蒸气,这是两种要除掉的杂质。用饱和食盐
水是为了除去 HCl 气体,这个装置必须在前,用浓硫酸洗气是
为了除掉水蒸气,应该在后,图中两个洗气瓶的进出气导管都
装反了。
答案:(1)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(2)①烧瓶下面缺石棉网
②铁圈下面缺酒精灯
③盛浓
硫酸的洗气瓶和盛饱和食盐水的洗气瓶位置颠倒了
④两个洗
气瓶中的进气管应插入液面下,而出气管口应靠近瓶塞
②吸收水蒸气
③吸收
(3)①吸收挥发出的氯化氢气体
多余的氯气
气体 A B C D
Cl2 浓盐酸 MnO2 NaOH 溶液 浓硫酸
NH3 饱和 NH4Cl 溶液 消石灰 H2O 固体 NaCl
NO 稀硝酸 铜屑 H2O P2O5
例2.拟用下图装置制取表中的三种干燥、纯净的气体(图中
铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加
热;A、B、C、D 表示相应仪器中加入的试剂)。
(1)上述方法中可以得到干燥、纯净的气体是_____。
(2)指出不能用上述制取的气体,并说明理由(可以不填满)。
①___,理由是_____________________________________。
②____,理由是____________________________________。
NH3
反应生成的 NH3 被 C 中的 H2O 吸收了
解析:制Cl2时反应生成的Cl2能与NaOH溶液反应,无法得到氯气;制NH3时反应生成的NH3能与H2O反应,无法得到NH3。
NO
Cl2
反应生成的 Cl2 被 C 中的 NaOH 溶液吸收了
物质的制备要考虑生成物质的反应原理和条件、物质的净
化和干燥,对于气体还要考虑气体的收集。
例3.实验室里用下图所示装置制取纯净的无水 CuCl2。试
回答下列问题:
(1)写出烧瓶中发生反应的化学方程式,并标出电子转移的
吸收 HCl 气体
浓硫酸
干燥气体
方向和数目_________________________________________。
(2)B 处盛有饱和食盐水(或水),其作用是_____________。
(3)C 处盛放的试剂为_______(填名称),其作用是________。
(4)E 处盛有__________(填名称),发生反应的离子方程式
为__________________________________。
D
(5)实验结束时,应先熄灭_____处酒精灯。
氢氧化钠
2OH-+Cl2===Cl-+ClO-+H2O
例 4.下列各组气体在常温下能共存且能用向上排空气法收
集的是(
)。
D
A.NO 和 O2
C.H2 和 CO
B.HCl 和 NH3
D.SO2 和 CO2
解析:A 和 B 选项中的两组气体常温下会发生反应,不能
共存;C 选项中的 H2 用向下排空气法收集,而 CO 一般用排水
法收集;D 选项中的 SO2 和 CO2 常温下不发生反应,而且两者
的密度均比空气大,都可以用向上排空气法收集。
1.实验室用 MnO2 和浓盐酸制取纯净的氯气时,气体通过两
个洗气瓶,第二个洗气瓶应盛(
)。
A.稀盐酸
B
B.浓硫酸
C.水
D.饱和食盐水
解析:由于氯气中的杂质气体是 HCl 和水蒸气,首先要除
去 HCl,用饱和食盐水,然后用浓硫酸除去水蒸气。
2.(双选)已知在实验室用 KMnO4 和浓盐酸制取 Cl2 无需加
热,则下列说法正确的是(
)。
BD
A.Cl2 是还原产物
B.KMnO4 氧化性强于 MnO2
C.氧化产物与还原产物物质的量之比为 1∶8
是 10 mol
D.若2 mol KMnO4参加反应,则Cl-失去电子的物质的量
3.从氧化还原反应的角度看,在实验室制取①H2、②CO2、
③Cl2 三种气体的反应中,盐酸的作用(
)。
A
A.①②③互不相同
B.在①和②中相同
C.在②和③中相同
D.在①②③中均相同
解析:制取H2 时盐酸的作用是酸性和氧化性;制取CO2
时盐酸的作用只是酸性;制取Cl2 时,盐酸的作用是酸性和还
原性。
4.用排气法收集下列气体时,如何确定集气瓶内的气体已
收集满?请写出简单的操作步骤、现象及结论。
(1)O2:________________________________________
证明氧气已集满
(2)Cl2:___________________________________________
(3)HCl:_________________________________________
(4)NH3:________________________________________
将带火星的木条伸到集气瓶口,木条复燃,
_____________;
蓝,证明氯气已集满
将湿润的淀粉碘化钾试纸置于瓶口,试纸变
_________________;
红,证明氯化氢气体已集满
将湿润的蓝色石蕊试纸置于瓶口,试纸变
______________________;
蓝,证明氨气已集满
将湿润的红色石蕊试纸置于瓶口,试纸变
_________________。
