第3章 第3节 2 乙酸 酯和油脂
图片预览








文档简介
(共26张PPT)
2
乙酸
酯和油脂
1.乙酸的物理性质
刺激性气味
无色液体
乙酸是食醋的主要成分,俗称醋酸,食醋中一般含 3%~5%(质
量分数)的乙酸。乙酸是一种具有强烈____________的_________,
沸点为 117.9 ℃,熔点为 16.6 ℃;当温度低于 16.6 ℃时,乙酸就
凝结成像冰一样的晶体,所以无水乙酸又称_______。
冰醋酸
乙酸的分子式为_______,结构式为
简式为_____________________。
,结构
乙酸分子中含有__________________原子团,这个原子团
称为羧基。
C2H4O2
2.乙酸的分子结构
或 CH3COOH
(—COOH)
3.乙酸的化学性质
(1)具有酸的通性
乙酸是一种一元弱酸,在水溶液中不能完全电离,其电离
方程式可表示为_______________________________。
①与指示剂反应,能_______________________。
②与活泼金属(金属活动性顺序表中排在氢以前的金属)反
应,生成盐和氢气:
2CH3COOH+Zn
(CH3COO)2Zn+H2↑。
③与一些金属氧化物反应,生成盐和水:
2CH3COOH+MgO
(CH3COO)2Mg+H2O。
CH3COOH CH3COO-+H+
使紫色石蕊溶液变红
④与碱反应(中和反应),生成盐和水:
2CH3COOH+Cu(OH)2
(CH3COO)2Cu+2H2O。
⑤与一些盐反应,生成新的盐和新的酸:2CH3COOH +
Na2CO3
2CH3COONa+H2O+CO2↑。
酸性强弱顺序为____________________。
用食醋浸泡有水垢〔主要成分CaCO3 和 Mg(OH)2〕的暖瓶
或水壶,可以清除其中的水垢。这是利用了醋酸的什么性质?
用化学方程式表示。
乙酸>碳酸>水>乙醇
答案:CaCO3+2CH3COOH==(CH3COO)2Ca+H2O+CO2↑
Mg(OH)2+2CH3COOH==(CH3COO)2Mg+2H2O
(2)乙酸的酯化反应
生成乙酸乙酯的化学反应方程式为_______________________
_______________________________,反应类型为____反应。
乙酸乙酯是一种____色透明、有______的油状液体。醇跟
羧酸生成________的反应叫做酯化反应,是______反应。
无
香味
酯和水
可逆
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
取代
4.酯
(1)酯的存在及物理性质
①存在:酯广泛存在于自然界中,植物果实特别是水果中
存在一定量的酯;另外,粮食酒中也含有少量酯。
②物理性质:酯的密度一般比水____,难溶于___,易溶于
乙醇和乙醚等有机溶剂,熔点都_______。相对分子质量较小的
低级酯是具有芳香气味的液体。
小
水
比较低
(2)化学性质(以乙酸乙酯为例)
①中性条件下,酯几乎______。
不水解
H+
CH3COOCH2CH3+H2O
H+
△
______________________
+H2O
△
____________________。
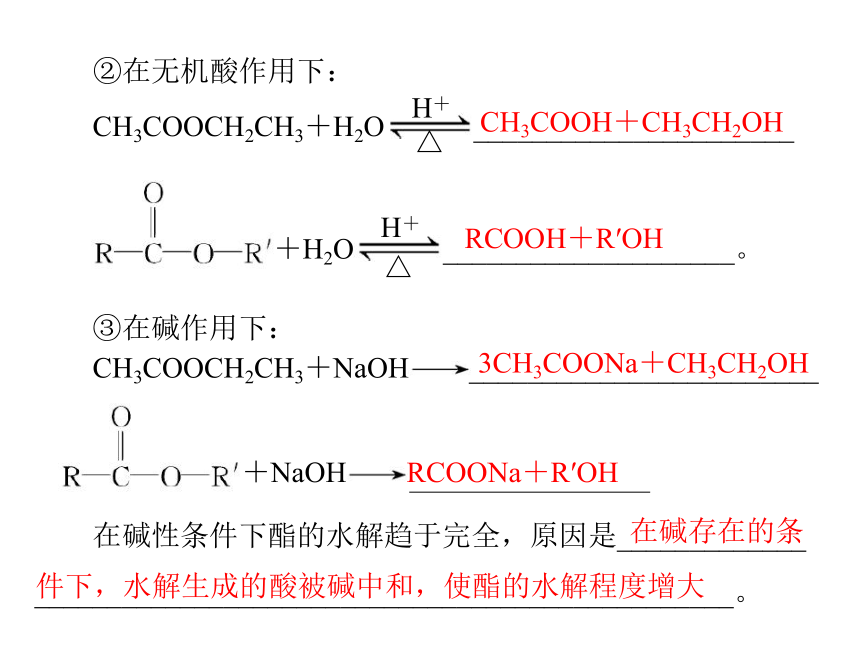
③在碱作用下:
RCOOH+R′OH
CH3COOCH2CH3+NaOH
________________________
+NaOH
RCOONa+R′OH
在碱性条件下酯的水解趋于完全,原因是_____________
________________________________________________。
CH3COOH+CH3CH2OH
3CH3COONa+CH3CH2OH
在碱存在的条
件下,水解生成的酸被碱中和,使酯的水解程度增大
②在无机酸作用下:
酯化反应 中和反应
反应历程 酸脱_______,醇脱____,
二者结合生成____ 酸中_____与碱中_____
结合成____
反应实质 分子间反应 离子反应
反应速率 _____ _____
反应程度 可逆反应 可进行到底的反应
是否需催
化剂 用浓硫酸作______ 不需要
④乙酸与碱反应生成盐和水, 是酸碱中和反应,乙酸和醇
反应生成酯和水,是酯化反应。请填空说明中和反应与酯化反
应的区别:
—OH
—H
H+
OH-
水
缓慢
迅速
催化剂
水
为什么在酯的水解反应、羧酸跟醇的酯化反应中,都可用
硫酸作催化剂?这里有什么不同之处?
答案:在酯化反应和酯的水解反应中,所用硫酸的浓度是
不同的。在酯化反应中,除利用硫酸的催化作用外,还利用它
的吸水性,以减少酯化反应生成的水,促使可逆反应主要向着
酯化反应方向进行,提高醇和羧酸的转化率(也是酯的产率),
故要选用浓硫酸,且用量较大;在酯的水解反应中,只利用硫
酸的催化作用,故要选用稀硫酸,且用量较小。
5.油脂
植物油
动物脂肪
C17H35COOH
甘油
油脂是一类特殊的酯,是______和_________的总称。油脂
可以看作是高级脂肪酸 (如硬脂酸 ____________ 、 软 脂 酸
_____________等)与_____经酯化反应生成的。
C15H31COOH
(1)组成:油脂是由多种___________(如硬脂酸、软脂酸或
油酸等)跟_____发生酯化反应生成的_____酯。
高级脂肪酸
(2)化学性质:
甘油
水解
油脂在适当的条件下能发生______反应,生成相应的高级
脂肪酸和甘油。工业上根据这一原理,利用油脂为原料来制取
_____________和_____。
高级脂肪酸
甘油
甘油
(3)油脂的用途:
①食品工业的香味添加剂。
②油脂在小肠内受酶的催化作用而水解,生成的高级脂肪
酸和甘油作为人体的营养成分为肠壁所吸收,同时提供人体活
动所需要的能量。
③油脂还可用于工业生产高级脂肪酸、肥皂、甘油、油漆
等。
1.乙酸与乙醇的酯化反应实验
在一试管中加入 3 mL 乙醇和 2 mL 乙酸的混合物,然后一
边摇动试管一边慢慢加入 2 mL 浓硫酸,加入 2~3 块碎瓷片。
按下图所示,连接好装置。用酒精灯小心均匀地加热试管 3~
5 min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上,在液
面上可以看到有透明的油状液体产生,并可闻到香味。
这种有香味的无色透明油状液体就是乙酸乙酯。反应的化
学方程式可以表示如下:
+H—O—C2H5
+
H2O
说明:①实验现象:碳酸钠溶液的液面上有透明的油状液
体产生,并可闻到香味。②饱和碳酸钠溶液的作用:中和挥发
出来的乙酸,生成乙酸钠(便于闻乙酸乙酯的香味);溶解挥发
出来的乙醇;降低乙酸乙酯在水中的溶解度,利于分层,所以
反应完毕后振荡试管,油层会变薄。③浓硫酸的作用:作催化
剂、吸水剂。该反应是可逆反应,水被浓硫酸吸收可以促进反
应向生成乙酸乙酯的方向进行。④导气管不能伸入碳酸钠溶液
中,是为了防止试管受热不均匀造成碳酸钠溶液倒吸。⑤在加
入药品时先加乙醇和乙酸,然后再加浓硫酸。若先加入浓硫酸
再加其他物质,由于浓硫酸溶于乙醇或乙酸时都会放出大量的
热,使液体发生飞溅。⑥大试管内反应混合液体积不超过试管
容积的 1/3。⑦加入碎瓷片的目的是防止暴沸。⑧试管倾斜 45°
使试管受热面积较大,弯导管起到导气兼冷凝的作用。⑨小火
加热的目的是防止液体剧烈沸腾,减少乙醇、乙酸因挥发而造
成的损失,防止高温时发生碳化和其他副反应。
①酸(羧酸或无机含氧酸)跟醇作用,生成酯和水的反应,
叫做酯化反应。
②酯化反应的一般历程是羧酸分子中羧基上的羟基跟醇分
子中羟基上的氢原子结合生成水,其余部分相互结合成酯,即
酸脱羟基醇脱氢。
③研究有机反应的历程通常采用示踪原子法。
④酯化反应属于取代反应的范畴。
2.乙醇、乙酸与乙酸乙酯分子在参加化学反应时的断键的
归纳
(1)跟活泼的金属反应,乙醇断键①,乙酸断键⑥。
(2)乙醇跟乙酸发生酯化反应,乙醇断键①,乙酸断键⑤。
(3)乙醇发生催化氧化反应,断键①和③。
(4)乙酸参与复分解反应,断键⑥。
(5)乙酸乙酯水解,断键⑦。“生亦⑦,亡亦⑦”,即生成
酯时新形成的键是⑦,酯水解时,断裂的键也是⑦。
例1.酯是重要的有机合成中间体,广泛用作溶剂、增塑剂、
香料、黏合剂及应用于印刷、纺织等工业。乙酸乙酯的实验室
和工业制法常采用如下反应:CH3COOH +C2H5OH
浓硫酸
△
CH3COOC2H5+H2O,请根据要求回答下列问题:
(1)欲增大生成乙酸乙酯的速率,可采取的措施有________
______、_________________等。
(2)若用下图所示装置来制备少量的乙酸乙酯,产率往往偏
低,其原因可能为______________________、_______________、
___________________________________等。
(3)此反应中浓硫酸除了作催化剂,还作________。
解析:(1)加快化学反应速率的措施有增大反应物浓度,升高
温度,选择合适的催化剂,增加反应物的接触面积,对于气体反
应物而言,还可以增大体系压强。本题中已选择了合适的催化剂,
又是溶液反应,所以要加快化学反应速率,可以采用增大反应物
浓度和适当升高反应温度的措施。(2)乙醇与乙酸制乙酸乙酯的反
应是可逆反应,产率低的原因有可能是反应物被蒸出,来不及反
应;温度过高,发生了副反应;乙酸乙酯容易挥发等。(3)浓硫酸
在反应中除了作催化剂外,还作吸水剂,吸收反应生成的水,提
高产率。
(2)原料来不及反应就被蒸出 温度过高,发生了副反应
冷凝效果不好,部分产物挥发了(任写两项)
(3)吸水剂
答案:(1)升高温度 增大反应物浓度
例2.已知
当
在水溶液中存在下列平衡:
与 CH3CH2OH 酯化时,不可能生成的是
(
)。
A.
C.H218O
B.
D.H2O
解析:酯化反应的断键方式是羧酸脱羟基醇脱氢生成水,
其余部分生成酯。因此,乙酸与乙醇(C2H5OH)酯化时发生如下
反应:
+ HOC2H5
+
+H2O 或
H218O
答案:A
)。
1.酯化反应属于(
A.中和反应
C.离子反应
B.取代反应
D.加成反应
解析:酯化反应是酸跟醇作用生成酯和水的反应,具体地
说是酸中的—OH 被醇中的—OR 所代替,故属于取代反应。
B
2.(双选)1 mol 的某物质与足量的金属钠反应,生成标准状
况下的氢气 22.4 L,则该物质可能是(
)。
AC
B.CH3COOH
C.HOOC—COOH
D.
3.(2011 年江西吉安检测)将乙醇 1 mol(其中羟基氧用 18O 标
记)在浓硫酸存在并加热下与足量乙酸充分反应。下列叙述正确
的是(
)。
A
A.生成的乙酸乙酯中含有 18O
B.生成的水分子中一定含有 18O
C.反应物乙酸中也可检测出 18O
D.生成了 90 g 乙酸乙酯
4.日常生活中我们经常使用热的纯碱(Na2CO3)溶液(显碱性)
洗涤炊具上的油污,请分析这利用了什么原理?
答案:炊具上的油污一般是油脂。油脂属于酯,不溶于水,
在碱性条件下水解生成易溶于水的高级脂肪酸盐和甘油。纯碱
的水溶液显碱性,并且温度升高碱性增强,有利于油脂的水解。
水解产物均易溶于水,油污也就容易被洗掉。因此用热的纯碱
溶液洗涤炊具上的油污效果较好。
2
乙酸
酯和油脂
1.乙酸的物理性质
刺激性气味
无色液体
乙酸是食醋的主要成分,俗称醋酸,食醋中一般含 3%~5%(质
量分数)的乙酸。乙酸是一种具有强烈____________的_________,
沸点为 117.9 ℃,熔点为 16.6 ℃;当温度低于 16.6 ℃时,乙酸就
凝结成像冰一样的晶体,所以无水乙酸又称_______。
冰醋酸
乙酸的分子式为_______,结构式为
简式为_____________________。
,结构
乙酸分子中含有__________________原子团,这个原子团
称为羧基。
C2H4O2
2.乙酸的分子结构
或 CH3COOH
(—COOH)
3.乙酸的化学性质
(1)具有酸的通性
乙酸是一种一元弱酸,在水溶液中不能完全电离,其电离
方程式可表示为_______________________________。
①与指示剂反应,能_______________________。
②与活泼金属(金属活动性顺序表中排在氢以前的金属)反
应,生成盐和氢气:
2CH3COOH+Zn
(CH3COO)2Zn+H2↑。
③与一些金属氧化物反应,生成盐和水:
2CH3COOH+MgO
(CH3COO)2Mg+H2O。
CH3COOH CH3COO-+H+
使紫色石蕊溶液变红
④与碱反应(中和反应),生成盐和水:
2CH3COOH+Cu(OH)2
(CH3COO)2Cu+2H2O。
⑤与一些盐反应,生成新的盐和新的酸:2CH3COOH +
Na2CO3
2CH3COONa+H2O+CO2↑。
酸性强弱顺序为____________________。
用食醋浸泡有水垢〔主要成分CaCO3 和 Mg(OH)2〕的暖瓶
或水壶,可以清除其中的水垢。这是利用了醋酸的什么性质?
用化学方程式表示。
乙酸>碳酸>水>乙醇
答案:CaCO3+2CH3COOH==(CH3COO)2Ca+H2O+CO2↑
Mg(OH)2+2CH3COOH==(CH3COO)2Mg+2H2O
(2)乙酸的酯化反应
生成乙酸乙酯的化学反应方程式为_______________________
_______________________________,反应类型为____反应。
乙酸乙酯是一种____色透明、有______的油状液体。醇跟
羧酸生成________的反应叫做酯化反应,是______反应。
无
香味
酯和水
可逆
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
取代
4.酯
(1)酯的存在及物理性质
①存在:酯广泛存在于自然界中,植物果实特别是水果中
存在一定量的酯;另外,粮食酒中也含有少量酯。
②物理性质:酯的密度一般比水____,难溶于___,易溶于
乙醇和乙醚等有机溶剂,熔点都_______。相对分子质量较小的
低级酯是具有芳香气味的液体。
小
水
比较低
(2)化学性质(以乙酸乙酯为例)
①中性条件下,酯几乎______。
不水解
H+
CH3COOCH2CH3+H2O
H+
△
______________________
+H2O
△
____________________。
③在碱作用下:
RCOOH+R′OH
CH3COOCH2CH3+NaOH
________________________
+NaOH
RCOONa+R′OH
在碱性条件下酯的水解趋于完全,原因是_____________
________________________________________________。
CH3COOH+CH3CH2OH
3CH3COONa+CH3CH2OH
在碱存在的条
件下,水解生成的酸被碱中和,使酯的水解程度增大
②在无机酸作用下:
酯化反应 中和反应
反应历程 酸脱_______,醇脱____,
二者结合生成____ 酸中_____与碱中_____
结合成____
反应实质 分子间反应 离子反应
反应速率 _____ _____
反应程度 可逆反应 可进行到底的反应
是否需催
化剂 用浓硫酸作______ 不需要
④乙酸与碱反应生成盐和水, 是酸碱中和反应,乙酸和醇
反应生成酯和水,是酯化反应。请填空说明中和反应与酯化反
应的区别:
—OH
—H
H+
OH-
水
缓慢
迅速
催化剂
水
为什么在酯的水解反应、羧酸跟醇的酯化反应中,都可用
硫酸作催化剂?这里有什么不同之处?
答案:在酯化反应和酯的水解反应中,所用硫酸的浓度是
不同的。在酯化反应中,除利用硫酸的催化作用外,还利用它
的吸水性,以减少酯化反应生成的水,促使可逆反应主要向着
酯化反应方向进行,提高醇和羧酸的转化率(也是酯的产率),
故要选用浓硫酸,且用量较大;在酯的水解反应中,只利用硫
酸的催化作用,故要选用稀硫酸,且用量较小。
5.油脂
植物油
动物脂肪
C17H35COOH
甘油
油脂是一类特殊的酯,是______和_________的总称。油脂
可以看作是高级脂肪酸 (如硬脂酸 ____________ 、 软 脂 酸
_____________等)与_____经酯化反应生成的。
C15H31COOH
(1)组成:油脂是由多种___________(如硬脂酸、软脂酸或
油酸等)跟_____发生酯化反应生成的_____酯。
高级脂肪酸
(2)化学性质:
甘油
水解
油脂在适当的条件下能发生______反应,生成相应的高级
脂肪酸和甘油。工业上根据这一原理,利用油脂为原料来制取
_____________和_____。
高级脂肪酸
甘油
甘油
(3)油脂的用途:
①食品工业的香味添加剂。
②油脂在小肠内受酶的催化作用而水解,生成的高级脂肪
酸和甘油作为人体的营养成分为肠壁所吸收,同时提供人体活
动所需要的能量。
③油脂还可用于工业生产高级脂肪酸、肥皂、甘油、油漆
等。
1.乙酸与乙醇的酯化反应实验
在一试管中加入 3 mL 乙醇和 2 mL 乙酸的混合物,然后一
边摇动试管一边慢慢加入 2 mL 浓硫酸,加入 2~3 块碎瓷片。
按下图所示,连接好装置。用酒精灯小心均匀地加热试管 3~
5 min,产生的蒸气经导管通到饱和碳酸钠溶液的液面上,在液
面上可以看到有透明的油状液体产生,并可闻到香味。
这种有香味的无色透明油状液体就是乙酸乙酯。反应的化
学方程式可以表示如下:
+H—O—C2H5
+
H2O
说明:①实验现象:碳酸钠溶液的液面上有透明的油状液
体产生,并可闻到香味。②饱和碳酸钠溶液的作用:中和挥发
出来的乙酸,生成乙酸钠(便于闻乙酸乙酯的香味);溶解挥发
出来的乙醇;降低乙酸乙酯在水中的溶解度,利于分层,所以
反应完毕后振荡试管,油层会变薄。③浓硫酸的作用:作催化
剂、吸水剂。该反应是可逆反应,水被浓硫酸吸收可以促进反
应向生成乙酸乙酯的方向进行。④导气管不能伸入碳酸钠溶液
中,是为了防止试管受热不均匀造成碳酸钠溶液倒吸。⑤在加
入药品时先加乙醇和乙酸,然后再加浓硫酸。若先加入浓硫酸
再加其他物质,由于浓硫酸溶于乙醇或乙酸时都会放出大量的
热,使液体发生飞溅。⑥大试管内反应混合液体积不超过试管
容积的 1/3。⑦加入碎瓷片的目的是防止暴沸。⑧试管倾斜 45°
使试管受热面积较大,弯导管起到导气兼冷凝的作用。⑨小火
加热的目的是防止液体剧烈沸腾,减少乙醇、乙酸因挥发而造
成的损失,防止高温时发生碳化和其他副反应。
①酸(羧酸或无机含氧酸)跟醇作用,生成酯和水的反应,
叫做酯化反应。
②酯化反应的一般历程是羧酸分子中羧基上的羟基跟醇分
子中羟基上的氢原子结合生成水,其余部分相互结合成酯,即
酸脱羟基醇脱氢。
③研究有机反应的历程通常采用示踪原子法。
④酯化反应属于取代反应的范畴。
2.乙醇、乙酸与乙酸乙酯分子在参加化学反应时的断键的
归纳
(1)跟活泼的金属反应,乙醇断键①,乙酸断键⑥。
(2)乙醇跟乙酸发生酯化反应,乙醇断键①,乙酸断键⑤。
(3)乙醇发生催化氧化反应,断键①和③。
(4)乙酸参与复分解反应,断键⑥。
(5)乙酸乙酯水解,断键⑦。“生亦⑦,亡亦⑦”,即生成
酯时新形成的键是⑦,酯水解时,断裂的键也是⑦。
例1.酯是重要的有机合成中间体,广泛用作溶剂、增塑剂、
香料、黏合剂及应用于印刷、纺织等工业。乙酸乙酯的实验室
和工业制法常采用如下反应:CH3COOH +C2H5OH
浓硫酸
△
CH3COOC2H5+H2O,请根据要求回答下列问题:
(1)欲增大生成乙酸乙酯的速率,可采取的措施有________
______、_________________等。
(2)若用下图所示装置来制备少量的乙酸乙酯,产率往往偏
低,其原因可能为______________________、_______________、
___________________________________等。
(3)此反应中浓硫酸除了作催化剂,还作________。
解析:(1)加快化学反应速率的措施有增大反应物浓度,升高
温度,选择合适的催化剂,增加反应物的接触面积,对于气体反
应物而言,还可以增大体系压强。本题中已选择了合适的催化剂,
又是溶液反应,所以要加快化学反应速率,可以采用增大反应物
浓度和适当升高反应温度的措施。(2)乙醇与乙酸制乙酸乙酯的反
应是可逆反应,产率低的原因有可能是反应物被蒸出,来不及反
应;温度过高,发生了副反应;乙酸乙酯容易挥发等。(3)浓硫酸
在反应中除了作催化剂外,还作吸水剂,吸收反应生成的水,提
高产率。
(2)原料来不及反应就被蒸出 温度过高,发生了副反应
冷凝效果不好,部分产物挥发了(任写两项)
(3)吸水剂
答案:(1)升高温度 增大反应物浓度
例2.已知
当
在水溶液中存在下列平衡:
与 CH3CH2OH 酯化时,不可能生成的是
(
)。
A.
C.H218O
B.
D.H2O
解析:酯化反应的断键方式是羧酸脱羟基醇脱氢生成水,
其余部分生成酯。因此,乙酸与乙醇(C2H5OH)酯化时发生如下
反应:
+ HOC2H5
+
+H2O 或
H218O
答案:A
)。
1.酯化反应属于(
A.中和反应
C.离子反应
B.取代反应
D.加成反应
解析:酯化反应是酸跟醇作用生成酯和水的反应,具体地
说是酸中的—OH 被醇中的—OR 所代替,故属于取代反应。
B
2.(双选)1 mol 的某物质与足量的金属钠反应,生成标准状
况下的氢气 22.4 L,则该物质可能是(
)。
AC
B.CH3COOH
C.HOOC—COOH
D.
3.(2011 年江西吉安检测)将乙醇 1 mol(其中羟基氧用 18O 标
记)在浓硫酸存在并加热下与足量乙酸充分反应。下列叙述正确
的是(
)。
A
A.生成的乙酸乙酯中含有 18O
B.生成的水分子中一定含有 18O
C.反应物乙酸中也可检测出 18O
D.生成了 90 g 乙酸乙酯
4.日常生活中我们经常使用热的纯碱(Na2CO3)溶液(显碱性)
洗涤炊具上的油污,请分析这利用了什么原理?
答案:炊具上的油污一般是油脂。油脂属于酯,不溶于水,
在碱性条件下水解生成易溶于水的高级脂肪酸盐和甘油。纯碱
的水溶液显碱性,并且温度升高碱性增强,有利于油脂的水解。
水解产物均易溶于水,油污也就容易被洗掉。因此用热的纯碱
溶液洗涤炊具上的油污效果较好。
