6.3物质的溶解性(第2课时物质溶解性的定量表示 )同步练习--2020-2021学年九年级化学沪教版(全国)下册(含解析)
文档属性
| 名称 | 6.3物质的溶解性(第2课时物质溶解性的定量表示 )同步练习--2020-2021学年九年级化学沪教版(全国)下册(含解析) |

|
|
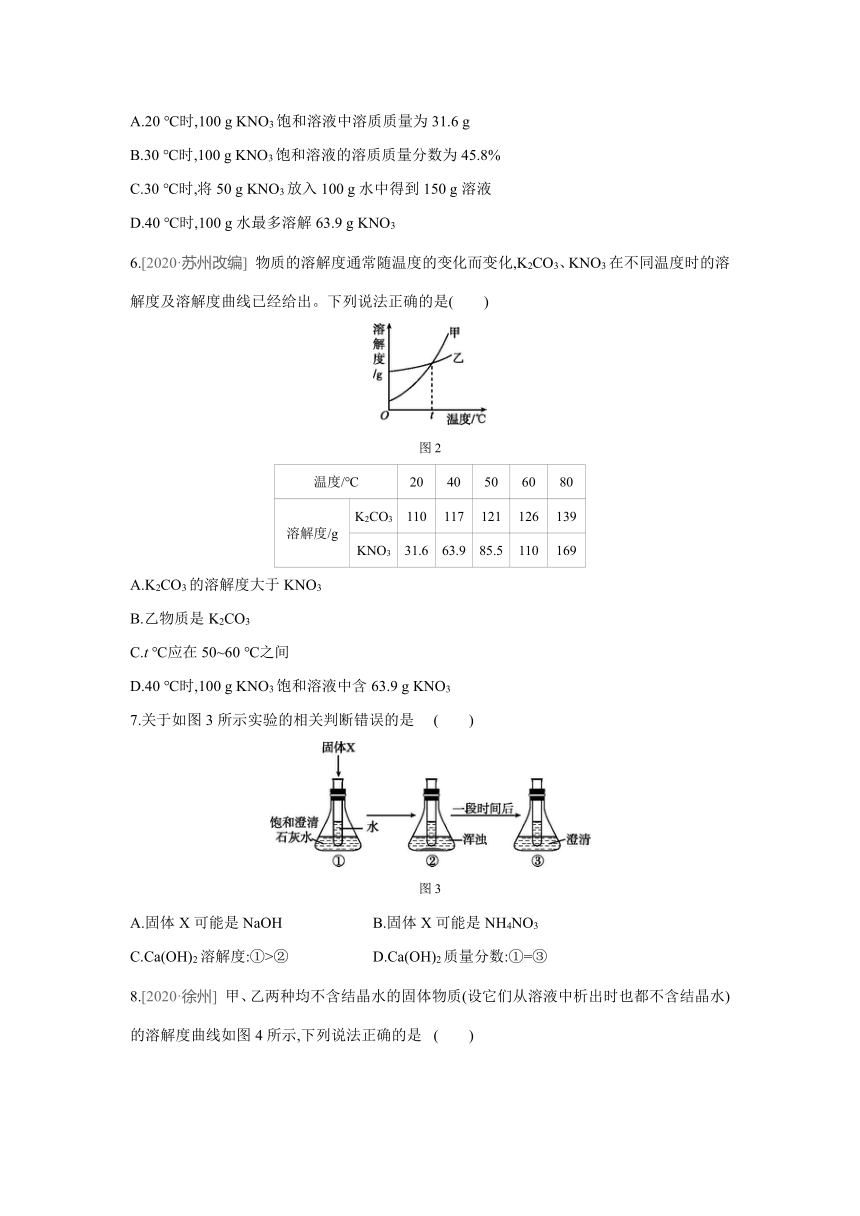
| 格式 | docx | ||
| 文件大小 | 183.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 00:00:00 | ||
图片预览

文档简介
第6章 第3节 第2课时 物质溶解性的定量表示
一、选择题
1.下列措施能使硝酸钾在水中的溶解度增大的是 ( )
A.增加水的质量 B.把硝酸钾粉碎,在溶解过程中不断地搅拌
C.增加硝酸钾的质量 D.使溶液的温度升高
2.[2020·张家界] 在20 ℃时,将40 g氯化钠固体加入100 g水中,充分搅拌后,有4 g固体未溶解。下列说法正确的是 ( )
A.20 ℃时,氯化钠的溶解度为36 g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140 g
D.将该溶液倒出一半,则溶质的质量分数改变
3.下列关于物质的溶解度的说法中,你认为正确的是 ( )
A.t1 ℃时,10 g硝酸钾可溶解在100 g水里,所以t1 ℃时硝酸钾的溶解度为10 g
B.t1 ℃时,10 g硝酸钾可溶解在水里配成饱和溶液,所以t1 ℃时硝酸钾的溶解度为10 g
C.把36 g氯化钠溶解在100 g水里,恰好配成饱和溶液,所以氯化钠的溶解度是36 g
D.t2 ℃时,36 g氯化钠溶解在100 g水里,恰好配成饱和溶液,则t2 ℃时氯化钠的溶解度为36 g
4.[2020·百色] 甲、乙两种固体物质的溶解度曲线如图1所示。下列叙述正确的是 ( )
图1
A.甲和乙的溶解度相等
B.t2 ℃时,甲物质的溶解度为40
C.用降温的方法一定能使甲的不饱和溶液变成饱和溶液
D.t2 ℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量
5.[2020·北京] 不同温度下KNO3的溶解度如下表所示。下列说法正确的是 ( )
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20 ℃时,100 g KNO3饱和溶液中溶质质量为31.6 g
B.30 ℃时,100 g KNO3饱和溶液的溶质质量分数为45.8%
C.30 ℃时,将50 g KNO3放入100 g水中得到150 g溶液
D.40 ℃时,100 g水最多溶解63.9 g KNO3
6.[2020·苏州改编] 物质的溶解度通常随温度的变化而变化,K2CO3、KNO3在不同温度时的溶解度及溶解度曲线已经给出。下列说法正确的是( )
图2
温度/℃ 20 40 50 60 80
溶解度/g K2CO3 110 117 121 126 139
KNO3 31.6 63.9 85.5 110 169
A.K2CO3的溶解度大于KNO3
B.乙物质是K2CO3
C.t ℃应在50~60 ℃之间
D.40 ℃时,100 g KNO3饱和溶液中含63.9 g KNO3
7.关于如图3所示实验的相关判断错误的是 ( )
图3
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
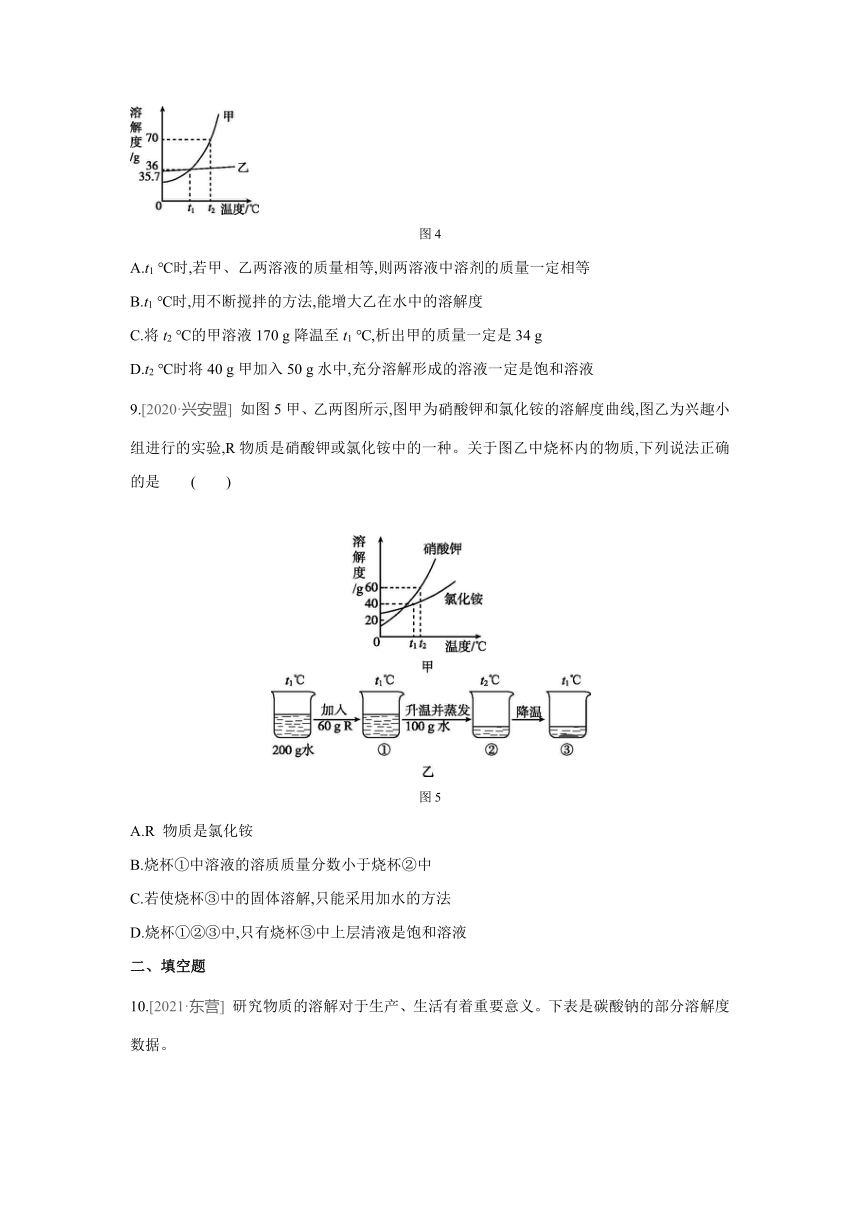
8.[2020·徐州] 甲、乙两种均不含结晶水的固体物质(设它们从溶液中析出时也都不含结晶水)的溶解度曲线如图4所示,下列说法正确的是 ( )
图4
A.t1 ℃时,若甲、乙两溶液的质量相等,则两溶液中溶剂的质量一定相等
B.t1 ℃时,用不断搅拌的方法,能增大乙在水中的溶解度
C.将t2 ℃的甲溶液170 g降温至t1 ℃,析出甲的质量一定是34 g
D.t2 ℃时将40 g甲加入50 g水中,充分溶解形成的溶液一定是饱和溶液
9.[2020·兴安盟] 如图5甲、乙两图所示,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。关于图乙中烧杯内的物质,下列说法正确的是 ( )
图5
A.R 物质是氯化铵
B.烧杯①中溶液的溶质质量分数小于烧杯②中
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
二、填空题
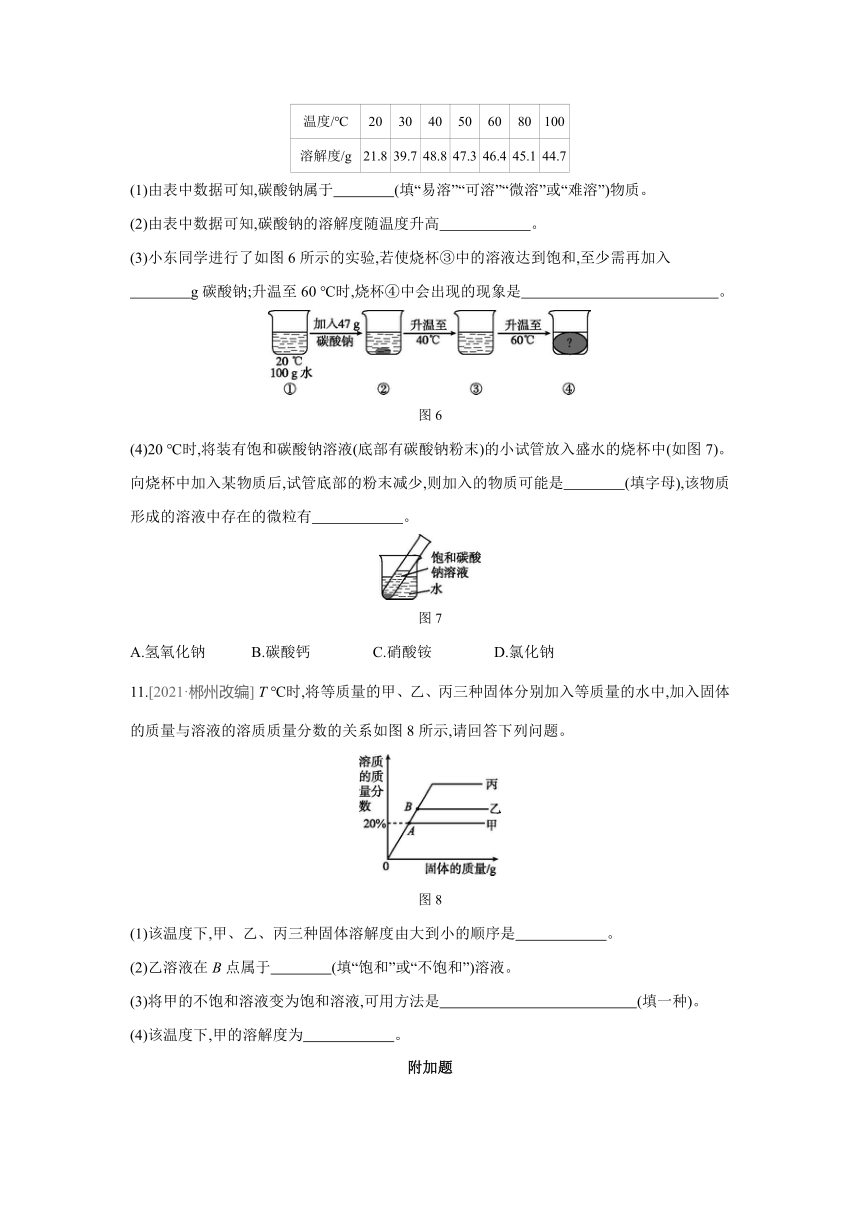
10.[2021·东营] 研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
(1)由表中数据可知,碳酸钠属于 (填“易溶”“可溶”“微溶”或“难溶”)物质。
(2)由表中数据可知,碳酸钠的溶解度随温度升高 。
(3)小东同学进行了如图6所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入
g碳酸钠;升温至60 ℃时,烧杯④中会出现的现象是 。
图6
(4)20 ℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中(如图7)。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是 (填字母),该物质形成的溶液中存在的微粒有 。
图7
A.氢氧化钠 B.碳酸钙 C.硝酸铵 D.氯化钠
11.[2021·郴州改编] T ℃时,将等质量的甲、乙、丙三种固体分别加入等质量的水中,加入固体的质量与溶液的溶质质量分数的关系如图8所示,请回答下列问题。
图8
(1)该温度下,甲、乙、丙三种固体溶解度由大到小的顺序是 。
(2)乙溶液在B点属于 (填“饱和”或“不饱和”)溶液。
(3)将甲的不饱和溶液变为饱和溶液,可用方法是 (填一种)。
(4)该温度下,甲的溶解度为 。
附加题
12.[2020·郴州] t ℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量之间的关系如图9所示。请回答下列问题。
图9
(1)蒸发溶剂前, (填“甲”或“乙”)是饱和溶液。
(2)b点对应的乙溶液是 (填“饱和溶液”或“不饱和溶液”)。
(3)t ℃时, (填“甲”或“乙”)的溶解度更大。
(4)甲的饱和溶液的质量分数是 (用含m、n的代数式表示)。
答案
1.D [解析] 抓住影响固体物质溶解度大小的三个因素就能正确解答此题。固体物质溶解度的大小与温度、溶质和溶剂的种类(性质)有关,与溶质和溶剂的质量及物质的溶解速率无关。
2.A [解析] 根据题意可知,在20 ℃时,100 g水中最多能溶解氯化钠固体40 g-4 g=36 g,溶液达到饱和状态,则20 ℃时,氯化钠的溶解度为36 g;该溶液是氯化钠的饱和溶液,还能继续溶解硝酸钾固体;所得氯化钠溶液的质量为40 g-4 g+100 g=136 g;溶液具有均一性,将该溶液倒出一半,溶质的质量分数是不变的。
3.D [解析] 在描述某一物质的溶解度时必须指明温度、溶液的饱和程度、溶剂的质量。
4.D [解析] 没有指明温度,无法比较甲和乙的溶解度;溶解度的单位是g;不确定原来温度下溶液中溶质的质量分数和所降的温度,无法判断降温后溶液是否能转化为饱和溶液;t2 ℃时,乙的溶解度比甲小,所以用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量。
5.D [解析] 20 ℃时,KNO3的溶解度为31.6 g,含义是20 ℃时,100 g水中最多能溶解KNO3 31.6 g,则20 ℃时,131.6 g KNO3饱和溶液中溶质质量为31.6 g;30 ℃时,100 g KNO3饱和溶液的溶质质量分数为×100%<45.8%;30 ℃时,KNO3的溶解度为45.8 g,则30 ℃时,将50 g KNO3放入100 g水中,最多溶解45.8 g,得到45.8 g+100 g=145.8 g溶液;40 ℃时,KNO3的溶解度为63.9 g,即40 ℃时,100 g水最多溶解63.9 g KNO3。
6.B [解析] 不指明温度,无法比较两种物质的溶解度大小;乙物质的溶解度受温度变化的影响小,结合表格中数值,可得知乙物质是碳酸钾;50~60 ℃时硝酸钾的溶解度始终小于碳酸钾的溶解度,两者的溶解度曲线没有交点,t ℃应在60~80 ℃之间;40 ℃时硝酸钾的溶解度是63.9 g,则40 ℃时,163.9 g硝酸钾饱和溶液中含有63.9 g硝酸钾。
7.B [解析] 氢氧化钙的溶解度随着温度的升高而减小,加入X后,溶液变浑浊,是因为温度升高,氢氧化钙的溶解度减小,有氢氧化钙析出,固体X可能是NaOH;硝酸铵溶于水吸热,使温度降低,不可能有氢氧化钙析出;由图示可知,①中溶解的氢氧化钙多,则Ca(OH)2溶解度:①>②;①和③中溶质和溶剂的质量均相等,故Ca(OH)2质量分数:①=③。
8.D [解析] t1 ℃时,甲、乙两溶液的质量相等,但两溶液中溶剂的质量不一定相等,因为不知道溶液是否饱和;搅拌能够加快物质的溶解速率,不能改变溶解度;将t2 ℃的甲溶液170 g降温至t1 ℃,析出甲的质量不一定是34 g,因为不知道t2 ℃时甲溶液是否饱和;t2 ℃时甲溶解度是70 g,将40 g甲加入50 g水中,能够溶解35 g甲,形成的溶液一定是饱和溶液。
9.B [解析] 升温到t2 ℃并且蒸发100 g水,烧杯中没有析出固体,说明t2 ℃时该物质的溶解度大于或等于60 g,由图甲信息可知,t2 ℃时硝酸钾溶解度是60 g,氯化铵的溶解度小于60 g,所以烧杯内的R物质是硝酸钾;烧杯①中的质量分数为×100%=23.1%,烧杯②中的质量分数为×100%=37.5%,所以溶液的溶质质量分数是烧杯①小于烧杯②;若使烧杯③中的固体溶解,采用加水、升温的方法都可以;t2 ℃时,硝酸钾的溶解度是60 g,烧杯②中溶液、烧杯③中上层清液都是饱和溶液。
10.(1)易溶
(2)先增大后减小
(3)1.8 有固体析出(合理即可)
(4)A Na+、OH-、H2O
[解析] (1)20 ℃时,碳酸钠的溶解度大于10 g,为易溶物质。(2)据表分析,随着温度升高,碳酸钠的溶解度越大,但温度高于40 ℃后,随着温度升高,碳酸钠的溶解度减小,所以随着温度升高,碳酸钠的溶解度先增大后减小。(3)烧杯③中温度为40 ℃,据表可知,此时碳酸钠的溶解度为48.8 g,若使溶液达到饱和,应加入(48.8-47) g=1.8 g固体;温度升高到60 ℃,碳酸钠的溶解度为46.4 g,小于47 g,有固体析出。(4)由题意可知,当加入某种物质后,固体减少,说明溶解度增大,因原温度为20 ℃,故水的温度应该升高,氢氧化钠溶于水放热,会使溶液温度升高。
11.(1)丙>乙>甲 (2)饱和
(3)加入甲物质(或蒸发溶剂)
(4)25 g
[解析] (1)甲、乙、丙的饱和溶液中,溶质质量分数的大小关系是丙>乙>甲;饱和溶液中溶质的质量分数=×100%,则该温度下,甲、乙、丙的溶解度大小顺序是丙>乙>甲。(2)乙溶液在B点,溶质质量分数达到最大,则乙溶液在B点属于饱和溶液。(4)甲的饱和溶液中溶质质量分数为20%,设该温度下甲的溶解度为x,则×100%=20%,x=25g。
12.(1)甲 (2)饱和溶液
(3)乙 (4)%
[解析] (1)甲溶液开始蒸发溶剂即有固体析出,说明甲是饱和溶液。(2)有固体析出,说明b点对应的乙溶液是饱和溶液。(3)t ℃时,蒸发相同质量的溶剂,乙析出的溶质多,说明乙的溶解度更大。(4)甲的饱和溶液的质量分数为×100%=%。
一、选择题
1.下列措施能使硝酸钾在水中的溶解度增大的是 ( )
A.增加水的质量 B.把硝酸钾粉碎,在溶解过程中不断地搅拌
C.增加硝酸钾的质量 D.使溶液的温度升高
2.[2020·张家界] 在20 ℃时,将40 g氯化钠固体加入100 g水中,充分搅拌后,有4 g固体未溶解。下列说法正确的是 ( )
A.20 ℃时,氯化钠的溶解度为36 g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140 g
D.将该溶液倒出一半,则溶质的质量分数改变
3.下列关于物质的溶解度的说法中,你认为正确的是 ( )
A.t1 ℃时,10 g硝酸钾可溶解在100 g水里,所以t1 ℃时硝酸钾的溶解度为10 g
B.t1 ℃时,10 g硝酸钾可溶解在水里配成饱和溶液,所以t1 ℃时硝酸钾的溶解度为10 g
C.把36 g氯化钠溶解在100 g水里,恰好配成饱和溶液,所以氯化钠的溶解度是36 g
D.t2 ℃时,36 g氯化钠溶解在100 g水里,恰好配成饱和溶液,则t2 ℃时氯化钠的溶解度为36 g
4.[2020·百色] 甲、乙两种固体物质的溶解度曲线如图1所示。下列叙述正确的是 ( )
图1
A.甲和乙的溶解度相等
B.t2 ℃时,甲物质的溶解度为40
C.用降温的方法一定能使甲的不饱和溶液变成饱和溶液
D.t2 ℃时,用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量
5.[2020·北京] 不同温度下KNO3的溶解度如下表所示。下列说法正确的是 ( )
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20 ℃时,100 g KNO3饱和溶液中溶质质量为31.6 g
B.30 ℃时,100 g KNO3饱和溶液的溶质质量分数为45.8%
C.30 ℃时,将50 g KNO3放入100 g水中得到150 g溶液
D.40 ℃时,100 g水最多溶解63.9 g KNO3
6.[2020·苏州改编] 物质的溶解度通常随温度的变化而变化,K2CO3、KNO3在不同温度时的溶解度及溶解度曲线已经给出。下列说法正确的是( )
图2
温度/℃ 20 40 50 60 80
溶解度/g K2CO3 110 117 121 126 139
KNO3 31.6 63.9 85.5 110 169
A.K2CO3的溶解度大于KNO3
B.乙物质是K2CO3
C.t ℃应在50~60 ℃之间
D.40 ℃时,100 g KNO3饱和溶液中含63.9 g KNO3
7.关于如图3所示实验的相关判断错误的是 ( )
图3
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
8.[2020·徐州] 甲、乙两种均不含结晶水的固体物质(设它们从溶液中析出时也都不含结晶水)的溶解度曲线如图4所示,下列说法正确的是 ( )
图4
A.t1 ℃时,若甲、乙两溶液的质量相等,则两溶液中溶剂的质量一定相等
B.t1 ℃时,用不断搅拌的方法,能增大乙在水中的溶解度
C.将t2 ℃的甲溶液170 g降温至t1 ℃,析出甲的质量一定是34 g
D.t2 ℃时将40 g甲加入50 g水中,充分溶解形成的溶液一定是饱和溶液
9.[2020·兴安盟] 如图5甲、乙两图所示,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。关于图乙中烧杯内的物质,下列说法正确的是 ( )
图5
A.R 物质是氯化铵
B.烧杯①中溶液的溶质质量分数小于烧杯②中
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
二、填空题
10.[2021·东营] 研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
(1)由表中数据可知,碳酸钠属于 (填“易溶”“可溶”“微溶”或“难溶”)物质。
(2)由表中数据可知,碳酸钠的溶解度随温度升高 。
(3)小东同学进行了如图6所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入
g碳酸钠;升温至60 ℃时,烧杯④中会出现的现象是 。
图6
(4)20 ℃时,将装有饱和碳酸钠溶液(底部有碳酸钠粉末)的小试管放入盛水的烧杯中(如图7)。向烧杯中加入某物质后,试管底部的粉末减少,则加入的物质可能是 (填字母),该物质形成的溶液中存在的微粒有 。
图7
A.氢氧化钠 B.碳酸钙 C.硝酸铵 D.氯化钠
11.[2021·郴州改编] T ℃时,将等质量的甲、乙、丙三种固体分别加入等质量的水中,加入固体的质量与溶液的溶质质量分数的关系如图8所示,请回答下列问题。
图8
(1)该温度下,甲、乙、丙三种固体溶解度由大到小的顺序是 。
(2)乙溶液在B点属于 (填“饱和”或“不饱和”)溶液。
(3)将甲的不饱和溶液变为饱和溶液,可用方法是 (填一种)。
(4)该温度下,甲的溶解度为 。
附加题
12.[2020·郴州] t ℃时,将一定质量的甲、乙两种溶液进行恒温蒸发,蒸发溶剂的质量与析出晶体的质量之间的关系如图9所示。请回答下列问题。
图9
(1)蒸发溶剂前, (填“甲”或“乙”)是饱和溶液。
(2)b点对应的乙溶液是 (填“饱和溶液”或“不饱和溶液”)。
(3)t ℃时, (填“甲”或“乙”)的溶解度更大。
(4)甲的饱和溶液的质量分数是 (用含m、n的代数式表示)。
答案
1.D [解析] 抓住影响固体物质溶解度大小的三个因素就能正确解答此题。固体物质溶解度的大小与温度、溶质和溶剂的种类(性质)有关,与溶质和溶剂的质量及物质的溶解速率无关。
2.A [解析] 根据题意可知,在20 ℃时,100 g水中最多能溶解氯化钠固体40 g-4 g=36 g,溶液达到饱和状态,则20 ℃时,氯化钠的溶解度为36 g;该溶液是氯化钠的饱和溶液,还能继续溶解硝酸钾固体;所得氯化钠溶液的质量为40 g-4 g+100 g=136 g;溶液具有均一性,将该溶液倒出一半,溶质的质量分数是不变的。
3.D [解析] 在描述某一物质的溶解度时必须指明温度、溶液的饱和程度、溶剂的质量。
4.D [解析] 没有指明温度,无法比较甲和乙的溶解度;溶解度的单位是g;不确定原来温度下溶液中溶质的质量分数和所降的温度,无法判断降温后溶液是否能转化为饱和溶液;t2 ℃时,乙的溶解度比甲小,所以用等质量的甲和乙固体溶于水配制饱和溶液,得到乙溶液的质量大于甲溶液的质量。
5.D [解析] 20 ℃时,KNO3的溶解度为31.6 g,含义是20 ℃时,100 g水中最多能溶解KNO3 31.6 g,则20 ℃时,131.6 g KNO3饱和溶液中溶质质量为31.6 g;30 ℃时,100 g KNO3饱和溶液的溶质质量分数为×100%<45.8%;30 ℃时,KNO3的溶解度为45.8 g,则30 ℃时,将50 g KNO3放入100 g水中,最多溶解45.8 g,得到45.8 g+100 g=145.8 g溶液;40 ℃时,KNO3的溶解度为63.9 g,即40 ℃时,100 g水最多溶解63.9 g KNO3。
6.B [解析] 不指明温度,无法比较两种物质的溶解度大小;乙物质的溶解度受温度变化的影响小,结合表格中数值,可得知乙物质是碳酸钾;50~60 ℃时硝酸钾的溶解度始终小于碳酸钾的溶解度,两者的溶解度曲线没有交点,t ℃应在60~80 ℃之间;40 ℃时硝酸钾的溶解度是63.9 g,则40 ℃时,163.9 g硝酸钾饱和溶液中含有63.9 g硝酸钾。
7.B [解析] 氢氧化钙的溶解度随着温度的升高而减小,加入X后,溶液变浑浊,是因为温度升高,氢氧化钙的溶解度减小,有氢氧化钙析出,固体X可能是NaOH;硝酸铵溶于水吸热,使温度降低,不可能有氢氧化钙析出;由图示可知,①中溶解的氢氧化钙多,则Ca(OH)2溶解度:①>②;①和③中溶质和溶剂的质量均相等,故Ca(OH)2质量分数:①=③。
8.D [解析] t1 ℃时,甲、乙两溶液的质量相等,但两溶液中溶剂的质量不一定相等,因为不知道溶液是否饱和;搅拌能够加快物质的溶解速率,不能改变溶解度;将t2 ℃的甲溶液170 g降温至t1 ℃,析出甲的质量不一定是34 g,因为不知道t2 ℃时甲溶液是否饱和;t2 ℃时甲溶解度是70 g,将40 g甲加入50 g水中,能够溶解35 g甲,形成的溶液一定是饱和溶液。
9.B [解析] 升温到t2 ℃并且蒸发100 g水,烧杯中没有析出固体,说明t2 ℃时该物质的溶解度大于或等于60 g,由图甲信息可知,t2 ℃时硝酸钾溶解度是60 g,氯化铵的溶解度小于60 g,所以烧杯内的R物质是硝酸钾;烧杯①中的质量分数为×100%=23.1%,烧杯②中的质量分数为×100%=37.5%,所以溶液的溶质质量分数是烧杯①小于烧杯②;若使烧杯③中的固体溶解,采用加水、升温的方法都可以;t2 ℃时,硝酸钾的溶解度是60 g,烧杯②中溶液、烧杯③中上层清液都是饱和溶液。
10.(1)易溶
(2)先增大后减小
(3)1.8 有固体析出(合理即可)
(4)A Na+、OH-、H2O
[解析] (1)20 ℃时,碳酸钠的溶解度大于10 g,为易溶物质。(2)据表分析,随着温度升高,碳酸钠的溶解度越大,但温度高于40 ℃后,随着温度升高,碳酸钠的溶解度减小,所以随着温度升高,碳酸钠的溶解度先增大后减小。(3)烧杯③中温度为40 ℃,据表可知,此时碳酸钠的溶解度为48.8 g,若使溶液达到饱和,应加入(48.8-47) g=1.8 g固体;温度升高到60 ℃,碳酸钠的溶解度为46.4 g,小于47 g,有固体析出。(4)由题意可知,当加入某种物质后,固体减少,说明溶解度增大,因原温度为20 ℃,故水的温度应该升高,氢氧化钠溶于水放热,会使溶液温度升高。
11.(1)丙>乙>甲 (2)饱和
(3)加入甲物质(或蒸发溶剂)
(4)25 g
[解析] (1)甲、乙、丙的饱和溶液中,溶质质量分数的大小关系是丙>乙>甲;饱和溶液中溶质的质量分数=×100%,则该温度下,甲、乙、丙的溶解度大小顺序是丙>乙>甲。(2)乙溶液在B点,溶质质量分数达到最大,则乙溶液在B点属于饱和溶液。(4)甲的饱和溶液中溶质质量分数为20%,设该温度下甲的溶解度为x,则×100%=20%,x=25g。
12.(1)甲 (2)饱和溶液
(3)乙 (4)%
[解析] (1)甲溶液开始蒸发溶剂即有固体析出,说明甲是饱和溶液。(2)有固体析出,说明b点对应的乙溶液是饱和溶液。(3)t ℃时,蒸发相同质量的溶剂,乙析出的溶质多,说明乙的溶解度更大。(4)甲的饱和溶液的质量分数为×100%=%。
