7.2常见的酸和碱(第2课时)同步练习-2020-2021学年九年级化学沪教版下册(word版 含解析)
文档属性
| 名称 | 7.2常见的酸和碱(第2课时)同步练习-2020-2021学年九年级化学沪教版下册(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 176.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
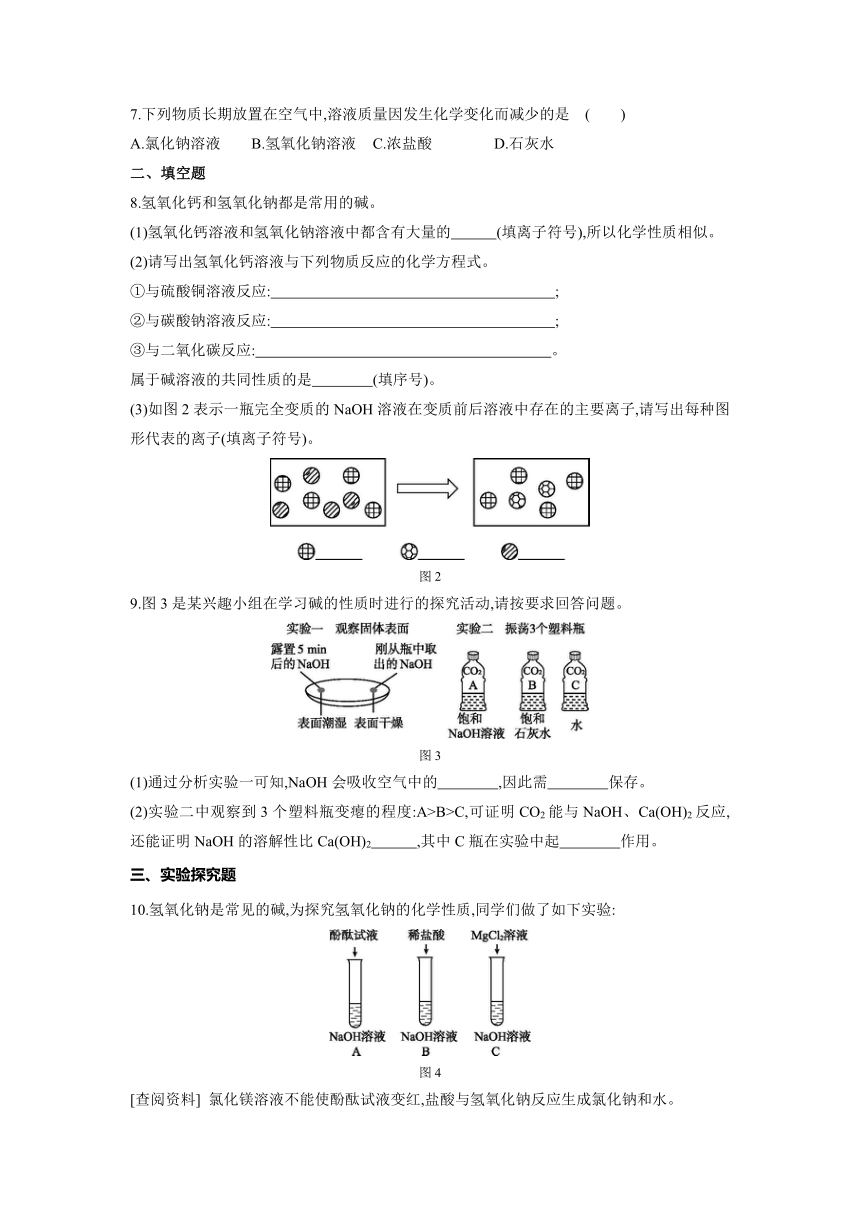
| 科目 | 化学 | ||
| 更新时间 | 2021-11-24 07:07:39 | ||
图片预览


文档简介
第7章 第2节 第2课时 常见的碱
一、选择题
1.下列物质属于碱的是 ( )
A.碳酸钠 B.硫酸钾
C.硝酸镁 D.氢氧化钙
2.下列物质的化学名称与俗名对应错误的是 ( )
A.汞——水银
B.氧化钙——熟石灰
C.氢氧化钙——消石灰
D.氢氧化钠——烧碱、火碱、苛性钠
3.[2020·百色] 下列反应属于复分解反应的是( )
A.4P+5O22P2O5
B.Fe+2HClFeCl2+H2↑
C.2H2O2H2↑+O2↑
D.Na2CO3+MgCl2MgCO3↓+2NaCl
4.下列有关熟石灰的说法错误的是 ( )
A.熟石灰是白色粉末状固体
B.熟石灰能由生石灰与水反应而制得
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰可以用来改良酸性土壤
5.[2020·百色改编] 下列关于氢氧化钠和浓氨水的描述中不正确的是 ( )
A.浓氨水具有挥发性,需要密封保存
B.用酚酞试液检验NaOH溶液是否变质
C.氢氧化钠的水溶液能使石蕊试液变蓝
D.氢氧化钠和浓氨水对皮肤均有腐蚀性
6.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如图1所示的四组实验方案,其中能达到目的的是 ( )
图1
7.下列物质长期放置在空气中,溶液质量因发生化学变化而减少的是 ( )
A.氯化钠溶液 B.氢氧化钠溶液 C.浓盐酸 D.石灰水
二、填空题
8.氢氧化钙和氢氧化钠都是常用的碱。
(1)氢氧化钙溶液和氢氧化钠溶液中都含有大量的 (填离子符号),所以化学性质相似。
(2)请写出氢氧化钙溶液与下列物质反应的化学方程式。
①与硫酸铜溶液反应: ;
②与碳酸钠溶液反应: ;
③与二氧化碳反应: 。
属于碱溶液的共同性质的是 (填序号)。
(3)如图2表示一瓶完全变质的NaOH溶液在变质前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号)。
图2
9.图3是某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题。
图3
(1)通过分析实验一可知,NaOH会吸收空气中的 ,因此需 保存。
(2)实验二中观察到3个塑料瓶变瘪的程度:A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,还能证明NaOH的溶解性比Ca(OH)2 ,其中C瓶在实验中起 作用。
三、实验探究题
10.氢氧化钠是常见的碱,为探究氢氧化钠的化学性质,同学们做了如下实验:
图4
[查阅资料] 氯化镁溶液不能使酚酞试液变红,盐酸与氢氧化钠反应生成氯化钠和水。
(1)A中溶液呈红色,说明氢氧化钠溶液显碱性,要测定它的酸碱度,可使用 。
(2)B中没有明显的现象,该反应真的发生了吗 有同学提出,可向反应后的溶液中加入某些物质,根据相应的现象来判断。下列分析正确的有 (填序号)。
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生
③加入紫色石蕊试液,如果溶液呈紫色,能证明反应发生
(3)C中发生反应的化学方程式是 。该实验证明碱能与某些盐反应。
(4)实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液呈无色。
[提出问题] 上层清液中溶质的成分是什么呢 (指示剂除外)
[作出猜想] 经过讨论,大家作出两种合理的猜想:①NaCl;② (填化学式)。
[实验验证] 设计实验验证猜想②。
实验操作 实验现象 结论
取少量上层清液于试管中,滴加 溶液 猜想②正确
老师提醒同学们,实验结束后氢氧化钠溶液要密封保存,原因是 (用化学方程式表示)。
四、计算题
11.[2020·兴安盟] 为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每份样品均按如图5所示进行实验,实验数据如下表。请计算:
图5
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50 g CuSO4溶液完全反应时,所得沉淀的质量为 g。
(2)CuSO4溶液中溶质的质量分数。
【能力提升】
12.[2020·重庆B] 一定温度下,向a g FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图6所示。下列叙述错误的是 ( )
图6
A.Fe(OH)3沉淀完全时消耗NaOH的质量为n g
B.P点对应的溶液中NaOH达到饱和状态
C.m=c-a
D.生成Fe(OH)3的质量为(n-b+a)g
13.下表是20 ℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是 。
(2)向10%的氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是 。
(3)理论上吸收4.4 g CO2需饱和澄清石灰水的质量至少为 g,或需10%的氢氧化钠溶液的质量至少为 g。(计算结果精确到个位)
答案
1.D 2.B
3.D [解析] 磷燃烧符合“多变一”的形式,属于化合反应;Fe与HCl反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;H2O通电分解符合“一变多”的形式,属于分解反应;Na2CO3与MgCl2反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。
4.C [解析] 熟石灰的化学名称为氢氧化钙,它的溶解度随温度的升高而减小。
5.B [解析] 浓氨水极易挥发出氨气,故应密封保存;氢氧化钠变质生成碳酸钠,其水溶液也显碱性,也能使酚酞试液变红;氢氧化钠溶液显碱性,能使石蕊试液变蓝;氢氧化钠和浓氨水均具有较强碱性,对皮肤和衣物都有腐蚀性。
6.D
7.D [解析] 氯化钠溶液长期放置在空气中不发生化学变化;氢氧化钠溶液长期放置在空气中能与二氧化碳反应生成碳酸钠和水,发生化学变化且溶液质量增加;浓盐酸易挥发出氯化氢气体,使溶液质量减少,但未发生化学变化;石灰水会与空气中的二氧化碳发生化学变化,生成碳酸钙沉淀,使溶液中的溶质质量减少,溶液质量也随之减少。
8.(1)OH-
(2)①Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓ ②Ca(OH)2+Na2CO3CaCO3↓+2NaOH
③Ca(OH)2+CO2CaCO3↓+H2O ①③ (3)Na+ C OH-
[解析] (2)①氢氧化钙溶液与硫酸铜溶液反应生成硫酸钙和氢氧化铜沉淀,反应的化学方程式为Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓;②氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Ca(OH)2+Na2CO3CaCO3↓+2NaOH;③氢氧化钙溶液与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为Ca(OH)2+CO2CaCO3↓+H2O;碱溶液能与硫酸铜反应生成蓝色沉淀,能与非金属氧化物反应生成盐和水,但碳酸钠不能与氢氧化钠等碱溶液反应,故属于碱溶液的共同性质的是①③。(3)变质前溶液中存在的主要离子是钠离子和氢氧根离子,完全变质的NaOH溶液中含有钠离子、碳酸根离子等,故“”表示Na+,“”表示C,“”表示OH-。
9.(1)水蒸气 密封 (2)强 对比(或对照)
[解析] (1)由实验一可知,氢氧化钠会吸收空气中的水蒸气,发生潮解,因此要密封保存。(2)实验二中C瓶之所以变瘪是因为二氧化碳能溶于水且能与水反应,使瓶内气压减小,A、B瓶变瘪的程度大于C瓶,可证明CO2能与NaOH、Ca(OH)2发生反应,C瓶在实验中起对比作用。A瓶变瘪的程度大于B瓶,说明A瓶中反应的二氧化碳比B瓶中多,可证明氢氧化钠的溶解性比氢氧化钙的强。
10.(1)pH试纸(合理即可) (2)①②③
(3)2NaOH+MgCl2Mg(OH)2↓+2NaCl
(4)[作出猜想] NaCl和MgCl2
[实验验证] 氢氧化钠(合理即可) 产生白色沉淀 CO2+2NaOHNa2CO3+H2O
[解析] (2)①加入Na2CO3溶液,如果不产生气泡,说明稀盐酸不存在;②加入CuSO4溶液,如果不产生蓝色沉淀,说明NaOH不存在;③加入紫色石蕊试液,如果溶液呈紫色,说明溶液呈中性;故以上三个方案均可证明稀盐酸与NaOH发生了反应。(4)将三支试管中的物质倒入一只洁净的烧杯中,静置,上层清液呈无色,说明溶液中不存在NaOH;烧杯中出现白色沉淀,说明溶液中不存在HCl,因此溶液中一定存在NaCl,可能存在MgCl2。
11.(1)9.8
(2)解:设50 g CuSO4溶液中含有溶质的质量为x。
2NaOH+CuSO4Cu(OH)2↓+Na2SO4
160 98
x 9.8 g
= x=16 g
则CuSO4溶液中溶质的质量分数为×100%=32%。
答:CuSO4溶液中溶质的质量分数为32%。
[解析] (1)根据表格中的数据,实验2、3中50 g 硫酸铜溶液都是与氢氧化钠完全发生反应,最终生成沉淀的质量为49.8 g-40 g=9.8 g。(2)依据化学方程式,代入氢氧化铜的质量即可求出参加反应的硫酸铜的质量,再根据溶质质量分数的计算公式即可求出硫酸铜溶液中溶质的质量分数。
12.C [解析] 从图像可知,aM段发生的化学反应是FeCl3+3NaOHFe(OH)3↓+3NaCl,消耗的NaOH固体质量是n g;P点后加入NaOH固体,溶液质量不再增加,说明P点对应的溶液已经是NaOH的饱和溶液;溶液质量增加(c-a)g,应该等于加入的NaOH固体总质量m g减去生成的Fe(OH)3沉淀质量;a g(原溶液质量)+n g(加入的NaOH固体质量)=b g(反应后溶液质量)+生成的Fe(OH)3沉淀质量,则生成Fe(OH)3沉淀的质量为(n-b+a) g。
13.(1)溶液先变浑浊,后变澄清
(2)一段时间后出现白色沉淀 (3)2316 40
[解析] (1)向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,产生白色沉淀,再转化为Ca(HCO3)2,沉淀消失,因此可观察到的现象是溶液先变浑浊,后变澄清。(2)向10%的氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,由于碳酸氢钠溶解度较小,一段时间后碳酸氢钠部分析出,出现白色沉淀。(3)用石灰水吸收二氧化碳,生成的碳酸钙、水还可以继续与二氧化碳反应,所以吸收二氧化碳时需饱和澄清石灰水的最少量为生成碳酸氢钙时所消耗石灰水的量。同理,用NaOH溶液吸收时,需要NaOH溶液量最少时全部转化为NaHCO3。
设需氢氧化钙的质量为x。
Ca(OH)2+2CO2Ca(HCO3)2
74 88
x 4.4 g
= x=3.7 g
至少需饱和澄清石灰水的质量为3.7 g÷=2316 g。
设需氢氧化钠的质量为y。
NaOH+CO2NaHCO3
40 44
y 4.4 g
= y=4 g
至少需10%的氢氧化钠溶液的质量为4 g÷10%=40 g。
一、选择题
1.下列物质属于碱的是 ( )
A.碳酸钠 B.硫酸钾
C.硝酸镁 D.氢氧化钙
2.下列物质的化学名称与俗名对应错误的是 ( )
A.汞——水银
B.氧化钙——熟石灰
C.氢氧化钙——消石灰
D.氢氧化钠——烧碱、火碱、苛性钠
3.[2020·百色] 下列反应属于复分解反应的是( )
A.4P+5O22P2O5
B.Fe+2HClFeCl2+H2↑
C.2H2O2H2↑+O2↑
D.Na2CO3+MgCl2MgCO3↓+2NaCl
4.下列有关熟石灰的说法错误的是 ( )
A.熟石灰是白色粉末状固体
B.熟石灰能由生石灰与水反应而制得
C.熟石灰的溶解度随温度的升高而增大
D.熟石灰可以用来改良酸性土壤
5.[2020·百色改编] 下列关于氢氧化钠和浓氨水的描述中不正确的是 ( )
A.浓氨水具有挥发性,需要密封保存
B.用酚酞试液检验NaOH溶液是否变质
C.氢氧化钠的水溶液能使石蕊试液变蓝
D.氢氧化钠和浓氨水对皮肤均有腐蚀性
6.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如图1所示的四组实验方案,其中能达到目的的是 ( )
图1
7.下列物质长期放置在空气中,溶液质量因发生化学变化而减少的是 ( )
A.氯化钠溶液 B.氢氧化钠溶液 C.浓盐酸 D.石灰水
二、填空题
8.氢氧化钙和氢氧化钠都是常用的碱。
(1)氢氧化钙溶液和氢氧化钠溶液中都含有大量的 (填离子符号),所以化学性质相似。
(2)请写出氢氧化钙溶液与下列物质反应的化学方程式。
①与硫酸铜溶液反应: ;
②与碳酸钠溶液反应: ;
③与二氧化碳反应: 。
属于碱溶液的共同性质的是 (填序号)。
(3)如图2表示一瓶完全变质的NaOH溶液在变质前后溶液中存在的主要离子,请写出每种图形代表的离子(填离子符号)。
图2
9.图3是某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题。
图3
(1)通过分析实验一可知,NaOH会吸收空气中的 ,因此需 保存。
(2)实验二中观察到3个塑料瓶变瘪的程度:A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,还能证明NaOH的溶解性比Ca(OH)2 ,其中C瓶在实验中起 作用。
三、实验探究题
10.氢氧化钠是常见的碱,为探究氢氧化钠的化学性质,同学们做了如下实验:
图4
[查阅资料] 氯化镁溶液不能使酚酞试液变红,盐酸与氢氧化钠反应生成氯化钠和水。
(1)A中溶液呈红色,说明氢氧化钠溶液显碱性,要测定它的酸碱度,可使用 。
(2)B中没有明显的现象,该反应真的发生了吗 有同学提出,可向反应后的溶液中加入某些物质,根据相应的现象来判断。下列分析正确的有 (填序号)。
①加入Na2CO3溶液,如果不产生气泡,能证明反应发生
②加入CuSO4溶液,如果不产生蓝色沉淀,能证明反应发生
③加入紫色石蕊试液,如果溶液呈紫色,能证明反应发生
(3)C中发生反应的化学方程式是 。该实验证明碱能与某些盐反应。
(4)实验结束后,将三支试管中的物质倒入一只洁净的烧杯中,烧杯中出现白色沉淀,静置,上层清液呈无色。
[提出问题] 上层清液中溶质的成分是什么呢 (指示剂除外)
[作出猜想] 经过讨论,大家作出两种合理的猜想:①NaCl;② (填化学式)。
[实验验证] 设计实验验证猜想②。
实验操作 实验现象 结论
取少量上层清液于试管中,滴加 溶液 猜想②正确
老师提醒同学们,实验结束后氢氧化钠溶液要密封保存,原因是 (用化学方程式表示)。
四、计算题
11.[2020·兴安盟] 为测定某CuSO4溶液中溶质的质量分数,取150 g CuSO4溶液,平均分为三份,每份样品均按如图5所示进行实验,实验数据如下表。请计算:
图5
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50 g CuSO4溶液完全反应时,所得沉淀的质量为 g。
(2)CuSO4溶液中溶质的质量分数。
【能力提升】
12.[2020·重庆B] 一定温度下,向a g FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图6所示。下列叙述错误的是 ( )
图6
A.Fe(OH)3沉淀完全时消耗NaOH的质量为n g
B.P点对应的溶液中NaOH达到饱和状态
C.m=c-a
D.生成Fe(OH)3的质量为(n-b+a)g
13.下表是20 ℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是 。
(2)向10%的氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是 。
(3)理论上吸收4.4 g CO2需饱和澄清石灰水的质量至少为 g,或需10%的氢氧化钠溶液的质量至少为 g。(计算结果精确到个位)
答案
1.D 2.B
3.D [解析] 磷燃烧符合“多变一”的形式,属于化合反应;Fe与HCl反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;H2O通电分解符合“一变多”的形式,属于分解反应;Na2CO3与MgCl2反应是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应。
4.C [解析] 熟石灰的化学名称为氢氧化钙,它的溶解度随温度的升高而减小。
5.B [解析] 浓氨水极易挥发出氨气,故应密封保存;氢氧化钠变质生成碳酸钠,其水溶液也显碱性,也能使酚酞试液变红;氢氧化钠溶液显碱性,能使石蕊试液变蓝;氢氧化钠和浓氨水均具有较强碱性,对皮肤和衣物都有腐蚀性。
6.D
7.D [解析] 氯化钠溶液长期放置在空气中不发生化学变化;氢氧化钠溶液长期放置在空气中能与二氧化碳反应生成碳酸钠和水,发生化学变化且溶液质量增加;浓盐酸易挥发出氯化氢气体,使溶液质量减少,但未发生化学变化;石灰水会与空气中的二氧化碳发生化学变化,生成碳酸钙沉淀,使溶液中的溶质质量减少,溶液质量也随之减少。
8.(1)OH-
(2)①Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓ ②Ca(OH)2+Na2CO3CaCO3↓+2NaOH
③Ca(OH)2+CO2CaCO3↓+H2O ①③ (3)Na+ C OH-
[解析] (2)①氢氧化钙溶液与硫酸铜溶液反应生成硫酸钙和氢氧化铜沉淀,反应的化学方程式为Ca(OH)2+CuSO4CaSO4+Cu(OH)2↓;②氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为Ca(OH)2+Na2CO3CaCO3↓+2NaOH;③氢氧化钙溶液与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为Ca(OH)2+CO2CaCO3↓+H2O;碱溶液能与硫酸铜反应生成蓝色沉淀,能与非金属氧化物反应生成盐和水,但碳酸钠不能与氢氧化钠等碱溶液反应,故属于碱溶液的共同性质的是①③。(3)变质前溶液中存在的主要离子是钠离子和氢氧根离子,完全变质的NaOH溶液中含有钠离子、碳酸根离子等,故“”表示Na+,“”表示C,“”表示OH-。
9.(1)水蒸气 密封 (2)强 对比(或对照)
[解析] (1)由实验一可知,氢氧化钠会吸收空气中的水蒸气,发生潮解,因此要密封保存。(2)实验二中C瓶之所以变瘪是因为二氧化碳能溶于水且能与水反应,使瓶内气压减小,A、B瓶变瘪的程度大于C瓶,可证明CO2能与NaOH、Ca(OH)2发生反应,C瓶在实验中起对比作用。A瓶变瘪的程度大于B瓶,说明A瓶中反应的二氧化碳比B瓶中多,可证明氢氧化钠的溶解性比氢氧化钙的强。
10.(1)pH试纸(合理即可) (2)①②③
(3)2NaOH+MgCl2Mg(OH)2↓+2NaCl
(4)[作出猜想] NaCl和MgCl2
[实验验证] 氢氧化钠(合理即可) 产生白色沉淀 CO2+2NaOHNa2CO3+H2O
[解析] (2)①加入Na2CO3溶液,如果不产生气泡,说明稀盐酸不存在;②加入CuSO4溶液,如果不产生蓝色沉淀,说明NaOH不存在;③加入紫色石蕊试液,如果溶液呈紫色,说明溶液呈中性;故以上三个方案均可证明稀盐酸与NaOH发生了反应。(4)将三支试管中的物质倒入一只洁净的烧杯中,静置,上层清液呈无色,说明溶液中不存在NaOH;烧杯中出现白色沉淀,说明溶液中不存在HCl,因此溶液中一定存在NaCl,可能存在MgCl2。
11.(1)9.8
(2)解:设50 g CuSO4溶液中含有溶质的质量为x。
2NaOH+CuSO4Cu(OH)2↓+Na2SO4
160 98
x 9.8 g
= x=16 g
则CuSO4溶液中溶质的质量分数为×100%=32%。
答:CuSO4溶液中溶质的质量分数为32%。
[解析] (1)根据表格中的数据,实验2、3中50 g 硫酸铜溶液都是与氢氧化钠完全发生反应,最终生成沉淀的质量为49.8 g-40 g=9.8 g。(2)依据化学方程式,代入氢氧化铜的质量即可求出参加反应的硫酸铜的质量,再根据溶质质量分数的计算公式即可求出硫酸铜溶液中溶质的质量分数。
12.C [解析] 从图像可知,aM段发生的化学反应是FeCl3+3NaOHFe(OH)3↓+3NaCl,消耗的NaOH固体质量是n g;P点后加入NaOH固体,溶液质量不再增加,说明P点对应的溶液已经是NaOH的饱和溶液;溶液质量增加(c-a)g,应该等于加入的NaOH固体总质量m g减去生成的Fe(OH)3沉淀质量;a g(原溶液质量)+n g(加入的NaOH固体质量)=b g(反应后溶液质量)+生成的Fe(OH)3沉淀质量,则生成Fe(OH)3沉淀的质量为(n-b+a) g。
13.(1)溶液先变浑浊,后变澄清
(2)一段时间后出现白色沉淀 (3)2316 40
[解析] (1)向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,产生白色沉淀,再转化为Ca(HCO3)2,沉淀消失,因此可观察到的现象是溶液先变浑浊,后变澄清。(2)向10%的氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,由于碳酸氢钠溶解度较小,一段时间后碳酸氢钠部分析出,出现白色沉淀。(3)用石灰水吸收二氧化碳,生成的碳酸钙、水还可以继续与二氧化碳反应,所以吸收二氧化碳时需饱和澄清石灰水的最少量为生成碳酸氢钙时所消耗石灰水的量。同理,用NaOH溶液吸收时,需要NaOH溶液量最少时全部转化为NaHCO3。
设需氢氧化钙的质量为x。
Ca(OH)2+2CO2Ca(HCO3)2
74 88
x 4.4 g
= x=3.7 g
至少需饱和澄清石灰水的质量为3.7 g÷=2316 g。
设需氢氧化钠的质量为y。
NaOH+CO2NaHCO3
40 44
y 4.4 g
= y=4 g
至少需10%的氢氧化钠溶液的质量为4 g÷10%=40 g。
