7.3几种重要的盐(第2课时几种常见的盐)同步练习—2021—2022学年九年级化学沪教版下册(含解析)
文档属性
| 名称 | 7.3几种重要的盐(第2课时几种常见的盐)同步练习—2021—2022学年九年级化学沪教版下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 174.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-23 23:32:59 | ||
图片预览

文档简介
第7章 第3节 第2课时 几种常见的盐
一、选择题
1.[2020·赤峰改编] 下列物质既可以作治疗胃酸过多的胃药,又可以作面点发酵剂的是 ( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
2.下列生活中常见的物质与其对应的用途描述不相符的是 ( )
A.氯化钠可用于制作常用的调味品
B.氢氧化钠可用于制作炉具清洁剂
C.碳酸钠用于配制生理盐水
D.碳酸钙可用作补钙剂
3.碳酸钠用途非常广泛,侯德榜先生发明了将制碱与制氨结合起来的联合制碱法(侯氏制碱法)。下列有关碳酸钠的说法不正确的是 ( )
A.生产:常用钠单质与二氧化碳通过化合反应制得
B.性质:其水溶液呈碱性
C.用途:广泛用于玻璃、造纸、纺织和洗涤剂的生产
D.组成:由钠离子和碳酸根离子构成
4.酸、碱、盐的溶解性表为我们确定常见物质的溶解性提供了方便。下表是溶解性表中的一部分,结合表格和溶解度知识判断,下列说法不正确的是( )
酸、碱、盐的溶解性表(20 ℃)
离子 OH- N Cl- S C
Ca2+ 微 溶 溶 微 不
A.绘制表格的依据是物质的溶解度
B.表中将常见物质的溶解性分为:溶、微溶和不溶
C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1 g
D.Ca2+、N、Cl-三种离子在溶液中能大量共存
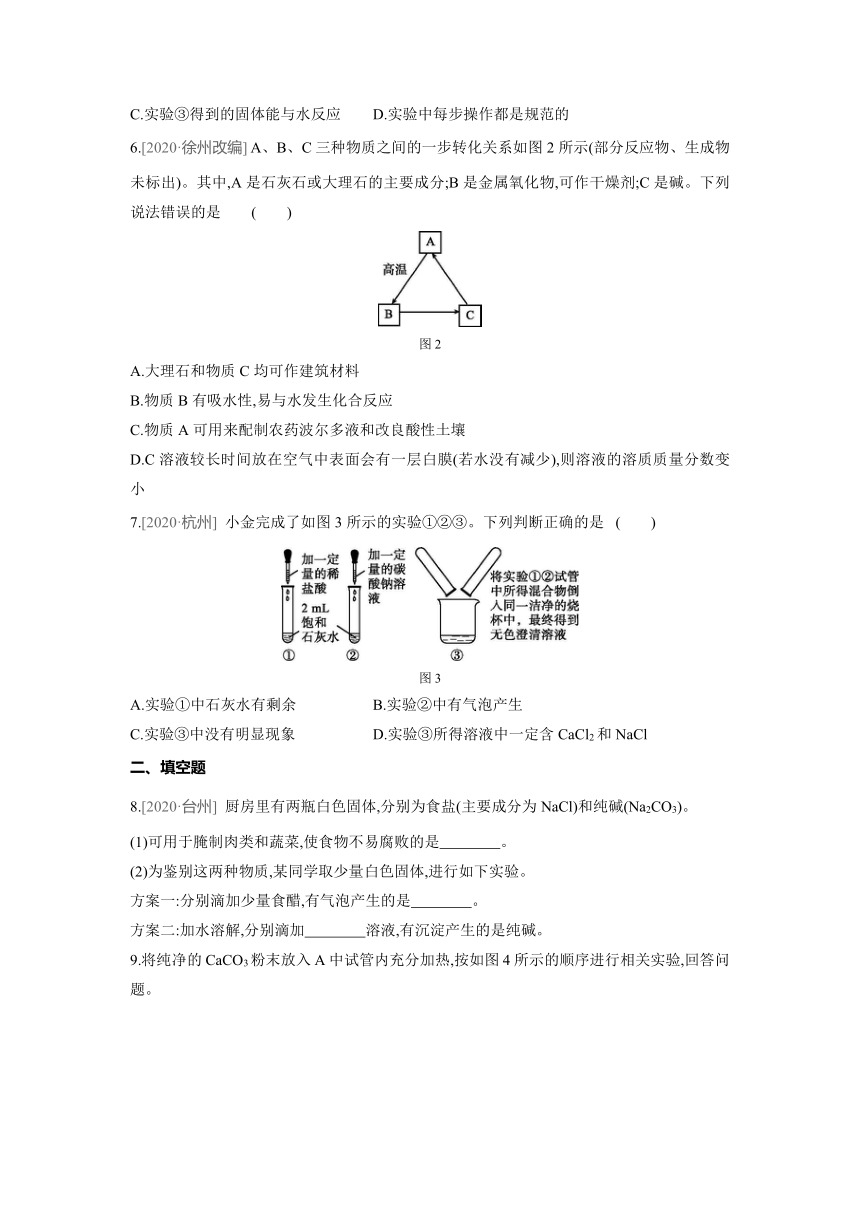
5.[2020·山西] 课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图1所示,其中正确的是( )
图1
A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的
6.[2020·徐州改编] A、B、C三种物质之间的一步转化关系如图2所示(部分反应物、生成物未标出)。其中,A是石灰石或大理石的主要成分;B是金属氧化物,可作干燥剂;C是碱。下列说法错误的是 ( )
图2
A.大理石和物质C均可作建筑材料
B.物质B有吸水性,易与水发生化合反应
C.物质A可用来配制农药波尔多液和改良酸性土壤
D.C溶液较长时间放在空气中表面会有一层白膜(若水没有减少),则溶液的溶质质量分数变小
7.[2020·杭州] 小金完成了如图3所示的实验①②③。下列判断正确的是 ( )
图3
A.实验①中石灰水有剩余 B.实验②中有气泡产生
C.实验③中没有明显现象 D.实验③所得溶液中一定含CaCl2和NaCl
二、填空题
8.[2020·台州] 厨房里有两瓶白色固体,分别为食盐(主要成分为NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 。
方案二:加水溶解,分别滴加 溶液,有沉淀产生的是纯碱。
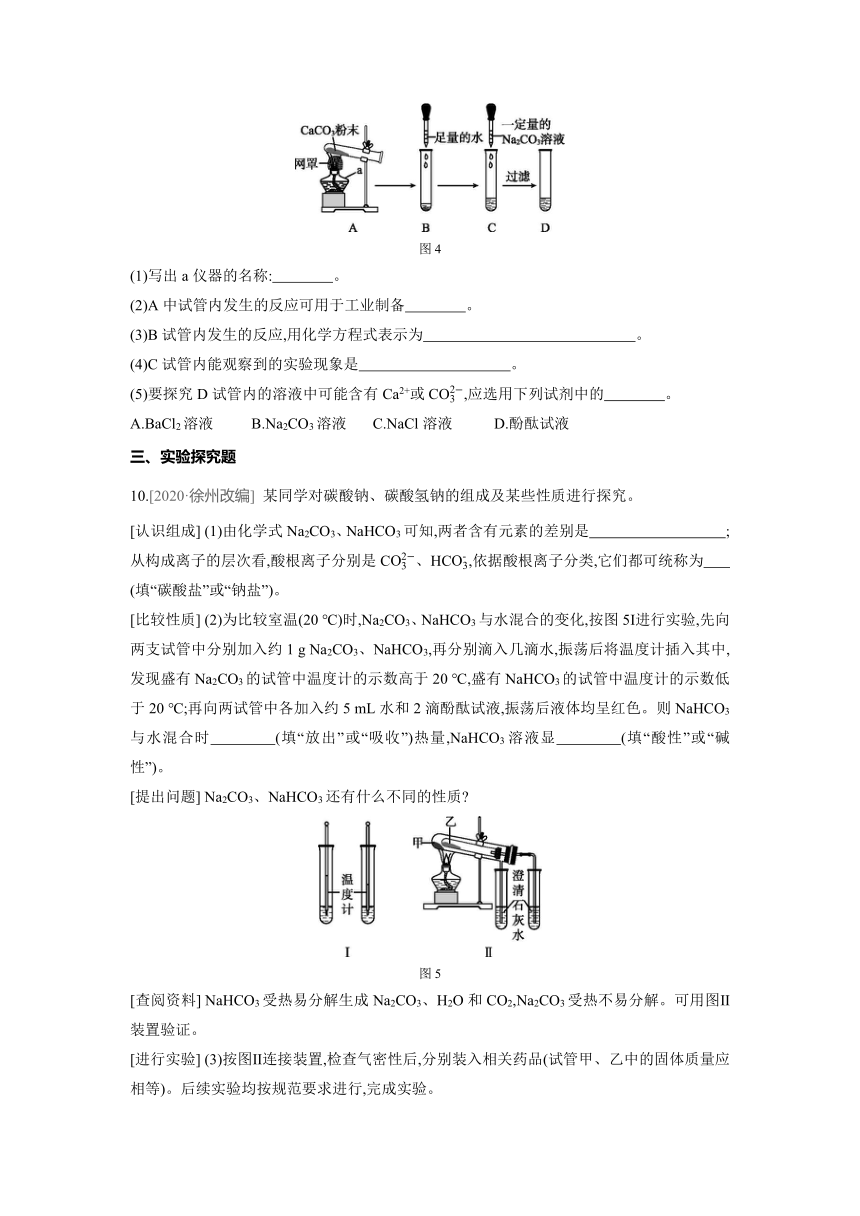
9.将纯净的CaCO3粉末放入A中试管内充分加热,按如图4所示的顺序进行相关实验,回答问题。
图4
(1)写出a仪器的名称: 。
(2)A中试管内发生的反应可用于工业制备 。
(3)B试管内发生的反应,用化学方程式表示为 。
(4)C试管内能观察到的实验现象是 。
(5)要探究D试管内的溶液中可能含有Ca2+或C,应选用下列试剂中的 。
A.BaCl2溶液 B.Na2CO3溶液 C.NaCl溶液 D.酚酞试液
三、实验探究题
10.[2020·徐州改编] 某同学对碳酸钠、碳酸氢钠的组成及某些性质进行探究。
[认识组成] (1)由化学式Na2CO3、NaHCO3可知,两者含有元素的差别是 ;从构成离子的层次看,酸根离子分别是C、HC,依据酸根离子分类,它们都可统称为
(填“碳酸盐”或“钠盐”)。
[比较性质] (2)为比较室温(20 ℃)时,Na2CO3、NaHCO3与水混合的变化,按图5Ⅰ进行实验,先向两支试管中分别加入约1 g Na2CO3、NaHCO3,再分别滴入几滴水,振荡后将温度计插入其中,发现盛有Na2CO3的试管中温度计的示数高于20 ℃,盛有NaHCO3的试管中温度计的示数低于20 ℃;再向两试管中各加入约5 mL水和2滴酚酞试液,振荡后液体均呈红色。则NaHCO3与水混合时 (填“放出”或“吸收”)热量,NaHCO3溶液显 (填“酸性”或“碱性”)。
[提出问题] Na2CO3、NaHCO3还有什么不同的性质
图5
[查阅资料] NaHCO3受热易分解生成Na2CO3、H2O和CO2,Na2CO3受热不易分解。可用图Ⅱ装置验证。
[进行实验] (3)按图Ⅱ连接装置,检查气密性后,分别装入相关药品(试管甲、乙中的固体质量应相等)。后续实验均按规范要求进行,完成实验。
①若要使实验效果更理想,则甲中应装入 (填“Na2CO3”或“NaHCO3”)。
②完成实验后,待试管冷却至室温,若甲、乙试管中剩余固体的质量分别用m(甲)、m(乙)表示,则m(甲) (填“>”“=”或“<”)m(乙)。
[拓展应用] (4)若把碳酸和NaHCO3比较,受热容易分解的是 (填“碳酸”或“NaHCO3”)。除去Na2CO3粉末中混有的少量NaHCO3的方法是 。
(5)研究表明,Na2CO3在水中溶解时能生成自由移动的离子,且Na2CO3溶液中还含有很少的HC,在Na2CO3溶液中存在的带负电荷的离子有HC、 、 (填离子符号)。
附加题
11.[2020·镇江] 以石灰浆[Ca(OH)2、CaCO3]为原料制备超细CaCO3的原理如图6所示。下列说法不正确的是 ( )
图6
A.过程Ⅰ中产生CO2,说明NH4Cl溶液呈酸性
B.过程Ⅱ中NH3需过量,否则会减少超细CaCO3的产率
C.过程Ⅱ中的反应为CaCl2+2NH3+CO2+H2OCaCO3↓+2NH4Cl
D.理论上,生产过程中无须补充CO2和NH4Cl溶液
答案
1.C [解析] 碳酸氢钠能与酸反应,生成二氧化碳气体,可以治疗胃酸过多,也是发酵粉的主要成分之一。
2.C [解析] 氯化钠用于配制生理盐水。
3.A [解析] 钠单质与二氧化碳无法通过化合反应制得碳酸钠。
4.C
5.C [解析] 实验①滴加食醋,产生气体,只能证明蛋壳成分可能是碳酸盐,不能证明蛋壳成分是CaCO3;实验②是向碎蛋壳中加入水和无色酚酞试液,溶液不变色,说明溶液不显碱性,不能证明蛋壳中含钙元素;使用胶头滴管滴加少量液体时,胶头滴管不能伸入烧杯(或试管)内或接触烧杯(或试管)内壁,应竖直悬空在烧杯(或试管)口正上方滴加液体,防止污染胶头滴管。
6.C [解析] A是石灰石或大理石的主要成分,所以A是碳酸钙;B是金属氧化物,可作干燥剂,碳酸钙高温分解会生成B,所以B是氧化钙;C是碱,氧化钙和水反应生成氢氧化钙,所以C是氢氧化钙,经过验证,推导正确。大理石和氢氧化钙均可作建筑材料;氧化钙有吸水性,易与水发生化合反应生成氢氧化钙;氢氧化钙可用来配制农药波尔多液和改良酸性土壤;氢氧化钙溶液较长时间放在空气中会和二氧化碳反应生成碳酸钙沉淀和水,溶液中的溶质质量减少,溶液的溶质质量分数变小。
7.D [解析] 实验①中盐酸和饱和石灰水发生中和反应生成氯化钙和水,实验②中碳酸钠和石灰水反应生成碳酸钙沉淀和氢氧化钠,没有气泡产生;实验③中得到无色澄清溶液,说明实验②中生成的碳酸钙和盐酸发生了反应,因此实验③中的实验现象为产生气泡,固体消失,由此可知实验①中盐酸有剩余;实验③中碳酸钙和盐酸反应生成氯化钙,氢氧化钠和盐酸反应生成氯化钠,因此所得溶液中一定含有氯化钙和氯化钠。
8.(1)食盐
(2)纯碱 氯化钙(合理即可)
9.(1)酒精灯 (2)生石灰
(3)CaO+H2OCa(OH)2
(4)产生白色沉淀 (5)AB
[解析] (5)要探究D试管内的溶液中可能含有Ca2+或C,验证含有钙离子,可选用碳酸钠溶液;验证含有碳酸根离子,可选用BaCl2溶液。
10.(1)是否含有氢元素 碳酸盐
(2)吸收 碱性
(3)①Na2CO3 ②>
(4)碳酸 加热
(5)C OH-
[解析] (3)①NaHCO3受热易分解生成Na2CO3、H2O和CO2,Na2CO3受热不易分解,用图Ⅱ装置验证,甲试管受热温度高,乙试管受热温度低。若要使实验效果更理想,则甲中应装入Na2CO3。②两支试管中分别加入质量相等的 Na2CO3、NaHCO3,加热后 Na2CO3不分解,而NaHCO3受热分解生成Na2CO3、H2O和CO2,故m(甲)>m(乙)。(4)依据碳酸的性质,稍加热就能分解,而碳酸氢钠受热才分解,所以受热容易分解的是碳酸。NaHCO3受热易分解生成Na2CO3、H2O和CO2,Na2CO3受热不易分解,所以除去Na2CO3粉末中混有的少量NaHCO3的方法是加热。(5)Na2CO3在水中溶解时能生成Na+、C,Na2CO3溶液显碱性,所以溶液中还含有OH-,因此在Na2CO3溶液中存在的带负电荷的离子有HC、C、OH-。
11.D [解析] 过程Ⅰ中产生CO2,说明NH4Cl溶液呈酸性,因为碳酸钙能和酸性物质反应生成盐、水和二氧化碳;过程Ⅱ中二氧化碳全部转化成碳酸根离子,NH3需过量,否则会减少超细CaCO3的产率;过程Ⅱ中的反应为CaCl2+2NH3+CO2+H2OCaCO3↓+2NH4Cl;氢氧化钙需要转化成碳酸钙,根据质量守恒定律,理论上需要补充二氧化碳,不需要补充氯化铵。
一、选择题
1.[2020·赤峰改编] 下列物质既可以作治疗胃酸过多的胃药,又可以作面点发酵剂的是 ( )
A.NaCl B.NaOH C.NaHCO3 D.Na2SO4
2.下列生活中常见的物质与其对应的用途描述不相符的是 ( )
A.氯化钠可用于制作常用的调味品
B.氢氧化钠可用于制作炉具清洁剂
C.碳酸钠用于配制生理盐水
D.碳酸钙可用作补钙剂
3.碳酸钠用途非常广泛,侯德榜先生发明了将制碱与制氨结合起来的联合制碱法(侯氏制碱法)。下列有关碳酸钠的说法不正确的是 ( )
A.生产:常用钠单质与二氧化碳通过化合反应制得
B.性质:其水溶液呈碱性
C.用途:广泛用于玻璃、造纸、纺织和洗涤剂的生产
D.组成:由钠离子和碳酸根离子构成
4.酸、碱、盐的溶解性表为我们确定常见物质的溶解性提供了方便。下表是溶解性表中的一部分,结合表格和溶解度知识判断,下列说法不正确的是( )
酸、碱、盐的溶解性表(20 ℃)
离子 OH- N Cl- S C
Ca2+ 微 溶 溶 微 不
A.绘制表格的依据是物质的溶解度
B.表中将常见物质的溶解性分为:溶、微溶和不溶
C.Ca(OH)2、CaSO4和CaCO3的溶解度都大于1 g
D.Ca2+、N、Cl-三种离子在溶液中能大量共存
5.[2020·山西] 课外实验具有趣味性、实践性等特点。鸡蛋壳成分的探究过程如图1所示,其中正确的是( )
图1
A.实验①证明蛋壳成分是CaCO3 B.实验②可证明蛋壳中含钙元素
C.实验③得到的固体能与水反应 D.实验中每步操作都是规范的
6.[2020·徐州改编] A、B、C三种物质之间的一步转化关系如图2所示(部分反应物、生成物未标出)。其中,A是石灰石或大理石的主要成分;B是金属氧化物,可作干燥剂;C是碱。下列说法错误的是 ( )
图2
A.大理石和物质C均可作建筑材料
B.物质B有吸水性,易与水发生化合反应
C.物质A可用来配制农药波尔多液和改良酸性土壤
D.C溶液较长时间放在空气中表面会有一层白膜(若水没有减少),则溶液的溶质质量分数变小
7.[2020·杭州] 小金完成了如图3所示的实验①②③。下列判断正确的是 ( )
图3
A.实验①中石灰水有剩余 B.实验②中有气泡产生
C.实验③中没有明显现象 D.实验③所得溶液中一定含CaCl2和NaCl
二、填空题
8.[2020·台州] 厨房里有两瓶白色固体,分别为食盐(主要成分为NaCl)和纯碱(Na2CO3)。
(1)可用于腌制肉类和蔬菜,使食物不易腐败的是 。
(2)为鉴别这两种物质,某同学取少量白色固体,进行如下实验。
方案一:分别滴加少量食醋,有气泡产生的是 。
方案二:加水溶解,分别滴加 溶液,有沉淀产生的是纯碱。
9.将纯净的CaCO3粉末放入A中试管内充分加热,按如图4所示的顺序进行相关实验,回答问题。
图4
(1)写出a仪器的名称: 。
(2)A中试管内发生的反应可用于工业制备 。
(3)B试管内发生的反应,用化学方程式表示为 。
(4)C试管内能观察到的实验现象是 。
(5)要探究D试管内的溶液中可能含有Ca2+或C,应选用下列试剂中的 。
A.BaCl2溶液 B.Na2CO3溶液 C.NaCl溶液 D.酚酞试液
三、实验探究题
10.[2020·徐州改编] 某同学对碳酸钠、碳酸氢钠的组成及某些性质进行探究。
[认识组成] (1)由化学式Na2CO3、NaHCO3可知,两者含有元素的差别是 ;从构成离子的层次看,酸根离子分别是C、HC,依据酸根离子分类,它们都可统称为
(填“碳酸盐”或“钠盐”)。
[比较性质] (2)为比较室温(20 ℃)时,Na2CO3、NaHCO3与水混合的变化,按图5Ⅰ进行实验,先向两支试管中分别加入约1 g Na2CO3、NaHCO3,再分别滴入几滴水,振荡后将温度计插入其中,发现盛有Na2CO3的试管中温度计的示数高于20 ℃,盛有NaHCO3的试管中温度计的示数低于20 ℃;再向两试管中各加入约5 mL水和2滴酚酞试液,振荡后液体均呈红色。则NaHCO3与水混合时 (填“放出”或“吸收”)热量,NaHCO3溶液显 (填“酸性”或“碱性”)。
[提出问题] Na2CO3、NaHCO3还有什么不同的性质
图5
[查阅资料] NaHCO3受热易分解生成Na2CO3、H2O和CO2,Na2CO3受热不易分解。可用图Ⅱ装置验证。
[进行实验] (3)按图Ⅱ连接装置,检查气密性后,分别装入相关药品(试管甲、乙中的固体质量应相等)。后续实验均按规范要求进行,完成实验。
①若要使实验效果更理想,则甲中应装入 (填“Na2CO3”或“NaHCO3”)。
②完成实验后,待试管冷却至室温,若甲、乙试管中剩余固体的质量分别用m(甲)、m(乙)表示,则m(甲) (填“>”“=”或“<”)m(乙)。
[拓展应用] (4)若把碳酸和NaHCO3比较,受热容易分解的是 (填“碳酸”或“NaHCO3”)。除去Na2CO3粉末中混有的少量NaHCO3的方法是 。
(5)研究表明,Na2CO3在水中溶解时能生成自由移动的离子,且Na2CO3溶液中还含有很少的HC,在Na2CO3溶液中存在的带负电荷的离子有HC、 、 (填离子符号)。
附加题
11.[2020·镇江] 以石灰浆[Ca(OH)2、CaCO3]为原料制备超细CaCO3的原理如图6所示。下列说法不正确的是 ( )
图6
A.过程Ⅰ中产生CO2,说明NH4Cl溶液呈酸性
B.过程Ⅱ中NH3需过量,否则会减少超细CaCO3的产率
C.过程Ⅱ中的反应为CaCl2+2NH3+CO2+H2OCaCO3↓+2NH4Cl
D.理论上,生产过程中无须补充CO2和NH4Cl溶液
答案
1.C [解析] 碳酸氢钠能与酸反应,生成二氧化碳气体,可以治疗胃酸过多,也是发酵粉的主要成分之一。
2.C [解析] 氯化钠用于配制生理盐水。
3.A [解析] 钠单质与二氧化碳无法通过化合反应制得碳酸钠。
4.C
5.C [解析] 实验①滴加食醋,产生气体,只能证明蛋壳成分可能是碳酸盐,不能证明蛋壳成分是CaCO3;实验②是向碎蛋壳中加入水和无色酚酞试液,溶液不变色,说明溶液不显碱性,不能证明蛋壳中含钙元素;使用胶头滴管滴加少量液体时,胶头滴管不能伸入烧杯(或试管)内或接触烧杯(或试管)内壁,应竖直悬空在烧杯(或试管)口正上方滴加液体,防止污染胶头滴管。
6.C [解析] A是石灰石或大理石的主要成分,所以A是碳酸钙;B是金属氧化物,可作干燥剂,碳酸钙高温分解会生成B,所以B是氧化钙;C是碱,氧化钙和水反应生成氢氧化钙,所以C是氢氧化钙,经过验证,推导正确。大理石和氢氧化钙均可作建筑材料;氧化钙有吸水性,易与水发生化合反应生成氢氧化钙;氢氧化钙可用来配制农药波尔多液和改良酸性土壤;氢氧化钙溶液较长时间放在空气中会和二氧化碳反应生成碳酸钙沉淀和水,溶液中的溶质质量减少,溶液的溶质质量分数变小。
7.D [解析] 实验①中盐酸和饱和石灰水发生中和反应生成氯化钙和水,实验②中碳酸钠和石灰水反应生成碳酸钙沉淀和氢氧化钠,没有气泡产生;实验③中得到无色澄清溶液,说明实验②中生成的碳酸钙和盐酸发生了反应,因此实验③中的实验现象为产生气泡,固体消失,由此可知实验①中盐酸有剩余;实验③中碳酸钙和盐酸反应生成氯化钙,氢氧化钠和盐酸反应生成氯化钠,因此所得溶液中一定含有氯化钙和氯化钠。
8.(1)食盐
(2)纯碱 氯化钙(合理即可)
9.(1)酒精灯 (2)生石灰
(3)CaO+H2OCa(OH)2
(4)产生白色沉淀 (5)AB
[解析] (5)要探究D试管内的溶液中可能含有Ca2+或C,验证含有钙离子,可选用碳酸钠溶液;验证含有碳酸根离子,可选用BaCl2溶液。
10.(1)是否含有氢元素 碳酸盐
(2)吸收 碱性
(3)①Na2CO3 ②>
(4)碳酸 加热
(5)C OH-
[解析] (3)①NaHCO3受热易分解生成Na2CO3、H2O和CO2,Na2CO3受热不易分解,用图Ⅱ装置验证,甲试管受热温度高,乙试管受热温度低。若要使实验效果更理想,则甲中应装入Na2CO3。②两支试管中分别加入质量相等的 Na2CO3、NaHCO3,加热后 Na2CO3不分解,而NaHCO3受热分解生成Na2CO3、H2O和CO2,故m(甲)>m(乙)。(4)依据碳酸的性质,稍加热就能分解,而碳酸氢钠受热才分解,所以受热容易分解的是碳酸。NaHCO3受热易分解生成Na2CO3、H2O和CO2,Na2CO3受热不易分解,所以除去Na2CO3粉末中混有的少量NaHCO3的方法是加热。(5)Na2CO3在水中溶解时能生成Na+、C,Na2CO3溶液显碱性,所以溶液中还含有OH-,因此在Na2CO3溶液中存在的带负电荷的离子有HC、C、OH-。
11.D [解析] 过程Ⅰ中产生CO2,说明NH4Cl溶液呈酸性,因为碳酸钙能和酸性物质反应生成盐、水和二氧化碳;过程Ⅱ中二氧化碳全部转化成碳酸根离子,NH3需过量,否则会减少超细CaCO3的产率;过程Ⅱ中的反应为CaCl2+2NH3+CO2+H2OCaCO3↓+2NH4Cl;氢氧化钙需要转化成碳酸钙,根据质量守恒定律,理论上需要补充二氧化碳,不需要补充氯化铵。
