7.1 溶液的酸碱性【课件34页】
图片预览











文档简介
(共34张PPT)
溶液的酸碱性
第七章 第一节
ACIDITY AND BASICITY OF SOLUTION
生活中的酸味物质
通常情况下是不允许品尝化学试剂的味道的,那我们怎么确定物质的酸性或碱性呢?
回忆:将二氧化碳通入紫色石蕊试液看到什么现象?
CO2 + H2O = H2CO3
能使紫色石蕊试液变红
食醋、酸果汁等有酸味的物质的溶液,是否能使紫色石蕊试液变红?
将白醋、酸果汁、稀盐酸、纯碱溶液、肥皂水、石灰水、氨水、食盐水、蔗糖水分别加入试管中。
再各滴加少量的紫色石蕊试液,观察现象,你能得出什么结论?
白醋、酸果汁、稀盐酸这些有酸味的物质能使紫色石蕊试液变红,这些溶液显酸性。
纯碱溶液、肥皂水、石灰水、氨水等能使紫色石蕊试液变蓝,这些溶液显碱性。
食盐水和蔗糖不能使紫色石蕊试液变色,呈中性。
结论:
实验1
将白醋、酸果汁、稀盐酸、纯碱溶液、肥皂水、石灰水、氨水、食盐水、蔗糖水分别加入试管中。
再各滴加少量的无色酚酞试液,观察现象,你能得出什么结论?
实验2
酸碱指示剂
能跟酸或碱的溶液起作用而显示不同颜色的物质
紫色石蕊试液
无色酚酞试液
溶液
紫色石蕊试液
无色酚酞试液
呈红色
呈蓝色
呈紫色
呈无色
呈红色
呈无色
注意:不能使酚酞试液变色的溶液,可能显酸性,可能显中性。
酸性溶液
碱性溶液
中性溶液
酸红碱蓝中不变
酸中都无碱呈红
现有两瓶失去标签的无色溶液,
一瓶是稀盐酸,一瓶是氢氧化钠溶液,
请你通过鉴别,贴上标签
鉴别两瓶无色溶液
检验酸碱溶液的操作步骤:
取样于试管中,分别滴加紫色石蕊溶液,观察现象,如果紫色石蕊变红,则原溶液是盐酸;如果紫色石蕊变蓝,则原溶液是氢氧化钠溶液。
取 样
滴加指示剂
观察现象
得出结论
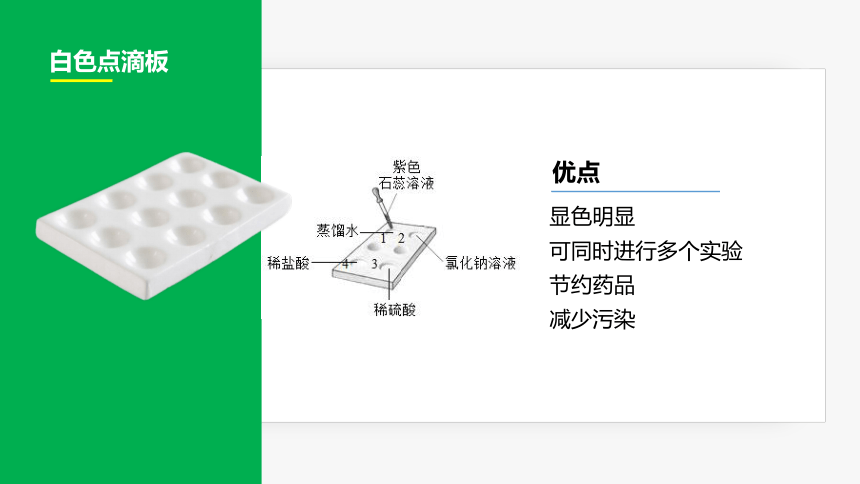
白色点滴板
优点
显色明显
可同时进行多个实验
节约药品
减少污染
为了使用方便,
通常还用蓝色或红色石蕊试纸来检验溶液的酸碱性。
稀硫酸
食盐水
石灰水
蓝纸遇酸红;
红纸遇碱蓝
操作注意事项:
不能将试纸浸入溶液中,会污染溶液
试纸放在干净的表面皿或玻璃片上
玻璃棒应洗净擦干
用玻璃棒蘸取溶液滴在试纸上
用酸度来表示溶液的酸性强弱程度
用碱度来表示溶液的碱性强弱程度
回忆:用 来表示溶液的溶解性强弱程度
pH
(酸碱度)
用石蕊或酚酞试液可以检验出某溶液的酸碱性,但如何比较两种溶液酸碱性的强弱呢?
例如:食醋和稀盐酸都是酸性的,谁的酸性比较强呢?
溶解度
2. 酸性溶液的pH<7;中性溶液的pH=7;碱性溶液的pH>7
3. 酸性溶液的pH值越小酸性越强,反之PH值越大酸性越弱
碱性溶液的pH值越大碱性越强,反之PH值越小碱性越弱
1. pH的范围是0-14
pH
(酸碱度)
1.pH=3与pH=4的溶液哪一个酸性强?
2. pH=8与pH=10的溶液哪一个碱性强?
3.pH=0是否代表溶液没有酸碱性?
4.使pH=8的溶液变为pH= 3,应加入下列哪种溶液( )
A. pH=1 B. pH=7 C. pH=14 D. pH=5
A
3
10
不是,酸性较强
5.10%的盐酸的pH与20% 盐酸的pH哪个小?
20%
酸性溶液浓度越大,pH越小,碱性溶液浓度越大,pH越大
练习
测定生活中常见物质的pH值
粗略地测定溶液的酸碱度(整数)
比较精确地测定溶液的pH
pH测定方法
pH试纸法
酸度计法
PH determination method
活动与探究
用pH试纸测定溶液的酸碱度
用玻璃棒醮取少量待测溶液,涂在pH试纸上,半分钟内)将试纸呈现的颜色与标准比色卡对照,读出pH值。
注意事项
1.pH试纸不能直接插入待测溶液中
2.不能用水润湿
3.玻璃棒应洗净擦干!
使用方法
溶液的pH
随所加水的体积(V)变化关系
B
0
7
pH
加水体积
A
14
加水稀释
一定质量分数的酸性或碱性溶液
加水后,溶液碱性减弱,pH减小,逐渐接近于7,但不会等于7
加水后,溶液酸性减弱,pH增大,逐渐接近于7,但不会等于7
碱性溶液
酸性溶液
说出实现如图所示pH变化的方法
酸性溶液中加入水或中性溶液
酸性溶液中加入碱性溶液
碱性溶液中加入水或中性溶液
碱性溶液中加入酸性溶液
Name the method to realize the pH change as shown in the figure
练习
1. 某溶液被稀释后,pH一定有误差
2.红蓝石蕊试纸可否用水润湿?
不一定,中性溶液不影响
可以,不影响酸碱性
pH
有没有同学有过胃痛的经历?
你能说说胃痛的原因吗?
你能说出胃药治疗的原理?
体液 pH 体液 pH 体液 pH
血液 7.35-7.45 胃液 0.8-1.5 乳汁 6.4-6.7
唾液 6.6-7.1 胆汁 6.8-7.4 尿 5.0-7.0
表7-1 人体中几种重要体液的正常pH范围
阅读资料:
健康人的体液pH必须维持在一定的范围内。如果体液pH超越正常范围 ,就会导致生理功能失调或发生疾病,甚至出现“酸中毒”。如果胃酸分泌过多,使胃液pH降到正常水平以下,容易出现胃痛等症状。
作物 pH 作物 pH
水稻、小麦、玉米 6.0-7.0 甘蔗、桑树、苹果树 6.0-8.0
番茄、西瓜 6.0-7.0 松树、烟草 5.0-6.0
棉花 6.0-6.8 柑橘树 5.0-7.0
大豆 6.5-7.5 茶树 5.0-5.5
表7-2 几种作物生长最适宜的pH范围
阅读资料:
大多数农作物适宜在接近中性(pH在6.5—7.5之间)的土壤中生长,酸性太强(pH小于4)或碱性太强(pH大于8)的土壤都不适宜作物的生长。
酸雨
pH小于5.6的雨水
1.实验室中常用的酸碱指示剂有( )试液和( )试液,其中( )
遇酸或碱都能变色.
石蕊
酚酞
石蕊
2.实验室中常用的酸碱指示剂来检验溶液的( ),
常用pH来测定溶液的( ).
酸碱性
酸碱度
3.使红色石蕊试纸变蓝的溶液能使酚酞试液呈( ).
A.无色 B.红色 C.蓝色 D.紫色
B
课堂巩固
课堂巩固
4.某溶液加酚酞试液为无色,则pH 7。
5.将①氯化钠、②氢氧化钙、③氯化氢分别溶于水所得溶液的
pH由大到小依次为 。
②①③
≤
6.如果体内的二氧化碳不能顺利排出,人体血液的pH会 。
偏小
7.正常人体内的下列液体,显酸性且酸性最强的是( )
液 体 血 浆 胰 液 胃 液 唾 液
pH 7.35-7.45 7.5-8.0 0.9-1.5 6.6-7.1
A.血浆 B.胰液 C.胃液 D.唾液
C
课堂巩固
8.用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴
到试纸上,测得的结果与白醋实际的pH比较( )
A.偏低 B.偏高 C.相等 D.无法比较
B
9.苯甲酸可用作食品防腐剂,其酸性比醋酸强.
下列对苯甲酸性质的推测不合理的是( )
A.苯甲酸溶液的pH大于7 B.苯甲酸溶液的pH小于7
C.苯甲酸能使紫色石蕊试液变红色 D.苯甲酸不能使无色酚酞试液变色
A
课堂巩固
7.下表为家庭中一些常见物质的PH值
物质 食醋 牙膏 食盐水 肥皂水 火碱液
pH 3 9 7 10 13
蚊子、蜂、蚂蚁等昆虫叮咬人时,会向人体射入一种叫蚁酸(具有酸的性质)的物质,使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的( )
A.牙膏和肥皂水 B.食盐水 C.火碱液 D.食醋
A
pH与人体健康:
在生命长期的进化过程中,人体形成了较为稳定的呈微碱性的内环境,人体体液在正常状态下的pH为 7.04,也就是说,人体在处于偏碱性状态时,是最平衡、最健康的。但由于现代人大量摄入高蛋白、高脂肪的偏酸性食物,容易造成人体体质的酸性化,导致身体机能减弱,新陈代谢变得缓慢,各种代谢废物不容易排出,内脏负担加重,最常见的表现是容易疲劳、上火便秘、感冒,严重的还可能导致高血压等慢性疾病。 反之,当人体处于正常的微碱性状态时,新陈代谢就较为活跃,体内废物容易排出,身体免疫力也较强,不易得病。
pH与人体健康
人体体液的pH值是7.35~7.45时正常;
人体体液的pH值<7.35时,处于亚健康状况;
人体体液的pH值=6.9时,变成植物人;
人体体液的pH值是6.85~6.45时死亡。
pH与智商:
近年来,医学研究发现,人体体液的酸碱度与智商水平有密切关系。在体液酸碱度允许的范围内,酸性偏高者智商较低,碱性偏高则智商较高。科学家测试了数十名6至13岁的男孩,结果表明,大脑皮层中的体液pH大于7.0的孩子,比小于7.0的孩子的智商高出1倍之多。 人们知道,健康人的体液(主要是血液)应呈微碱性(pH约为7.3至7.5),这样有利于机体对蛋白质等营养物质的吸收利用,并使体内的血液循环和免疫系统保持良好状态,人的精力也就显得较为充沛。而有些孩子表现脾气暴躁、多动,学习精力不集中,常感疲乏无力,且易患感冒、龋齿及牙周炎等疾病,其原因可能与体液酸碱度偏高有关。
正常情况下人的血液PH为7.35~7.45之间,高于此数值表明体液呈碱性,低于此表明体液呈酸性。由于生活和环境的影响,多数人为酸性体液,你是不是酸性人呢?
经常头疼 经常有筋疲力尽的感觉 健忘 免疫力差
肠胃不适 皮肤苍白多粉刺 便秘 情绪波动大
易激惹 头发无光泽且易断 龋齿
如果上面症状中有一半以上符合你,那么你就是一个不折不扣的酸性人了。
酸碱误区
误区一:酸碱食物是以口味酸碱来区分并非味觉上有酸味的食品就属于酸性食品,新鲜的成熟水果,即使其味道是酸的,也是碱性生成物。
误区二:酸性食品是坏的,碱性食品是好的将食物以酸碱分为好坏是大错特错,饮食并非“碱性越多越好”,人体有良好的酸碱调节系统,使体液保持相对稳定的酸碱数值,只有平衡才能健康
小测试——你是一个酸性人吗?
https://www.21cnjy.com/help/help_extract.php
溶液的酸碱性
第七章 第一节
ACIDITY AND BASICITY OF SOLUTION
生活中的酸味物质
通常情况下是不允许品尝化学试剂的味道的,那我们怎么确定物质的酸性或碱性呢?
回忆:将二氧化碳通入紫色石蕊试液看到什么现象?
CO2 + H2O = H2CO3
能使紫色石蕊试液变红
食醋、酸果汁等有酸味的物质的溶液,是否能使紫色石蕊试液变红?
将白醋、酸果汁、稀盐酸、纯碱溶液、肥皂水、石灰水、氨水、食盐水、蔗糖水分别加入试管中。
再各滴加少量的紫色石蕊试液,观察现象,你能得出什么结论?
白醋、酸果汁、稀盐酸这些有酸味的物质能使紫色石蕊试液变红,这些溶液显酸性。
纯碱溶液、肥皂水、石灰水、氨水等能使紫色石蕊试液变蓝,这些溶液显碱性。
食盐水和蔗糖不能使紫色石蕊试液变色,呈中性。
结论:
实验1
将白醋、酸果汁、稀盐酸、纯碱溶液、肥皂水、石灰水、氨水、食盐水、蔗糖水分别加入试管中。
再各滴加少量的无色酚酞试液,观察现象,你能得出什么结论?
实验2
酸碱指示剂
能跟酸或碱的溶液起作用而显示不同颜色的物质
紫色石蕊试液
无色酚酞试液
溶液
紫色石蕊试液
无色酚酞试液
呈红色
呈蓝色
呈紫色
呈无色
呈红色
呈无色
注意:不能使酚酞试液变色的溶液,可能显酸性,可能显中性。
酸性溶液
碱性溶液
中性溶液
酸红碱蓝中不变
酸中都无碱呈红
现有两瓶失去标签的无色溶液,
一瓶是稀盐酸,一瓶是氢氧化钠溶液,
请你通过鉴别,贴上标签
鉴别两瓶无色溶液
检验酸碱溶液的操作步骤:
取样于试管中,分别滴加紫色石蕊溶液,观察现象,如果紫色石蕊变红,则原溶液是盐酸;如果紫色石蕊变蓝,则原溶液是氢氧化钠溶液。
取 样
滴加指示剂
观察现象
得出结论
白色点滴板
优点
显色明显
可同时进行多个实验
节约药品
减少污染
为了使用方便,
通常还用蓝色或红色石蕊试纸来检验溶液的酸碱性。
稀硫酸
食盐水
石灰水
蓝纸遇酸红;
红纸遇碱蓝
操作注意事项:
不能将试纸浸入溶液中,会污染溶液
试纸放在干净的表面皿或玻璃片上
玻璃棒应洗净擦干
用玻璃棒蘸取溶液滴在试纸上
用酸度来表示溶液的酸性强弱程度
用碱度来表示溶液的碱性强弱程度
回忆:用 来表示溶液的溶解性强弱程度
pH
(酸碱度)
用石蕊或酚酞试液可以检验出某溶液的酸碱性,但如何比较两种溶液酸碱性的强弱呢?
例如:食醋和稀盐酸都是酸性的,谁的酸性比较强呢?
溶解度
2. 酸性溶液的pH<7;中性溶液的pH=7;碱性溶液的pH>7
3. 酸性溶液的pH值越小酸性越强,反之PH值越大酸性越弱
碱性溶液的pH值越大碱性越强,反之PH值越小碱性越弱
1. pH的范围是0-14
pH
(酸碱度)
1.pH=3与pH=4的溶液哪一个酸性强?
2. pH=8与pH=10的溶液哪一个碱性强?
3.pH=0是否代表溶液没有酸碱性?
4.使pH=8的溶液变为pH= 3,应加入下列哪种溶液( )
A. pH=1 B. pH=7 C. pH=14 D. pH=5
A
3
10
不是,酸性较强
5.10%的盐酸的pH与20% 盐酸的pH哪个小?
20%
酸性溶液浓度越大,pH越小,碱性溶液浓度越大,pH越大
练习
测定生活中常见物质的pH值
粗略地测定溶液的酸碱度(整数)
比较精确地测定溶液的pH
pH测定方法
pH试纸法
酸度计法
PH determination method
活动与探究
用pH试纸测定溶液的酸碱度
用玻璃棒醮取少量待测溶液,涂在pH试纸上,半分钟内)将试纸呈现的颜色与标准比色卡对照,读出pH值。
注意事项
1.pH试纸不能直接插入待测溶液中
2.不能用水润湿
3.玻璃棒应洗净擦干!
使用方法
溶液的pH
随所加水的体积(V)变化关系
B
0
7
pH
加水体积
A
14
加水稀释
一定质量分数的酸性或碱性溶液
加水后,溶液碱性减弱,pH减小,逐渐接近于7,但不会等于7
加水后,溶液酸性减弱,pH增大,逐渐接近于7,但不会等于7
碱性溶液
酸性溶液
说出实现如图所示pH变化的方法
酸性溶液中加入水或中性溶液
酸性溶液中加入碱性溶液
碱性溶液中加入水或中性溶液
碱性溶液中加入酸性溶液
Name the method to realize the pH change as shown in the figure
练习
1. 某溶液被稀释后,pH一定有误差
2.红蓝石蕊试纸可否用水润湿?
不一定,中性溶液不影响
可以,不影响酸碱性
pH
有没有同学有过胃痛的经历?
你能说说胃痛的原因吗?
你能说出胃药治疗的原理?
体液 pH 体液 pH 体液 pH
血液 7.35-7.45 胃液 0.8-1.5 乳汁 6.4-6.7
唾液 6.6-7.1 胆汁 6.8-7.4 尿 5.0-7.0
表7-1 人体中几种重要体液的正常pH范围
阅读资料:
健康人的体液pH必须维持在一定的范围内。如果体液pH超越正常范围 ,就会导致生理功能失调或发生疾病,甚至出现“酸中毒”。如果胃酸分泌过多,使胃液pH降到正常水平以下,容易出现胃痛等症状。
作物 pH 作物 pH
水稻、小麦、玉米 6.0-7.0 甘蔗、桑树、苹果树 6.0-8.0
番茄、西瓜 6.0-7.0 松树、烟草 5.0-6.0
棉花 6.0-6.8 柑橘树 5.0-7.0
大豆 6.5-7.5 茶树 5.0-5.5
表7-2 几种作物生长最适宜的pH范围
阅读资料:
大多数农作物适宜在接近中性(pH在6.5—7.5之间)的土壤中生长,酸性太强(pH小于4)或碱性太强(pH大于8)的土壤都不适宜作物的生长。
酸雨
pH小于5.6的雨水
1.实验室中常用的酸碱指示剂有( )试液和( )试液,其中( )
遇酸或碱都能变色.
石蕊
酚酞
石蕊
2.实验室中常用的酸碱指示剂来检验溶液的( ),
常用pH来测定溶液的( ).
酸碱性
酸碱度
3.使红色石蕊试纸变蓝的溶液能使酚酞试液呈( ).
A.无色 B.红色 C.蓝色 D.紫色
B
课堂巩固
课堂巩固
4.某溶液加酚酞试液为无色,则pH 7。
5.将①氯化钠、②氢氧化钙、③氯化氢分别溶于水所得溶液的
pH由大到小依次为 。
②①③
≤
6.如果体内的二氧化碳不能顺利排出,人体血液的pH会 。
偏小
7.正常人体内的下列液体,显酸性且酸性最强的是( )
液 体 血 浆 胰 液 胃 液 唾 液
pH 7.35-7.45 7.5-8.0 0.9-1.5 6.6-7.1
A.血浆 B.胰液 C.胃液 D.唾液
C
课堂巩固
8.用pH试纸测定白醋的酸碱度时,如果先将试纸用蒸馏水润湿,再把白醋滴
到试纸上,测得的结果与白醋实际的pH比较( )
A.偏低 B.偏高 C.相等 D.无法比较
B
9.苯甲酸可用作食品防腐剂,其酸性比醋酸强.
下列对苯甲酸性质的推测不合理的是( )
A.苯甲酸溶液的pH大于7 B.苯甲酸溶液的pH小于7
C.苯甲酸能使紫色石蕊试液变红色 D.苯甲酸不能使无色酚酞试液变色
A
课堂巩固
7.下表为家庭中一些常见物质的PH值
物质 食醋 牙膏 食盐水 肥皂水 火碱液
pH 3 9 7 10 13
蚊子、蜂、蚂蚁等昆虫叮咬人时,会向人体射入一种叫蚁酸(具有酸的性质)的物质,使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的( )
A.牙膏和肥皂水 B.食盐水 C.火碱液 D.食醋
A
pH与人体健康:
在生命长期的进化过程中,人体形成了较为稳定的呈微碱性的内环境,人体体液在正常状态下的pH为 7.04,也就是说,人体在处于偏碱性状态时,是最平衡、最健康的。但由于现代人大量摄入高蛋白、高脂肪的偏酸性食物,容易造成人体体质的酸性化,导致身体机能减弱,新陈代谢变得缓慢,各种代谢废物不容易排出,内脏负担加重,最常见的表现是容易疲劳、上火便秘、感冒,严重的还可能导致高血压等慢性疾病。 反之,当人体处于正常的微碱性状态时,新陈代谢就较为活跃,体内废物容易排出,身体免疫力也较强,不易得病。
pH与人体健康
人体体液的pH值是7.35~7.45时正常;
人体体液的pH值<7.35时,处于亚健康状况;
人体体液的pH值=6.9时,变成植物人;
人体体液的pH值是6.85~6.45时死亡。
pH与智商:
近年来,医学研究发现,人体体液的酸碱度与智商水平有密切关系。在体液酸碱度允许的范围内,酸性偏高者智商较低,碱性偏高则智商较高。科学家测试了数十名6至13岁的男孩,结果表明,大脑皮层中的体液pH大于7.0的孩子,比小于7.0的孩子的智商高出1倍之多。 人们知道,健康人的体液(主要是血液)应呈微碱性(pH约为7.3至7.5),这样有利于机体对蛋白质等营养物质的吸收利用,并使体内的血液循环和免疫系统保持良好状态,人的精力也就显得较为充沛。而有些孩子表现脾气暴躁、多动,学习精力不集中,常感疲乏无力,且易患感冒、龋齿及牙周炎等疾病,其原因可能与体液酸碱度偏高有关。
正常情况下人的血液PH为7.35~7.45之间,高于此数值表明体液呈碱性,低于此表明体液呈酸性。由于生活和环境的影响,多数人为酸性体液,你是不是酸性人呢?
经常头疼 经常有筋疲力尽的感觉 健忘 免疫力差
肠胃不适 皮肤苍白多粉刺 便秘 情绪波动大
易激惹 头发无光泽且易断 龋齿
如果上面症状中有一半以上符合你,那么你就是一个不折不扣的酸性人了。
酸碱误区
误区一:酸碱食物是以口味酸碱来区分并非味觉上有酸味的食品就属于酸性食品,新鲜的成熟水果,即使其味道是酸的,也是碱性生成物。
误区二:酸性食品是坏的,碱性食品是好的将食物以酸碱分为好坏是大错特错,饮食并非“碱性越多越好”,人体有良好的酸碱调节系统,使体液保持相对稳定的酸碱数值,只有平衡才能健康
小测试——你是一个酸性人吗?
https://www.21cnjy.com/help/help_extract.php
