元素周期表的应用
图片预览



文档简介
(共20张PPT)
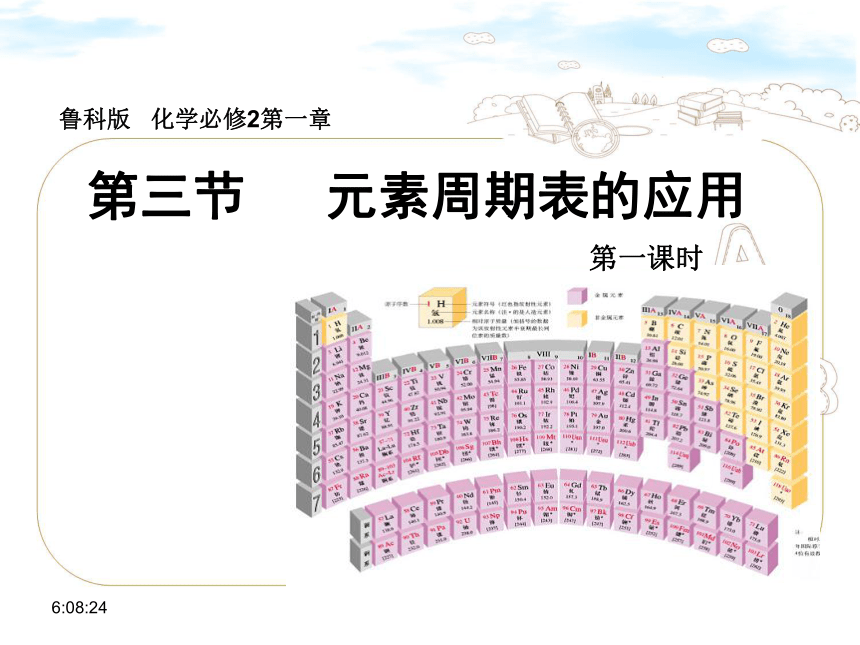
第三节 元素周期表的应用
第一课时
鲁科版 化学必修2第一章
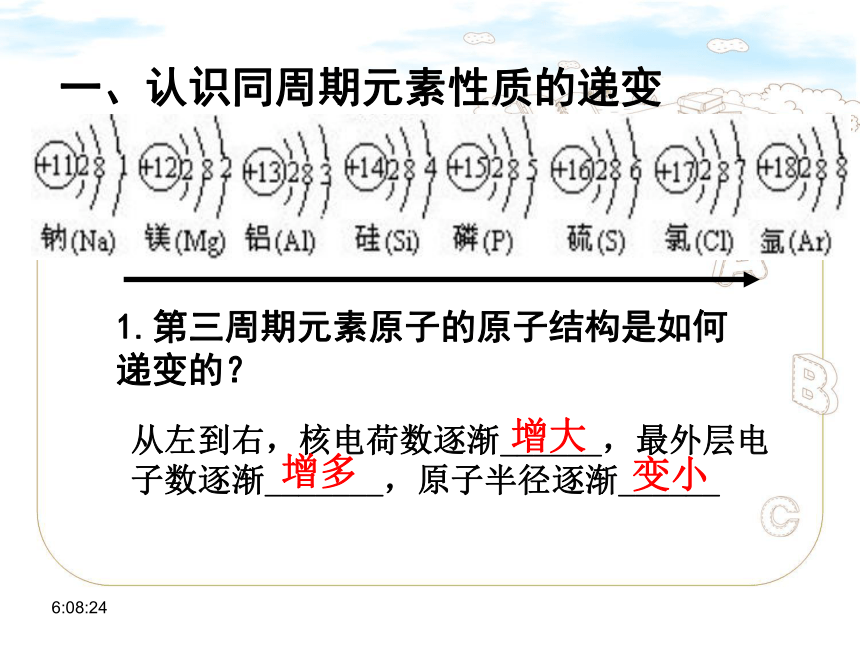
一、认识同周期元素性质的递变
1.第三周期元素原子的原子结构是如何递变的?
从左到右,核电荷数逐渐______,最外层电子数逐渐_______,原子半径逐渐______
增大
增多
变小
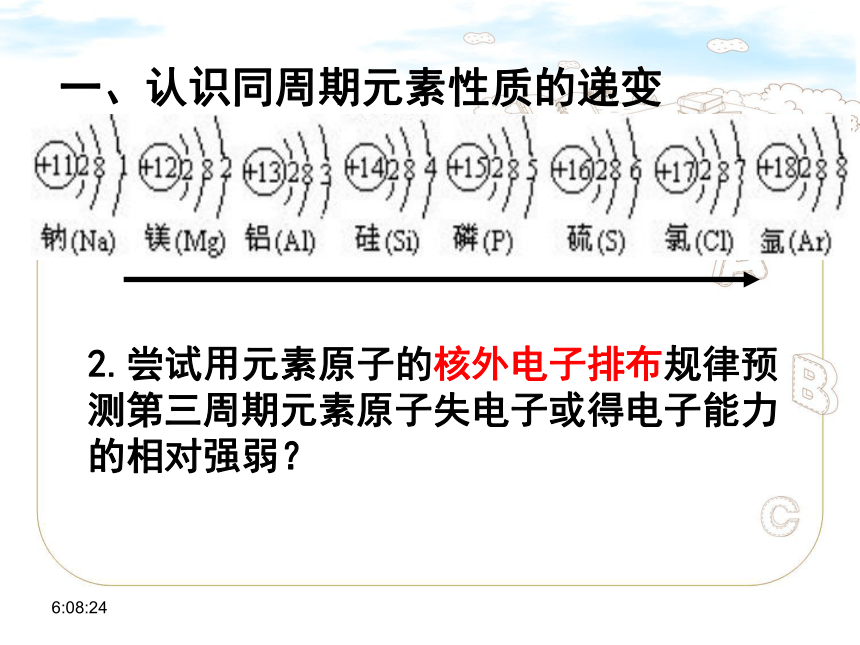
2.尝试用元素原子的核外电子排布规律预测第三周期元素原子失电子或得电子能力的相对强弱?
一、认识同周期元素性质的递变
金属元素
失电子能力的强弱
得电子能力的强弱
非金属元素
稀有气体元素
由方法导引及你对Na、Mg、Al性质的了解,和所提供的实验药品,设计实验方案来验证对Na、Mg、Al失电子能力的预测。
讨论
判断依据
金属单质与水或酸反应置换
出H2的难易程度
金属最高价氧化物对应的水化物
碱性强弱
实验探究
钠、镁、铝失电子能力比较
实验内容 实验现象 结论
Na+H2O
Mg+H2O
Al+H2O
常温下,剧烈反应,有大量气泡产生
加热反应缓慢,
加热无现象
失电子能力:
Na>Mg>Al
提示:镁、铝与水反应时,看不到明显现象,可适当加热,加热至沸腾后立即停止加热,观察现象。
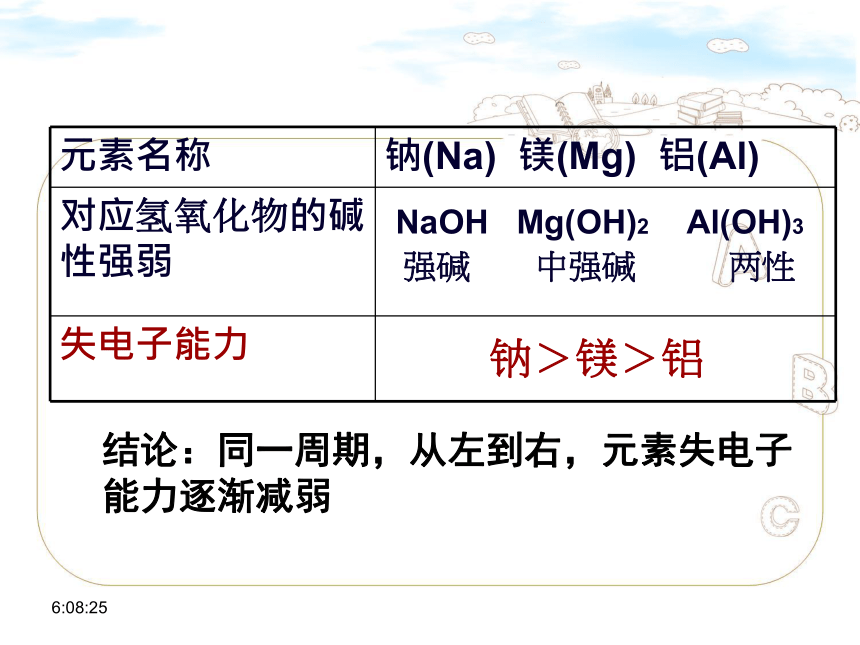
元素名称 钠(Na) 镁(Mg) 铝(Al)
对应氢氧化物的碱性强弱
失电子能力
钠>镁>铝
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性
结论:同一周期,从左到右,元素失电子能力逐渐减弱
同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:XOH、Y(OH)2、Z(OH)3,则:
(1)X、Y、Z的原子序数从小到大的顺序为________
失电子能力的强弱顺序为_____________。
(2)单质与酸反应的剧烈程度_________________
(3)最高价氧化物对应水化物的碱性强弱为_______ _________________________________。
X>Y>Z
XX>Y>Z
XOH>Y(OH)2>Z(OH)3
练习:
方法导引
元素原子得电子能力的强弱,可以采用下列方法间接判断:
1、元素单质与氢气化合的难易程度;
2、比较气态氢化物的稳定性;
3、比较元素最高价氧化物对应水化物的酸性强弱。
元 素 硅 磷 硫 氯
单质与氢气反应条件
气态氢化物 化学式
稳定性
最高价氧化物对应水化物 化学式
酸 性
结 论 得电子能力:
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
高温
蒸汽反应
加热
点燃
或光照
SiH4
PH3
H2S
HCl
逐渐增强
Si同一周期,随着原子序数的增大,各元素失电子能力逐渐减弱,得电子能力逐渐增强。
练习
1、判断下列说法是否正确:
(1) Si、P、S、Cl原子半径依次增大 ( )
(2) PH3、H2S、HCl 稳定性依次增强( )
(3) HClO比H2SO4酸性弱,所以氯的得电子能力比硫弱。 ( )
(4)甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲得电子能力强。
( )
错
对
错
错
2.元素X、Y是同周期的元素,已知X原子比Y原子半径大。
(1)最高价氧化物对应水化物的酸性:X____Y;(填>、<或=,下同)
(2)失电子的能力:X____Y;
(3)气态氢化物的稳定性:X____Y;
<
>
<
小结:
金属单质与水或酸反应置换
出H2的难易程度
金属最高价氧化物对应的水化物
碱性强弱
失电子能力
同一周期,从左到右
失电子能力逐渐减弱,得电子能力逐渐增强。
得电子能力
元素单质与氢气化合的难易程度;
比较气态氢化物的稳定性;
比较元素最高价氧化物对应水化物的酸性强弱
作业:
1、预习第二部分:预测同主族元素 性质递变规律。
2、完成名校学案P14基础演练(一)
综合训练
有A、B、C、D、E五种金属元素。在相同条件下,
①B最高价氧化物对应水化物的碱性比A的强;
②A、B都可以从C的盐溶液中置换出C;
③D与冷水剧烈反应并放出H2;
④A、B、C、E四种金属分别投入盐酸中,只有E不放出H2。
则,这5种金属元素的失电子能力由强到弱的顺序是______________
D>B>A>C>E
第三节 元素周期表的应用
第一课时
鲁科版 化学必修2第一章
一、认识同周期元素性质的递变
1.第三周期元素原子的原子结构是如何递变的?
从左到右,核电荷数逐渐______,最外层电子数逐渐_______,原子半径逐渐______
增大
增多
变小
2.尝试用元素原子的核外电子排布规律预测第三周期元素原子失电子或得电子能力的相对强弱?
一、认识同周期元素性质的递变
金属元素
失电子能力的强弱
得电子能力的强弱
非金属元素
稀有气体元素
由方法导引及你对Na、Mg、Al性质的了解,和所提供的实验药品,设计实验方案来验证对Na、Mg、Al失电子能力的预测。
讨论
判断依据
金属单质与水或酸反应置换
出H2的难易程度
金属最高价氧化物对应的水化物
碱性强弱
实验探究
钠、镁、铝失电子能力比较
实验内容 实验现象 结论
Na+H2O
Mg+H2O
Al+H2O
常温下,剧烈反应,有大量气泡产生
加热反应缓慢,
加热无现象
失电子能力:
Na>Mg>Al
提示:镁、铝与水反应时,看不到明显现象,可适当加热,加热至沸腾后立即停止加热,观察现象。
元素名称 钠(Na) 镁(Mg) 铝(Al)
对应氢氧化物的碱性强弱
失电子能力
钠>镁>铝
NaOH Mg(OH)2 Al(OH)3
强碱 中强碱 两性
结论:同一周期,从左到右,元素失电子能力逐渐减弱
同一周期的X、Y、Z三元素,已知最高价氧化物对应水化物的化学式是:XOH、Y(OH)2、Z(OH)3,则:
(1)X、Y、Z的原子序数从小到大的顺序为________
失电子能力的强弱顺序为_____________。
(2)单质与酸反应的剧烈程度_________________
(3)最高价氧化物对应水化物的碱性强弱为_______ _________________________________。
X>Y>Z
X
XOH>Y(OH)2>Z(OH)3
练习:
方法导引
元素原子得电子能力的强弱,可以采用下列方法间接判断:
1、元素单质与氢气化合的难易程度;
2、比较气态氢化物的稳定性;
3、比较元素最高价氧化物对应水化物的酸性强弱。
元 素 硅 磷 硫 氯
单质与氢气反应条件
气态氢化物 化学式
稳定性
最高价氧化物对应水化物 化学式
酸 性
结 论 得电子能力:
H4SiO4
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
高温
蒸汽反应
加热
点燃
或光照
SiH4
PH3
H2S
HCl
逐渐增强
Si
练习
1、判断下列说法是否正确:
(1) Si、P、S、Cl原子半径依次增大 ( )
(2) PH3、H2S、HCl 稳定性依次增强( )
(3) HClO比H2SO4酸性弱,所以氯的得电子能力比硫弱。 ( )
(4)甲、乙两种非金属元素与金属钠反应时, 甲得电子的数目多,所以甲得电子能力强。
( )
错
对
错
错
2.元素X、Y是同周期的元素,已知X原子比Y原子半径大。
(1)最高价氧化物对应水化物的酸性:X____Y;(填>、<或=,下同)
(2)失电子的能力:X____Y;
(3)气态氢化物的稳定性:X____Y;
<
>
<
小结:
金属单质与水或酸反应置换
出H2的难易程度
金属最高价氧化物对应的水化物
碱性强弱
失电子能力
同一周期,从左到右
失电子能力逐渐减弱,得电子能力逐渐增强。
得电子能力
元素单质与氢气化合的难易程度;
比较气态氢化物的稳定性;
比较元素最高价氧化物对应水化物的酸性强弱
作业:
1、预习第二部分:预测同主族元素 性质递变规律。
2、完成名校学案P14基础演练(一)
综合训练
有A、B、C、D、E五种金属元素。在相同条件下,
①B最高价氧化物对应水化物的碱性比A的强;
②A、B都可以从C的盐溶液中置换出C;
③D与冷水剧烈反应并放出H2;
④A、B、C、E四种金属分别投入盐酸中,只有E不放出H2。
则,这5种金属元素的失电子能力由强到弱的顺序是______________
D>B>A>C>E
