(沪教版)2021-2022学年九年级化学下册同步课件:7.3 几种重要的盐(第1课时)-【24张PPT】
文档属性
| 名称 | (沪教版)2021-2022学年九年级化学下册同步课件:7.3 几种重要的盐(第1课时)-【24张PPT】 |  | |
| 格式 | pptx | ||
| 文件大小 | 58.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-21 14:44:23 | ||
图片预览



文档简介
(共24张PPT)
第7章 应用广泛的酸、碱、盐
第3节 几种重要的盐
(第1课时)
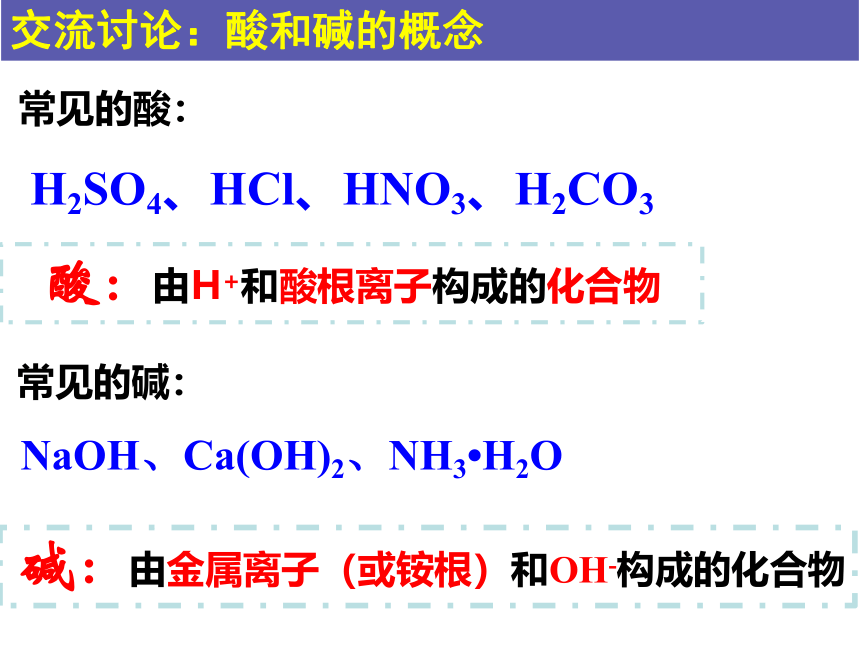
常见的酸:
H2SO4、HCl、HNO3、H2CO3
常见的碱:
NaOH、Ca(OH)2、NH3 H2O
酸:由H+和酸根离子构成的化合物
碱:由金属离子(或铵根)和OH-构成的化合物
交流讨论:酸和碱的概念
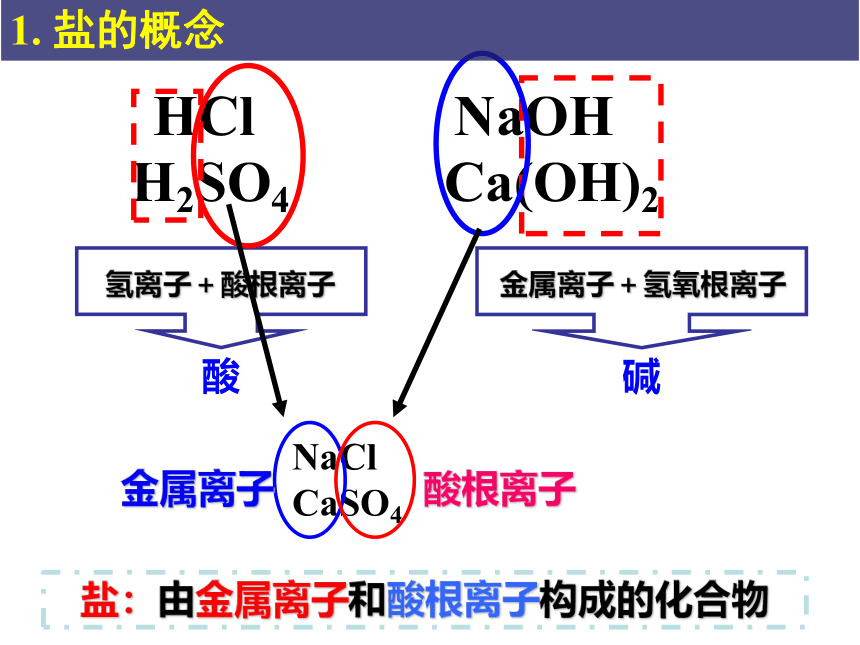
HCl
H2SO4
NaOH
Ca(OH)2
氢离子+酸根离子
金属离子+氢氧根离子
酸
碱
盐:由金属离子和酸根离子构成的化合物
NaCl
CaSO4
金属离子
酸根离子
1. 盐的概念
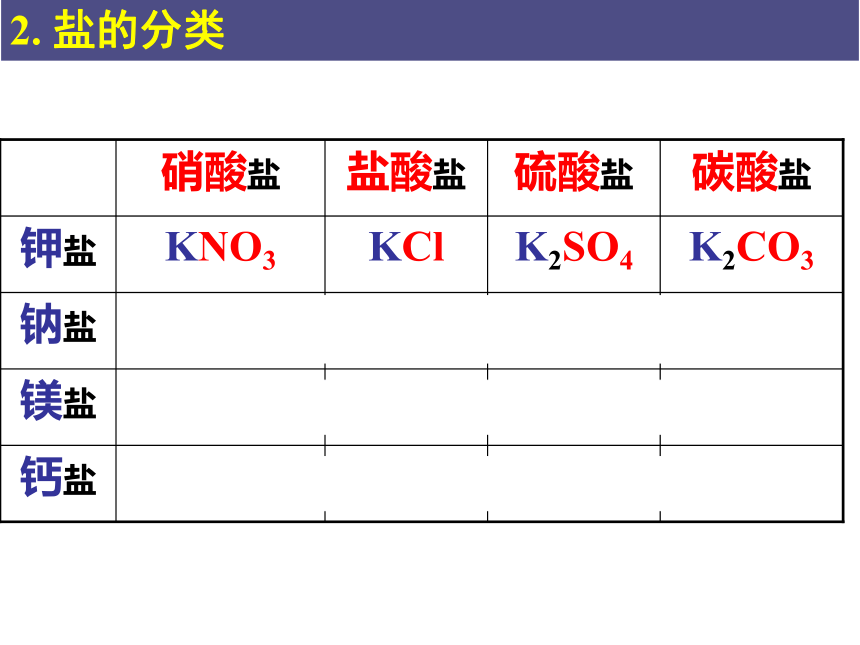
CaCO3
CaSO4
CaCl2
Ca(NO3)2
钙盐
MgCO3
MgSO4
MgCl2
Mg(NO3)2
镁盐
Na2CO3
Na2SO4
NaCl
NaNO3
钠盐
K2CO3
K2SO4
KCl
KNO3
钾盐
碳酸盐
硫酸盐
盐酸盐
硝酸盐
2. 盐的分类
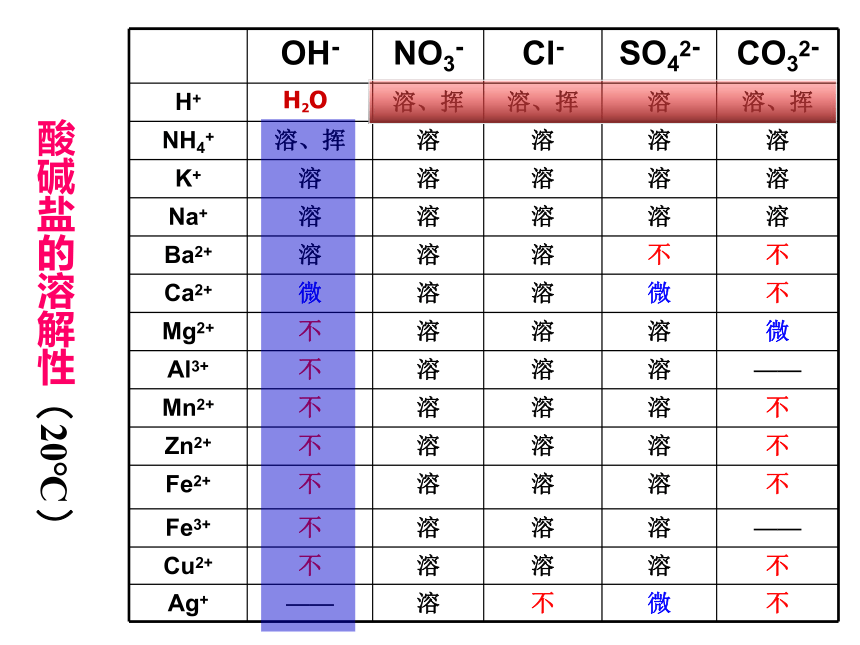
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 不
Ag+ —— 溶 不 微 不
酸碱盐的溶解性(20℃)
H2O
(1)钾盐、钠盐、铵盐、硝酸盐在水中都可溶;
(2)盐酸盐除氯化银难溶于水外,其余都可溶;
(4)碳酸盐中除碳酸钾、碳酸钠、碳酸铵可溶于水,碳酸镁微溶于水外,其余都难溶。
(3)硫酸盐除硫酸钡难溶于水,硫酸钙、硫酸银微溶于水外,其余都可溶;
3. 盐的溶解性
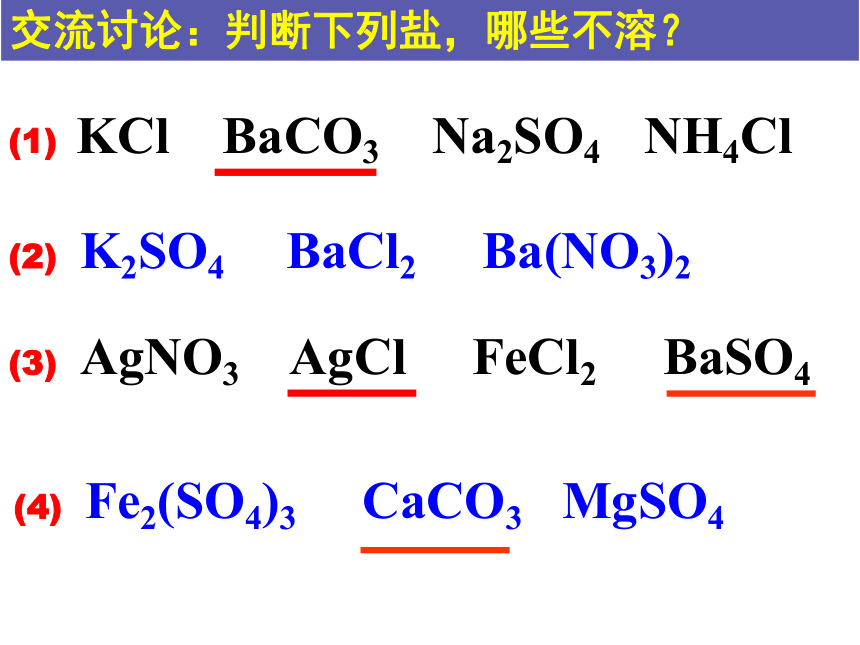
(1) KCl BaCO3 Na2SO4 NH4Cl
(2) K2SO4 BaCl2 Ba(NO3)2
(3) AgNO3 AgCl FeCl2 BaSO4
(4) Fe2(SO4)3 CaCO3 MgSO4
交流讨论:判断下列盐,哪些不溶?
白色沉淀: 氯化银 AgCl
硫酸钡 BaSO4
碳酸钙 CaCO3
碳酸钡 BaCO3
氢氧化镁 Mg(OH)2
氢氧化铝 Al(OH)3
蓝色沉淀:氢氧化铜 Cu(OH)2
红褐色沉淀:氢氧化铁 Fe(OH)3
初中化学常见8大沉淀
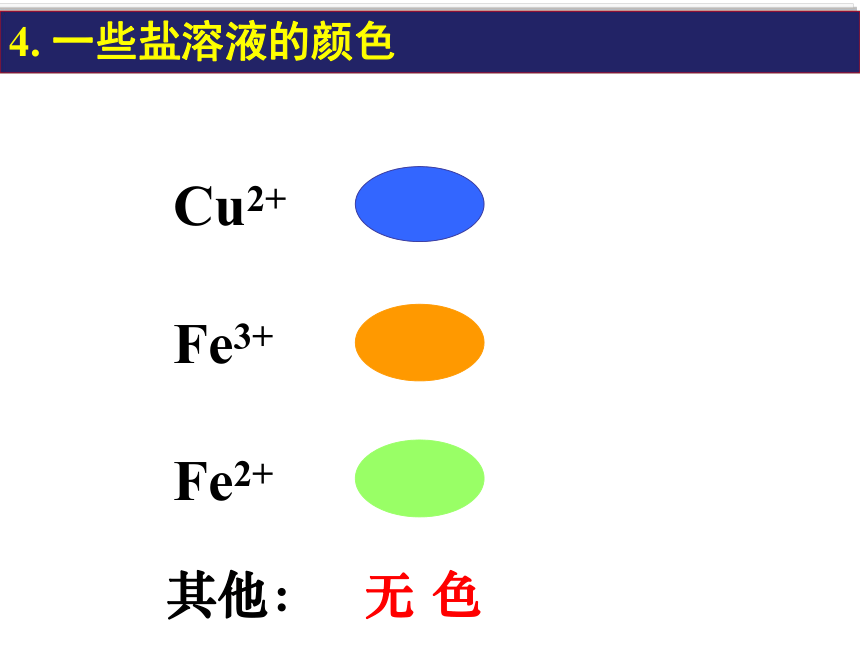
4. 一些盐溶液的颜色
Cu2+
Fe3+
Fe2+
其他:
无 色
实验操作 实验现象
Fe +CuSO4
Al+ CuSO4
Cu + AgNO3
(1)盐 + 金属 = 新盐 + 新金属
5. 盐的化学性质
反应条件:
(1)盐必须溶于水;
(2)金属单质除K、Ca、Na外;
(3)金属的活动性比盐中金属活动性强。
5. 盐的化学性质
(1)盐 + 金属 = 新盐 + 新金属
反应条件:
生成物中有沉淀或气体或水
AgNO3 + HCl =
BaCl2 + H2SO4 =
(2) 盐 + 酸 = 新盐 + 新酸
5. 盐的化学性质
反应条件:
(1)反应物两者均可溶;
(2)生成物有沉淀或气体或水。
Na2CO3 + Ca(OH)2 =
FeCl3 + 3NaOH =
(3) 盐 + 碱 = 新盐 + 新碱
5. 盐的化学性质
AgNO3 + NaCl =
BaCl2 + Na2SO4 =
反应条件:
(1)反应物两者均可溶;
(2)生成物有沉淀。
(4)盐1 + 盐2 = 新盐1 + 新盐2
5. 盐的化学性质
1、盐 + 金属 = 新盐 + 新金属
2、盐 + 酸 = 新盐 + 新酸
3、盐 + 碱 = 新盐 + 新碱
4、盐 + 盐 = 新盐 + 新盐
复分解反应
置换反应
5. 盐的化学性质
化合物
化合物
化合物
化合物
复分解反应
(1)HCl + NaOH == H2O + NaCl
(2)CaCO3 + 2HCl == CaCl2 + H2CO3
(3)Na2CO3 + 2HCl == 2NaCl + H2CO3
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
H2O+CO2↑
H2O+CO2↑
什么条件下复分解反应才能发生呢?
+
+
AB + CD → AD + CB
特点:双交换,价不变
复分解反应的特点
生成沉淀:当反应中有难溶或微溶的物质生成,溶液中就会出现沉淀。
(即通常所说“变浑浊”)
复分解反应发生的条件:
①生成水;②生成气体;③生成沉淀。 (满足一条即可)
H+、Cl-
Na+、CO3 2 -
Na+、Cl-
反应前
反应后
溶液中离子种类发生改变
2HCl+Na2CO3 ——
2NaCl+ + H2O
——
CO2↑
复分解反应发生时的离子变化
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na2SO4 + KNO3 —
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
实质
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断 依据
能
有水生成
不能
能
能
无气体、无沉淀、无水生成
有气体生成
有沉淀生成
探究
某些酸、碱、盐之间是否发生反应
(1)NaOH+H2SO4=
(2)NaCl+H2SO4=
(3)K2CO3+H2SO4=
(4)Ba(NO3)2+H2SO4=
【课堂训练】
1.下列盐可由金属与酸发生置换反应生成的是( )
A.FeCl2 B.FeCl3
C.ZnSO4 D.CuSO4
AC
2. 请根据课本的“酸、碱、盐的溶解性表”,判断下列盐的溶解性,其中难溶于水的有 。
① KCl ② Na2CO3 ③ (NH4)2SO4
④ Ba(NO3)2 ⑤ BaSO4 ⑥ AgCl
⑦ K2CO3 ⑧ CuCO3
【课堂训练】
⑤⑥⑧
【课堂训练】
3.下列复分解反应不能发生的是( )
A.NaNO3 + KCl = NaCl + KNO3
B.Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C.BaCl2 + H2SO4 = BaSO4↓ + 2HCl
D.2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
A
第7章 应用广泛的酸、碱、盐
第3节 几种重要的盐
(第1课时)
常见的酸:
H2SO4、HCl、HNO3、H2CO3
常见的碱:
NaOH、Ca(OH)2、NH3 H2O
酸:由H+和酸根离子构成的化合物
碱:由金属离子(或铵根)和OH-构成的化合物
交流讨论:酸和碱的概念
HCl
H2SO4
NaOH
Ca(OH)2
氢离子+酸根离子
金属离子+氢氧根离子
酸
碱
盐:由金属离子和酸根离子构成的化合物
NaCl
CaSO4
金属离子
酸根离子
1. 盐的概念
CaCO3
CaSO4
CaCl2
Ca(NO3)2
钙盐
MgCO3
MgSO4
MgCl2
Mg(NO3)2
镁盐
Na2CO3
Na2SO4
NaCl
NaNO3
钠盐
K2CO3
K2SO4
KCl
KNO3
钾盐
碳酸盐
硫酸盐
盐酸盐
硝酸盐
2. 盐的分类
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 不
Ag+ —— 溶 不 微 不
酸碱盐的溶解性(20℃)
H2O
(1)钾盐、钠盐、铵盐、硝酸盐在水中都可溶;
(2)盐酸盐除氯化银难溶于水外,其余都可溶;
(4)碳酸盐中除碳酸钾、碳酸钠、碳酸铵可溶于水,碳酸镁微溶于水外,其余都难溶。
(3)硫酸盐除硫酸钡难溶于水,硫酸钙、硫酸银微溶于水外,其余都可溶;
3. 盐的溶解性
(1) KCl BaCO3 Na2SO4 NH4Cl
(2) K2SO4 BaCl2 Ba(NO3)2
(3) AgNO3 AgCl FeCl2 BaSO4
(4) Fe2(SO4)3 CaCO3 MgSO4
交流讨论:判断下列盐,哪些不溶?
白色沉淀: 氯化银 AgCl
硫酸钡 BaSO4
碳酸钙 CaCO3
碳酸钡 BaCO3
氢氧化镁 Mg(OH)2
氢氧化铝 Al(OH)3
蓝色沉淀:氢氧化铜 Cu(OH)2
红褐色沉淀:氢氧化铁 Fe(OH)3
初中化学常见8大沉淀
4. 一些盐溶液的颜色
Cu2+
Fe3+
Fe2+
其他:
无 色
实验操作 实验现象
Fe +CuSO4
Al+ CuSO4
Cu + AgNO3
(1)盐 + 金属 = 新盐 + 新金属
5. 盐的化学性质
反应条件:
(1)盐必须溶于水;
(2)金属单质除K、Ca、Na外;
(3)金属的活动性比盐中金属活动性强。
5. 盐的化学性质
(1)盐 + 金属 = 新盐 + 新金属
反应条件:
生成物中有沉淀或气体或水
AgNO3 + HCl =
BaCl2 + H2SO4 =
(2) 盐 + 酸 = 新盐 + 新酸
5. 盐的化学性质
反应条件:
(1)反应物两者均可溶;
(2)生成物有沉淀或气体或水。
Na2CO3 + Ca(OH)2 =
FeCl3 + 3NaOH =
(3) 盐 + 碱 = 新盐 + 新碱
5. 盐的化学性质
AgNO3 + NaCl =
BaCl2 + Na2SO4 =
反应条件:
(1)反应物两者均可溶;
(2)生成物有沉淀。
(4)盐1 + 盐2 = 新盐1 + 新盐2
5. 盐的化学性质
1、盐 + 金属 = 新盐 + 新金属
2、盐 + 酸 = 新盐 + 新酸
3、盐 + 碱 = 新盐 + 新碱
4、盐 + 盐 = 新盐 + 新盐
复分解反应
置换反应
5. 盐的化学性质
化合物
化合物
化合物
化合物
复分解反应
(1)HCl + NaOH == H2O + NaCl
(2)CaCO3 + 2HCl == CaCl2 + H2CO3
(3)Na2CO3 + 2HCl == 2NaCl + H2CO3
(4)Na2CO3 + Ca(OH)2== 2NaOH + CaCO3↓
H2O+CO2↑
H2O+CO2↑
什么条件下复分解反应才能发生呢?
+
+
AB + CD → AD + CB
特点:双交换,价不变
复分解反应的特点
生成沉淀:当反应中有难溶或微溶的物质生成,溶液中就会出现沉淀。
(即通常所说“变浑浊”)
复分解反应发生的条件:
①生成水;②生成气体;③生成沉淀。 (满足一条即可)
H+、Cl-
Na+、CO3 2 -
Na+、Cl-
反应前
反应后
溶液中离子种类发生改变
2HCl+Na2CO3 ——
2NaCl+ + H2O
——
CO2↑
复分解反应发生时的离子变化
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na2SO4 + KNO3 —
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
实质
根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸
判断 依据
能
有水生成
不能
能
能
无气体、无沉淀、无水生成
有气体生成
有沉淀生成
探究
某些酸、碱、盐之间是否发生反应
(1)NaOH+H2SO4=
(2)NaCl+H2SO4=
(3)K2CO3+H2SO4=
(4)Ba(NO3)2+H2SO4=
【课堂训练】
1.下列盐可由金属与酸发生置换反应生成的是( )
A.FeCl2 B.FeCl3
C.ZnSO4 D.CuSO4
AC
2. 请根据课本的“酸、碱、盐的溶解性表”,判断下列盐的溶解性,其中难溶于水的有 。
① KCl ② Na2CO3 ③ (NH4)2SO4
④ Ba(NO3)2 ⑤ BaSO4 ⑥ AgCl
⑦ K2CO3 ⑧ CuCO3
【课堂训练】
⑤⑥⑧
【课堂训练】
3.下列复分解反应不能发生的是( )
A.NaNO3 + KCl = NaCl + KNO3
B.Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
C.BaCl2 + H2SO4 = BaSO4↓ + 2HCl
D.2HNO3 + Ca(OH)2 = Ca(NO3)2 + 2H2O
A
