2021-2022学年沪教版九年级化学下册 7.2 常见的酸 同步测试(WORD版,含答案)
文档属性
| 名称 | 2021-2022学年沪教版九年级化学下册 7.2 常见的酸 同步测试(WORD版,含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 395.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-23 13:21:13 | ||
图片预览


文档简介
7.2 常见的酸 同步测试
一、单项选择题(本题共15小题)
1.化学与生活密切相关,生活中的下列做法合理的是( )
A.用钢丝球擦洗铝锅表面污垢
B.用浓硫酸做食品干燥剂
C.用氢氧化钠中和酸性土壤
D.用稀硫酸除去铁钉表面的铁锈
2.下列现象和事实,可用金属活动性作出合理解释的是( )
①相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的金属活动性强
②用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放
③尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在
④金属铝比金属锌更耐腐蚀,说明锌比铝的金属活动性强
A.①②③ B.①②
C.③④ D.①②③④
3.已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。为探究铜和浓硫酸的反应及生成的二氧化硫气体的部分性质,某同学设计右图实验(图中脱脂棉团蘸有紫色石蕊溶液)。关于该实验的说法错误的是( )
A.与鼓气球相连接的导管需插入浓硫酸中
B.该装置便于控制铜和浓硫酸反应的发生和停止
C.铜丝绕成螺旋状是为了加快铜和浓硫酸的反应
D.实验中可观察到脱脂棉团变红
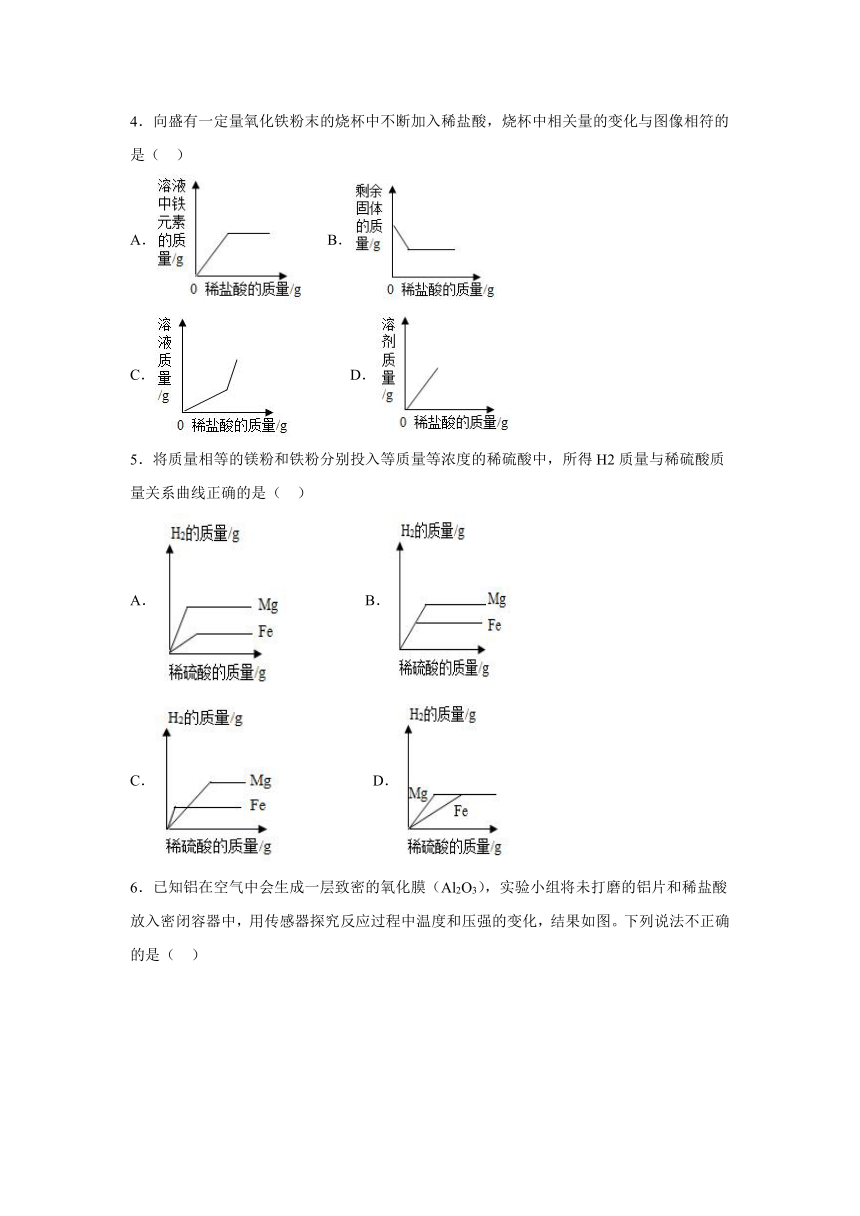
4.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
A. B.
C. D.
5.将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是( )
A. B.
C. D.
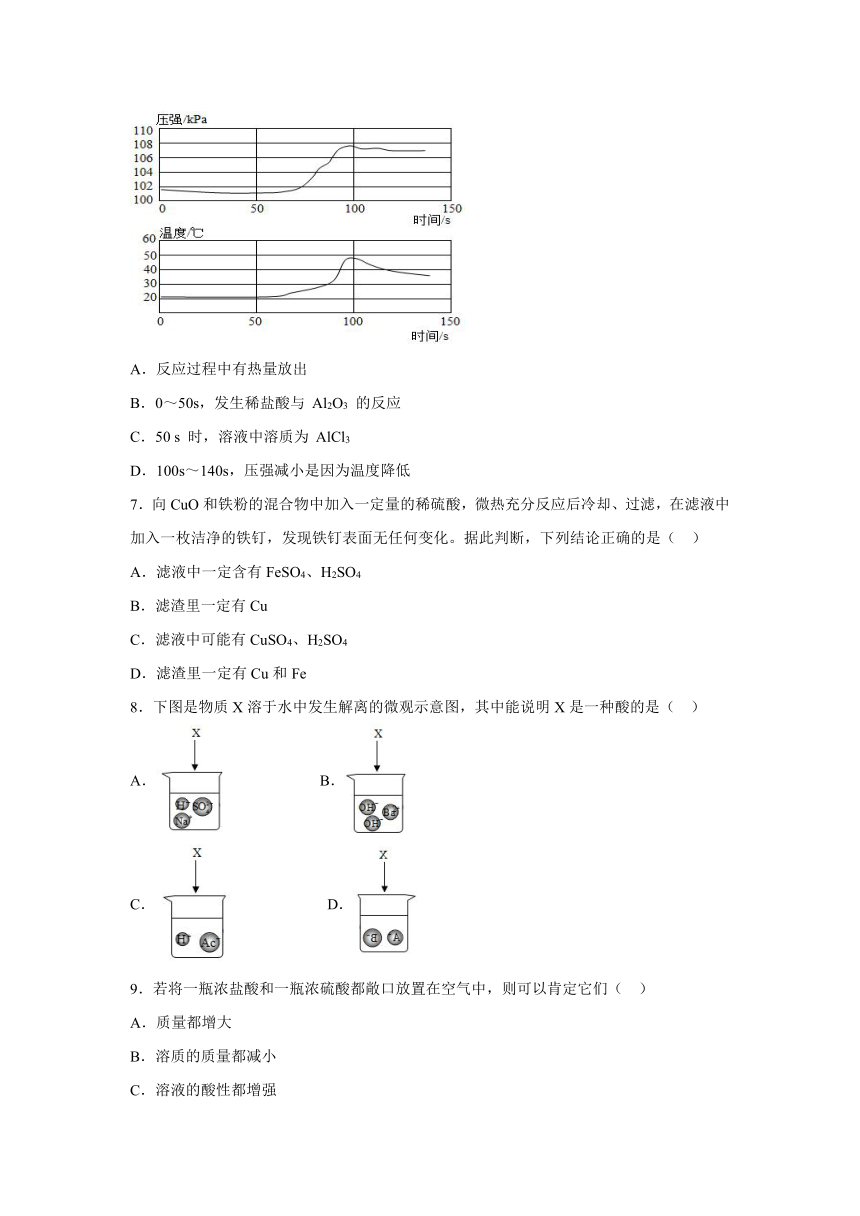
6.已知铝在空气中会生成一层致密的氧化膜(Al2O3),实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法不正确的是( )
A.反应过程中有热量放出
B.0~50s,发生稀盐酸与 Al2O3 的反应
C.50 s 时,溶液中溶质为 AlCl3
D.100s~140s,压强减小是因为温度降低
7.向CuO和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤,在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化。据此判断,下列结论正确的是( )
A.滤液中一定含有FeSO4、H2SO4
B.滤渣里一定有Cu
C.滤液中可能有CuSO4、H2SO4
D.滤渣里一定有Cu和Fe
8.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A. B.
C. D.
9.若将一瓶浓盐酸和一瓶浓硫酸都敞口放置在空气中,则可以肯定它们( )
A.质量都增大
B.溶质的质量都减小
C.溶液的酸性都增强
D.溶质质量分数都增小
10.下列关于稀盐酸化学性质的描述中,不属于酸的共同性质的是( )
A.能与氧化铝反应生成盐和水
B.能使石蕊试液变红色
C.能与氢氧化钠反应生成水
D.能与AgNO3溶液反应生成白色沉淀
11.运输浓硫酸的罐车应贴的安全警示标志是( )
A. B.
C. D.
12.关于硫酸的说法错误的是( )
A.稀硫酸与锌反应可制得氢气
B.稀硫酸可用于除铁锈
C.可将水注入浓硫酸中进行稀释
D.浓硫酸可用来干燥氢气
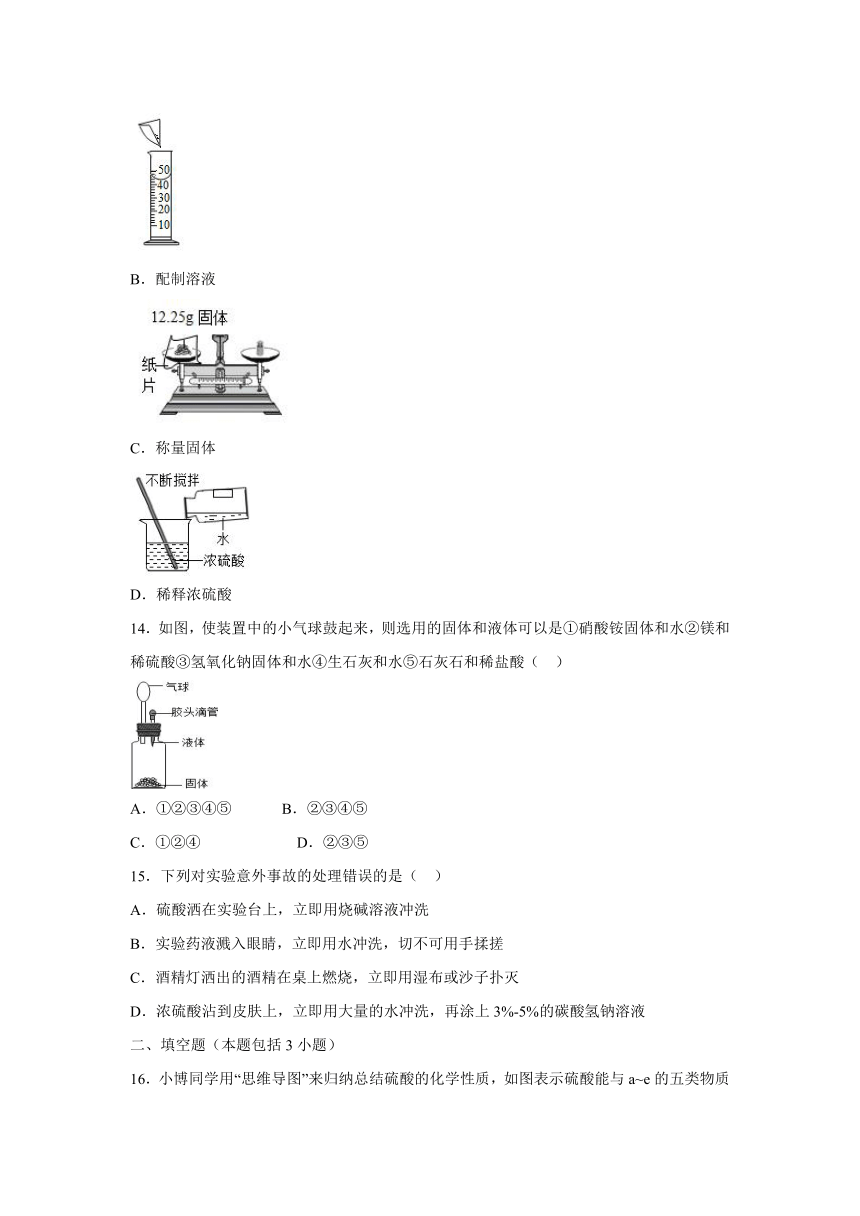
13.正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )
A.测定溶液pH
B.配制溶液
C.称量固体
D.稀释浓硫酸
14.如图,使装置中的小气球鼓起来,则选用的固体和液体可以是①硝酸铵固体和水②镁和稀硫酸③氢氧化钠固体和水④生石灰和水⑤石灰石和稀盐酸( )
A.①②③④⑤ B.②③④⑤
C.①②④ D.②③⑤
15.下列对实验意外事故的处理错误的是( )
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%-5%的碳酸氢钠溶液
二、填空题(本题包括3小题)
16.小博同学用“思维导图”来归纳总结硫酸的化学性质,如图表示硫酸能与a~e的五类物质反应,请你回答下列问题。
(1)a 为石蕊试液,反应的现象是_____。
(2)b 是活泼金属,以地壳中含量最多的金属元素为例,写出反应的化学方程式:_____。
(3)e 是盐,写出有气体生成的反应的化学方程式:_____。
(4)c 是金属氧化物,所属反应类型是;_____;d是哪一类物质?_____。
(5)工业上可用e与d反应制烧碱,反应的化学方程式为_____。
17.为了探究金属Mg、Zn、Fe的活动性顺序,某研究性学习小组设计了如图甲的实验。实验步骤如下:①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上。
实验预测与分析:
(1)写出铁与盐酸反应的化学方程式为___________;
(2)气球膨胀速度最快的是____________;(填试管编号)
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是______________;
(4)若将质量相等的铝粉和铁粉分别与相同质量、相同浓度的稀硫酸反应。反应情况如图中乙所示,下列叙述与图象情况符合的是______________。
A.铝粉、铁粉和硫酸均有剩余
B.铝粉、铁粉均反应完,硫酸有剩余
C.硫酸、铝粉均反应完,铁粉有剩余
D.硫酸、铁粉均反应完,铝粉有剩余
18.请按要求完成下列金属性质的实验:
研究一:金属与酸反应过程中的能量变化。
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应_____(填“吸热”或“放热”),反应的化学方程式为_____ 。
(2)实验测得反应中产生的气体的速率(v)与时间(t)的关系如图1,请根据t1﹣t2时间段反应速率变化,说明化学反应速率受_____等因素影响。
研究二:金属与盐溶液反应过程中的相关变化。
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为_____ 。
(2)在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,图2描述相关变化曲线,一定不正确的是_____ 。
19.阅读下列短文,回答有关问题:
钛因为具有神奇的性能越来越引起人们的关注。钛是一种银白色金属,化学性质比较活泼,加热时能与O2、N2等非金属反应。但在常温下,钛表面易生成一层极薄的致密的氧化物保护膜,可以抵抗强酸甚至王水的作用。钛的硬度与钢铁差不多,而它的重量几乎只有同体积的钢铁的一半。钛合金制成的飞机比其他金属制成同样重的飞机多载客100多人。钛无毒且与人体组织及血液有好的相容性,所以被医疗界广泛采用。地壳中含钛的矿石之一为金红石(TiO2 ),目前大规模生产Ti的方法是:先将金红石和过量炭粉的混合物在高温条件下通入Cl2制得TiCl4和一种可燃性气体,然后在氩气的环境中,用过量的Mg在加热条件下与TiCl4反应制得金属钛。
(1)金属钛的物理性质有 _____(写一点即可),钛合金属于 _____(填“纯净物”或 “混合物”)。
(2)钛可以抵抗强酸甚至王水的作用,其原因是 _____。
(3)在生产钛的过程中生成的可燃性气体是 _____(写化学式),写出Mg与TiCl4发生置换反应的化学方程式 _____。
(4)如果要比较钛和铁的金属活动性顺序,以下方法能达到目的的是 _____。
A. 查阅初中化学课本上的金属活动性顺序表
B. 利用金属钛和FeCl2溶液进行实验
C. 利用金属钛和金属铁分别与稀硫酸反应
D. 利用金属铁和TiSO4溶液进行实验
参考答案
1-15 DAAAB CBCDD ACABA
一、单项选择题(本题共15小题)
1.化学与生活密切相关,生活中的下列做法合理的是( )
A.用钢丝球擦洗铝锅表面污垢
B.用浓硫酸做食品干燥剂
C.用氢氧化钠中和酸性土壤
D.用稀硫酸除去铁钉表面的铁锈
2.下列现象和事实,可用金属活动性作出合理解释的是( )
①相同几何外形的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的金属活动性强
②用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放
③尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在
④金属铝比金属锌更耐腐蚀,说明锌比铝的金属活动性强
A.①②③ B.①②
C.③④ D.①②③④
3.已知:Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O。为探究铜和浓硫酸的反应及生成的二氧化硫气体的部分性质,某同学设计右图实验(图中脱脂棉团蘸有紫色石蕊溶液)。关于该实验的说法错误的是( )
A.与鼓气球相连接的导管需插入浓硫酸中
B.该装置便于控制铜和浓硫酸反应的发生和停止
C.铜丝绕成螺旋状是为了加快铜和浓硫酸的反应
D.实验中可观察到脱脂棉团变红
4.向盛有一定量氧化铁粉末的烧杯中不断加入稀盐酸,烧杯中相关量的变化与图像相符的是( )
A. B.
C. D.
5.将质量相等的镁粉和铁粉分别投入等质量等浓度的稀硫酸中,所得H2质量与稀硫酸质量关系曲线正确的是( )
A. B.
C. D.
6.已知铝在空气中会生成一层致密的氧化膜(Al2O3),实验小组将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,结果如图。下列说法不正确的是( )
A.反应过程中有热量放出
B.0~50s,发生稀盐酸与 Al2O3 的反应
C.50 s 时,溶液中溶质为 AlCl3
D.100s~140s,压强减小是因为温度降低
7.向CuO和铁粉的混合物中加入一定量的稀硫酸,微热充分反应后冷却、过滤,在滤液中加入一枚洁净的铁钉,发现铁钉表面无任何变化。据此判断,下列结论正确的是( )
A.滤液中一定含有FeSO4、H2SO4
B.滤渣里一定有Cu
C.滤液中可能有CuSO4、H2SO4
D.滤渣里一定有Cu和Fe
8.下图是物质X溶于水中发生解离的微观示意图,其中能说明X是一种酸的是( )
A. B.
C. D.
9.若将一瓶浓盐酸和一瓶浓硫酸都敞口放置在空气中,则可以肯定它们( )
A.质量都增大
B.溶质的质量都减小
C.溶液的酸性都增强
D.溶质质量分数都增小
10.下列关于稀盐酸化学性质的描述中,不属于酸的共同性质的是( )
A.能与氧化铝反应生成盐和水
B.能使石蕊试液变红色
C.能与氢氧化钠反应生成水
D.能与AgNO3溶液反应生成白色沉淀
11.运输浓硫酸的罐车应贴的安全警示标志是( )
A. B.
C. D.
12.关于硫酸的说法错误的是( )
A.稀硫酸与锌反应可制得氢气
B.稀硫酸可用于除铁锈
C.可将水注入浓硫酸中进行稀释
D.浓硫酸可用来干燥氢气
13.正确规范的操作是实验成功和人身安全的重要保证。下列实验操作正确的是( )
A.测定溶液pH
B.配制溶液
C.称量固体
D.稀释浓硫酸
14.如图,使装置中的小气球鼓起来,则选用的固体和液体可以是①硝酸铵固体和水②镁和稀硫酸③氢氧化钠固体和水④生石灰和水⑤石灰石和稀盐酸( )
A.①②③④⑤ B.②③④⑤
C.①②④ D.②③⑤
15.下列对实验意外事故的处理错误的是( )
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上3%-5%的碳酸氢钠溶液
二、填空题(本题包括3小题)
16.小博同学用“思维导图”来归纳总结硫酸的化学性质,如图表示硫酸能与a~e的五类物质反应,请你回答下列问题。
(1)a 为石蕊试液,反应的现象是_____。
(2)b 是活泼金属,以地壳中含量最多的金属元素为例,写出反应的化学方程式:_____。
(3)e 是盐,写出有气体生成的反应的化学方程式:_____。
(4)c 是金属氧化物,所属反应类型是;_____;d是哪一类物质?_____。
(5)工业上可用e与d反应制烧碱,反应的化学方程式为_____。
17.为了探究金属Mg、Zn、Fe的活动性顺序,某研究性学习小组设计了如图甲的实验。实验步骤如下:①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液,②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上。
实验预测与分析:
(1)写出铁与盐酸反应的化学方程式为___________;
(2)气球膨胀速度最快的是____________;(填试管编号)
(3)该实验表明,实验室一般选用锌而不选用镁、铁制取氢气的主要原因是______________;
(4)若将质量相等的铝粉和铁粉分别与相同质量、相同浓度的稀硫酸反应。反应情况如图中乙所示,下列叙述与图象情况符合的是______________。
A.铝粉、铁粉和硫酸均有剩余
B.铝粉、铁粉均反应完,硫酸有剩余
C.硫酸、铝粉均反应完,铁粉有剩余
D.硫酸、铁粉均反应完,铝粉有剩余
18.请按要求完成下列金属性质的实验:
研究一:金属与酸反应过程中的能量变化。
(1)打磨后的镁条与稀盐酸反应,试管外壁发烫,说明该反应_____(填“吸热”或“放热”),反应的化学方程式为_____ 。
(2)实验测得反应中产生的气体的速率(v)与时间(t)的关系如图1,请根据t1﹣t2时间段反应速率变化,说明化学反应速率受_____等因素影响。
研究二:金属与盐溶液反应过程中的相关变化。
(1)某同学用硫酸铜溶液把“铁勺”变“铜勺”,其反应的化学方程式为_____ 。
(2)在一定量AgNO3和Cu(NO3)2的混合溶液中加入铁粉,充分反应后,图2描述相关变化曲线,一定不正确的是_____ 。
19.阅读下列短文,回答有关问题:
钛因为具有神奇的性能越来越引起人们的关注。钛是一种银白色金属,化学性质比较活泼,加热时能与O2、N2等非金属反应。但在常温下,钛表面易生成一层极薄的致密的氧化物保护膜,可以抵抗强酸甚至王水的作用。钛的硬度与钢铁差不多,而它的重量几乎只有同体积的钢铁的一半。钛合金制成的飞机比其他金属制成同样重的飞机多载客100多人。钛无毒且与人体组织及血液有好的相容性,所以被医疗界广泛采用。地壳中含钛的矿石之一为金红石(TiO2 ),目前大规模生产Ti的方法是:先将金红石和过量炭粉的混合物在高温条件下通入Cl2制得TiCl4和一种可燃性气体,然后在氩气的环境中,用过量的Mg在加热条件下与TiCl4反应制得金属钛。
(1)金属钛的物理性质有 _____(写一点即可),钛合金属于 _____(填“纯净物”或 “混合物”)。
(2)钛可以抵抗强酸甚至王水的作用,其原因是 _____。
(3)在生产钛的过程中生成的可燃性气体是 _____(写化学式),写出Mg与TiCl4发生置换反应的化学方程式 _____。
(4)如果要比较钛和铁的金属活动性顺序,以下方法能达到目的的是 _____。
A. 查阅初中化学课本上的金属活动性顺序表
B. 利用金属钛和FeCl2溶液进行实验
C. 利用金属钛和金属铁分别与稀硫酸反应
D. 利用金属铁和TiSO4溶液进行实验
参考答案
1-15 DAAAB CBCDD ACABA
