6.3物质的溶解性达标训练-2021-2022学年九年级化学沪教版下册(word版含解析)
文档属性
| 名称 | 6.3物质的溶解性达标训练-2021-2022学年九年级化学沪教版下册(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 98.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-09 23:18:33 | ||
图片预览


文档简介
6.1物质的溶解性 达标训练
一、单选题
1.通常情况下,将一杯不饱和的蔗糖溶液变成饱和溶液,最适宜的方法是( )
A. 加蔗糖 B. 加水 C. 升温 D. 增大压强
2.下列有关溶液的说法中,正确的是
A.饱和溶液一定比不饱和溶液所含的溶质多
B.不饱和溶液都可以通过降低温度的方法变成饱和溶液
C.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小
3.降低温度使氯化钠饱和溶液析出晶体前后,不改变的是
A.溶解度 B.溶剂质量 C.溶液质量 D.溶质质量
4.关于溶解度说法正确的是
A.硝酸钾的溶解度为222g/100g 水 B.溶解度随温度升高而升高
C.难溶物质的溶解度为零 D.溶解度可以定量的表示物质溶解性的大小
5.60℃时,化合物甲的溶解度比乙的大。分别取等质量60℃时的甲、乙饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水)。以下叙述中正确的是( )
A. 60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量小
B. a一定大于b
C. 20℃时,若甲的溶解度比乙的小,则a一定大于b
D. 20℃时,若甲的溶解度仍比乙的大,则a一定小于b
6.如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( )
A.甲和丙的溶解度相等
B.在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g
C.t2℃时,等质量的甲、乙、丙三种固体配制成饱和溶液所需溶剂质量的大小关系是甲<乙<丙
D.将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>乙>丙
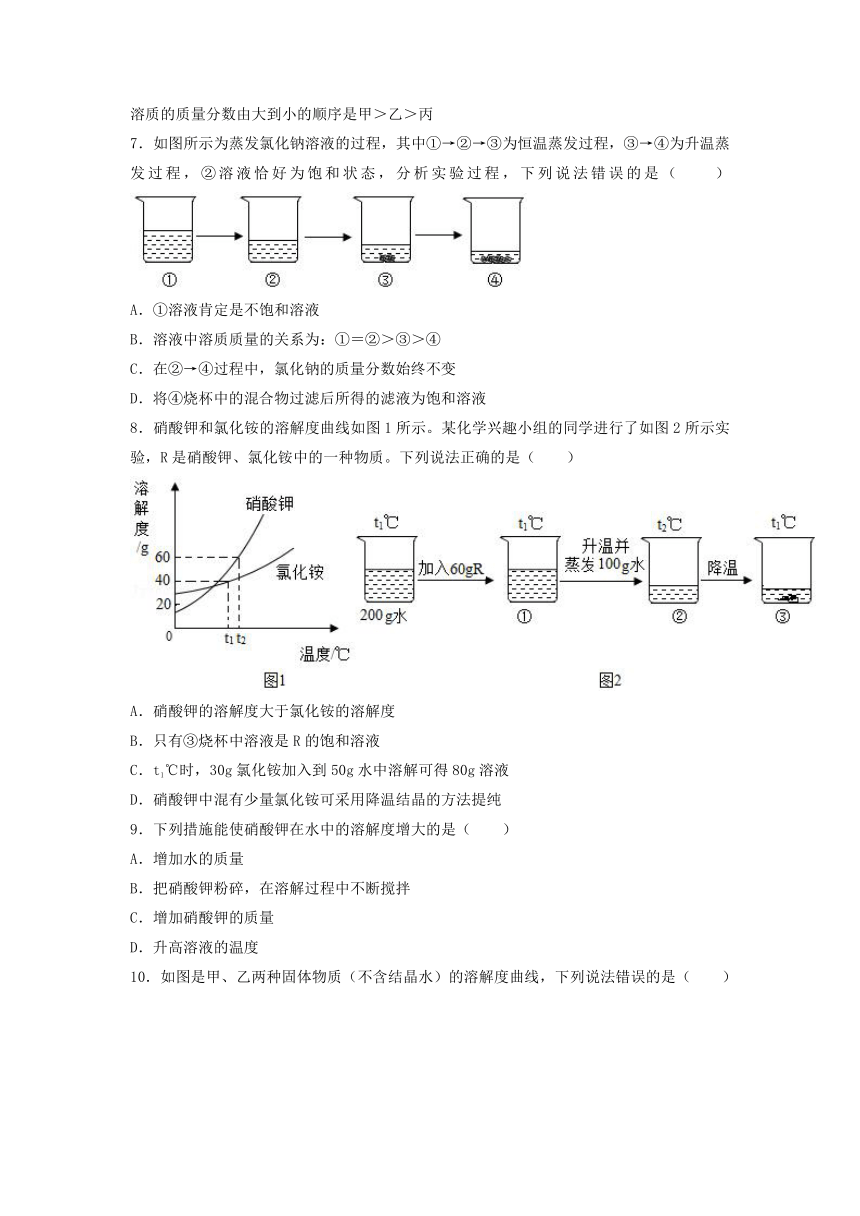
7.如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,下列说法错误的是( )
A.①溶液肯定是不饱和溶液
B.溶液中溶质质量的关系为:①=②>③>④
C.在②→④过程中,氯化钠的质量分数始终不变
D.将④烧杯中的混合物过滤后所得的滤液为饱和溶液
8.硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组的同学进行了如图2所示实验,R是硝酸钾、氯化铵中的一种物质。下列说法正确的是( )
A.硝酸钾的溶解度大于氯化铵的溶解度
B.只有③烧杯中溶液是R的饱和溶液
C.t1℃时,30g氯化铵加入到50g水中溶解可得80g溶液
D.硝酸钾中混有少量氯化铵可采用降温结晶的方法提纯
9.下列措施能使硝酸钾在水中的溶解度增大的是( )
A.增加水的质量
B.把硝酸钾粉碎,在溶解过程中不断搅拌
C.增加硝酸钾的质量
D.升高溶液的温度
10.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在 t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
11.要使二氧化碳气体大量溶解在水里,可以采用的方法是( )
A.降温、加压 B.升温、加压 C.降温、减压 D.升温、减压
12.下列条件下的氢氧化钙溶液,质量分数最大的是( )
A. 80℃的饱和溶液 B. 20℃的饱和溶液
C. 80℃的不饱和溶液 D. 20℃的不饱和溶液
二、填空题
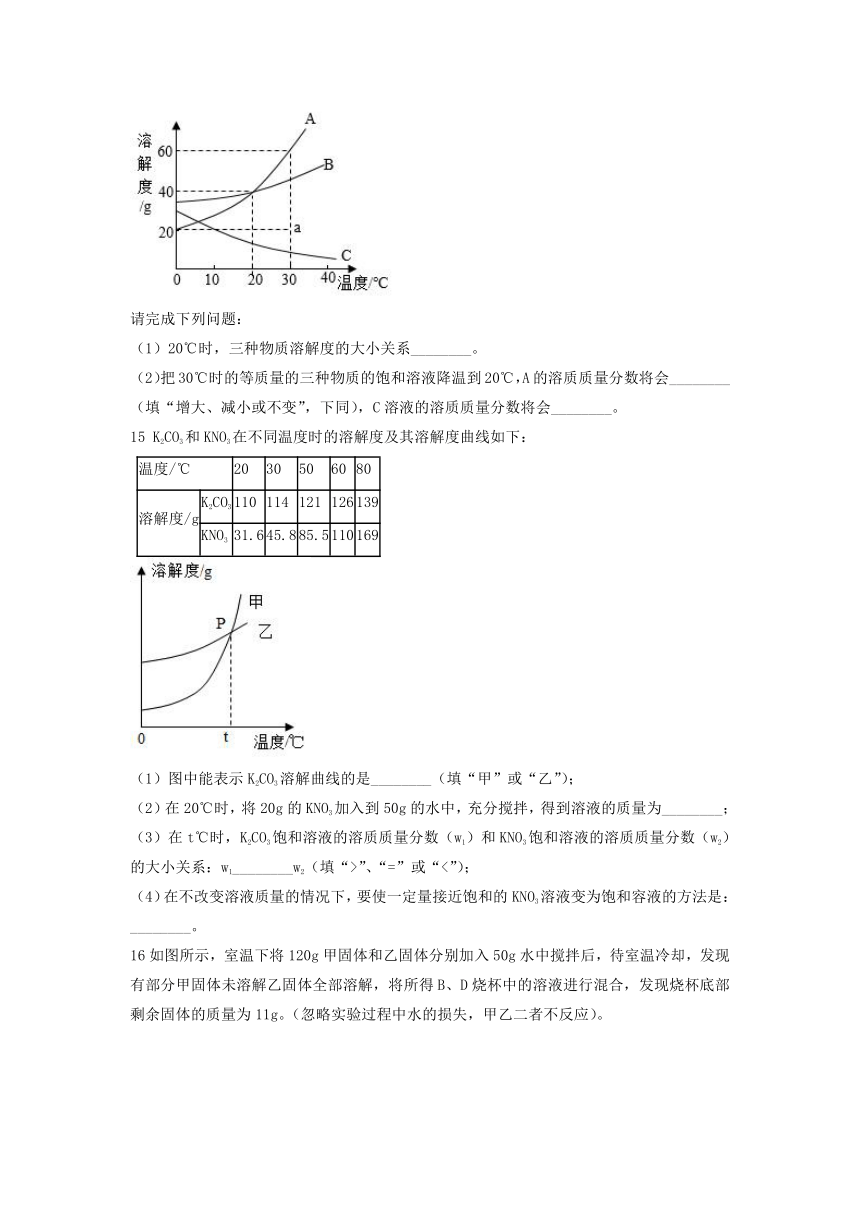
13.请根据图中a、b、c 三种物质的溶解度曲线,回答下列问题。
(1)三种物质中,溶解度随温度的升高而减小的是 。
(2)P 点的含义是 。
(3)t2℃时,28g 物质 a 加入到 50g 水中,充分溶解后得到物质a的 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量是 克。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是 。
14.A、B、C三种物质的溶解度曲线如图所示。
请完成下列问题:
(1)20℃时,三种物质溶解度的大小关系________。
(2)把30℃时的等质量的三种物质的饱和溶液降温到20℃,A的溶质质量分数将会________(填“增大、减小或不变”,下同),C溶液的溶质质量分数将会________。
15 K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
温度/℃ 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
(1)图中能表示K2CO3溶解曲线的是________(填“甲”或“乙”);
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为________;
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1________w2(填“>”、“=”或“<”);
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和容液的方法是:________。
16如图所示,室温下将120g甲固体和乙固体分别加入50g水中搅拌后,待室温冷却,发现有部分甲固体未溶解乙固体全部溶解,将所得B、D烧杯中的溶液进行混合,发现烧杯底部剩余固体的质量为11g。(忽略实验过程中水的损失,甲乙二者不反应)。
(1)烧杯B中溶液为________(填“饱和”或“不饱和”)溶液。
(2)烧杯E中溶液的质量为________。
(3)室温时甲物质的溶解度是________。
(4)从该实验可以推出,温度t与室温的高低关系是t________室温(填“高于”、“等于”或“低于”)。
参考答案
A
2.D 3.B 4.D
5.C
6.C 7.C 8.D
9.D 10.D 11.A
12.B
13.请根据图中a、b、c 三种物质的溶解度曲线,回答下列问题。
(1)三种物质中,溶解度随温度的升高而减小的是 c 。
(2)P 点的含义是 t1℃时,a、c物质的溶解度相等,均为20g 。
(3)t2℃时,28g 物质 a 加入到 50g 水中,充分溶解后得到物质a的 饱和 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量是 25 克。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是 c 。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)通过分析溶解度曲线可知,三种物质中,溶解度随温度的升高而减小的是c;
(2)P 点的含义是t1℃时,a、c物质的溶解度相等,均为20g;
(3)t2℃时,a物质的溶解度是50g,所以28g物质a加入到50g水中,充分溶解后得到物质a的饱和溶液,此时溶液中溶质的质量是25克;
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,a、b物质的溶解度最大,c物质的溶解度减小,应该按照t2℃时是溶解度计算,所以所得溶液中溶质质量分数最小的是c。
故答案为:(1)c;
(2)t1℃时,a、c物质的溶解度相等,均为20g;
(3)饱和,25;
(4)c。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
14【答案】 (1)A=B>C
(2)减小;不变
【解析】【解答】(1)由溶解度曲线图可知,20℃时,三种物质溶解度的大小关系A=B>C,故填:A=B>C;
(2)A物质的溶解度随温度的降低而减小,把30℃时A的饱和溶液降温到20℃,有晶体析出,A的溶质质量分数将会减小;C物质的溶解度随温度的降低而增大,把30℃时C的饱和溶液降温到20℃,溶液由饱和溶液变成不饱和溶液,溶液组成不变,溶质的质量分数不变,故填:减小;不变。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
15.【答案】 (1)乙
(2)65.8g
(3)=
(4)降低温度
【解析】【解答】(1)通过分析溶解度表中数据可知:碳酸钾的溶解度受温度影响较小,所以图1中能表示碳酸钾溶解度曲线是乙;
(2)在20℃时,硝酸钾的溶解度是31.6g,将20g的KNO3加入到50g的水中,充分搅拌,只能溶解15.8g,得到溶液的质量为65.8g;
(3)在t℃时,碳酸钾和硝酸钾的溶解度相等,所以K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1=w2;
(4)硝酸钾的溶解度随温度的降低而减小,在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和容液的方法是:降低温度。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
16.【答案】 (1)饱和
(2)329g
(3)109
(4)高于
【解析】【解答】(1)烧杯B中固体不能全部溶解,溶液为饱和溶液。
(2)烧杯E中剩余固体的质量为11g,溶液的质量为120g+50g+120g+50g-11g=329g。
(3)烧杯E中中剩余甲的质量为11g,溶液中溶剂的质量为100g,溶质甲的质量为120g-11g=109g,故室温时甲物质的溶解度是109g。
(4)从该实验可以推出,室温时乙的溶解度大于甲,温度t与室温的高低关系是t高于室温。
【分析】
(1)饱和溶液即一定温度下,一定量溶剂中,不能继续溶解该物质的状态;
(2)溶液质量=溶质质量+溶剂质量;
(3)根据溶解度(一定温度下,100g溶剂中最多能溶解溶质的质量)的概念来判断;
(4)结合图1和图2根据甲乙的溶解度大小比较进行判断。
一、单选题
1.通常情况下,将一杯不饱和的蔗糖溶液变成饱和溶液,最适宜的方法是( )
A. 加蔗糖 B. 加水 C. 升温 D. 增大压强
2.下列有关溶液的说法中,正确的是
A.饱和溶液一定比不饱和溶液所含的溶质多
B.不饱和溶液都可以通过降低温度的方法变成饱和溶液
C.不饱和溶液转化为饱和溶液,溶液中溶质的质量分数一定增大
D.将一定质量某物质的饱和溶液降温析出晶体后,所得溶液中溶质的质量一定减小
3.降低温度使氯化钠饱和溶液析出晶体前后,不改变的是
A.溶解度 B.溶剂质量 C.溶液质量 D.溶质质量
4.关于溶解度说法正确的是
A.硝酸钾的溶解度为222g/100g 水 B.溶解度随温度升高而升高
C.难溶物质的溶解度为零 D.溶解度可以定量的表示物质溶解性的大小
5.60℃时,化合物甲的溶解度比乙的大。分别取等质量60℃时的甲、乙饱和溶液,降温至20℃后,析出甲和乙的质量分别为ag和bg(甲、乙均无结晶水)。以下叙述中正确的是( )
A. 60℃时等质量的甲饱和溶液与乙饱和溶液相比,前者所含溶质的质量小
B. a一定大于b
C. 20℃时,若甲的溶解度比乙的小,则a一定大于b
D. 20℃时,若甲的溶解度仍比乙的大,则a一定小于b
6.如图是甲、乙、两三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是( )
A.甲和丙的溶解度相等
B.在t2℃时,将28g甲物质加入到50g水中,充分溶解后所得溶液的质量为78g
C.t2℃时,等质量的甲、乙、丙三种固体配制成饱和溶液所需溶剂质量的大小关系是甲<乙<丙
D.将t1℃时,甲、乙、丙三种物质的饱和溶液升温至t2℃(不考虑水的蒸发),所得溶液中溶质的质量分数由大到小的顺序是甲>乙>丙
7.如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,下列说法错误的是( )
A.①溶液肯定是不饱和溶液
B.溶液中溶质质量的关系为:①=②>③>④
C.在②→④过程中,氯化钠的质量分数始终不变
D.将④烧杯中的混合物过滤后所得的滤液为饱和溶液
8.硝酸钾和氯化铵的溶解度曲线如图1所示。某化学兴趣小组的同学进行了如图2所示实验,R是硝酸钾、氯化铵中的一种物质。下列说法正确的是( )
A.硝酸钾的溶解度大于氯化铵的溶解度
B.只有③烧杯中溶液是R的饱和溶液
C.t1℃时,30g氯化铵加入到50g水中溶解可得80g溶液
D.硝酸钾中混有少量氯化铵可采用降温结晶的方法提纯
9.下列措施能使硝酸钾在水中的溶解度增大的是( )
A.增加水的质量
B.把硝酸钾粉碎,在溶解过程中不断搅拌
C.增加硝酸钾的质量
D.升高溶液的温度
10.如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列说法错误的是( )
A.甲物质的溶解度随温度的升高而增大
B.在t1℃时,甲、乙两物质的溶解度相等
C.在 t2℃时,N点表示甲物质的不饱和溶液
D.在t1℃时,100g乙物质的饱和溶液中溶质的质量是25g
11.要使二氧化碳气体大量溶解在水里,可以采用的方法是( )
A.降温、加压 B.升温、加压 C.降温、减压 D.升温、减压
12.下列条件下的氢氧化钙溶液,质量分数最大的是( )
A. 80℃的饱和溶液 B. 20℃的饱和溶液
C. 80℃的不饱和溶液 D. 20℃的不饱和溶液
二、填空题
13.请根据图中a、b、c 三种物质的溶解度曲线,回答下列问题。
(1)三种物质中,溶解度随温度的升高而减小的是 。
(2)P 点的含义是 。
(3)t2℃时,28g 物质 a 加入到 50g 水中,充分溶解后得到物质a的 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量是 克。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是 。
14.A、B、C三种物质的溶解度曲线如图所示。
请完成下列问题:
(1)20℃时,三种物质溶解度的大小关系________。
(2)把30℃时的等质量的三种物质的饱和溶液降温到20℃,A的溶质质量分数将会________(填“增大、减小或不变”,下同),C溶液的溶质质量分数将会________。
15 K2CO3和KNO3在不同温度时的溶解度及其溶解度曲线如下:
温度/℃ 20 30 50 60 80
溶解度/g K2CO3 110 114 121 126 139
KNO3 31.6 45.8 85.5 110 169
(1)图中能表示K2CO3溶解曲线的是________(填“甲”或“乙”);
(2)在20℃时,将20g的KNO3加入到50g的水中,充分搅拌,得到溶液的质量为________;
(3)在t℃时,K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1________w2(填“>”、“=”或“<”);
(4)在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和容液的方法是:________。
16如图所示,室温下将120g甲固体和乙固体分别加入50g水中搅拌后,待室温冷却,发现有部分甲固体未溶解乙固体全部溶解,将所得B、D烧杯中的溶液进行混合,发现烧杯底部剩余固体的质量为11g。(忽略实验过程中水的损失,甲乙二者不反应)。
(1)烧杯B中溶液为________(填“饱和”或“不饱和”)溶液。
(2)烧杯E中溶液的质量为________。
(3)室温时甲物质的溶解度是________。
(4)从该实验可以推出,温度t与室温的高低关系是t________室温(填“高于”、“等于”或“低于”)。
参考答案
A
2.D 3.B 4.D
5.C
6.C 7.C 8.D
9.D 10.D 11.A
12.B
13.请根据图中a、b、c 三种物质的溶解度曲线,回答下列问题。
(1)三种物质中,溶解度随温度的升高而减小的是 c 。
(2)P 点的含义是 t1℃时,a、c物质的溶解度相等,均为20g 。
(3)t2℃时,28g 物质 a 加入到 50g 水中,充分溶解后得到物质a的 饱和 (填“饱和”或“不饱和”)溶液,此时溶液中溶质的质量是 25 克。
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质量分数最小的是 c 。
【分析】根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
【解答】解:(1)通过分析溶解度曲线可知,三种物质中,溶解度随温度的升高而减小的是c;
(2)P 点的含义是t1℃时,a、c物质的溶解度相等,均为20g;
(3)t2℃时,a物质的溶解度是50g,所以28g物质a加入到50g水中,充分溶解后得到物质a的饱和溶液,此时溶液中溶质的质量是25克;
(4)将 t2℃时的 a、b、c 三种物质的饱和溶液降温到t1℃时,a、b物质的溶解度最大,c物质的溶解度减小,应该按照t2℃时是溶解度计算,所以所得溶液中溶质质量分数最小的是c。
故答案为:(1)c;
(2)t1℃时,a、c物质的溶解度相等,均为20g;
(3)饱和,25;
(4)c。
【点评】本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力。
14【答案】 (1)A=B>C
(2)减小;不变
【解析】【解答】(1)由溶解度曲线图可知,20℃时,三种物质溶解度的大小关系A=B>C,故填:A=B>C;
(2)A物质的溶解度随温度的降低而减小,把30℃时A的饱和溶液降温到20℃,有晶体析出,A的溶质质量分数将会减小;C物质的溶解度随温度的降低而增大,把30℃时C的饱和溶液降温到20℃,溶液由饱和溶液变成不饱和溶液,溶液组成不变,溶质的质量分数不变,故填:减小;不变。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
15.【答案】 (1)乙
(2)65.8g
(3)=
(4)降低温度
【解析】【解答】(1)通过分析溶解度表中数据可知:碳酸钾的溶解度受温度影响较小,所以图1中能表示碳酸钾溶解度曲线是乙;
(2)在20℃时,硝酸钾的溶解度是31.6g,将20g的KNO3加入到50g的水中,充分搅拌,只能溶解15.8g,得到溶液的质量为65.8g;
(3)在t℃时,碳酸钾和硝酸钾的溶解度相等,所以K2CO3饱和溶液的溶质质量分数(w1)和KNO3饱和溶液的溶质质量分数(w2)的大小关系:w1=w2;
(4)硝酸钾的溶解度随温度的降低而减小,在不改变溶液质量的情况下,要使一定量接近饱和的KNO3溶液变为饱和容液的方法是:降低温度。
【分析】根据溶解度曲线含义分析,溶解度曲线可以确定同一温度下不同物质的溶解度大小,可以确定各物质的溶解度随温度变化规律,确定结晶方法及饱和溶液不饱和溶液的转化方法,若溶解度受温度影响很大,适用于降温结晶,若溶解度受温度影响不大,则可采用蒸发结晶;可以根据溶解度/(溶解度+100)确定某温度下饱和溶液的溶质质量分数。
16.【答案】 (1)饱和
(2)329g
(3)109
(4)高于
【解析】【解答】(1)烧杯B中固体不能全部溶解,溶液为饱和溶液。
(2)烧杯E中剩余固体的质量为11g,溶液的质量为120g+50g+120g+50g-11g=329g。
(3)烧杯E中中剩余甲的质量为11g,溶液中溶剂的质量为100g,溶质甲的质量为120g-11g=109g,故室温时甲物质的溶解度是109g。
(4)从该实验可以推出,室温时乙的溶解度大于甲,温度t与室温的高低关系是t高于室温。
【分析】
(1)饱和溶液即一定温度下,一定量溶剂中,不能继续溶解该物质的状态;
(2)溶液质量=溶质质量+溶剂质量;
(3)根据溶解度(一定温度下,100g溶剂中最多能溶解溶质的质量)的概念来判断;
(4)结合图1和图2根据甲乙的溶解度大小比较进行判断。
