2.7元素符号表示的量(1)(课件 25张PPT)
文档属性
| 名称 | 2.7元素符号表示的量(1)(课件 25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 889.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-02-11 17:29:41 | ||
图片预览





文档简介
(共25张PPT)
学习目标:
1.理解相对原子质量的定义
2.学会查阅相对原子质量表
3.能根据化学式计算物质的相对分子质量
2.7.1 元素符号表示的量
一个碳-12原子的质量:
1.993×10-26千克
一个氧原子的质量:
2.657×10-26 千克
请你计算一个二氧化碳分子的质量是多少?
7.307×10-26千克
有没有什么方法可以简化呢?
一、相对原子质量
国际上规定:(P64)
采用相对原子质量来表示原子的质量关系。
1.定义:
以碳-12原子质量的1/12作为标准,
其它原子质量跟它相比所得的数值,
就是该种原子的相对原子质量。
→比值
相对原子质量有没有单位?
思考与讨论:
1、如果以碳-12原子质量的1/10作为标准,
则氧原子的相对原子质量还是16吗?
如果不是16,那会是比16要大,还是小呢?
标准变 。
大
标准变了,相对原子质量也要改变。不是16。
相对原子质量变 。
小
比16小。
2、如果设C-12的质量是a,某原子的质量是b,
那么这个原子的相对质量可以怎样表示?
这个原子的相对质量
=
=
b
a
×
1
12
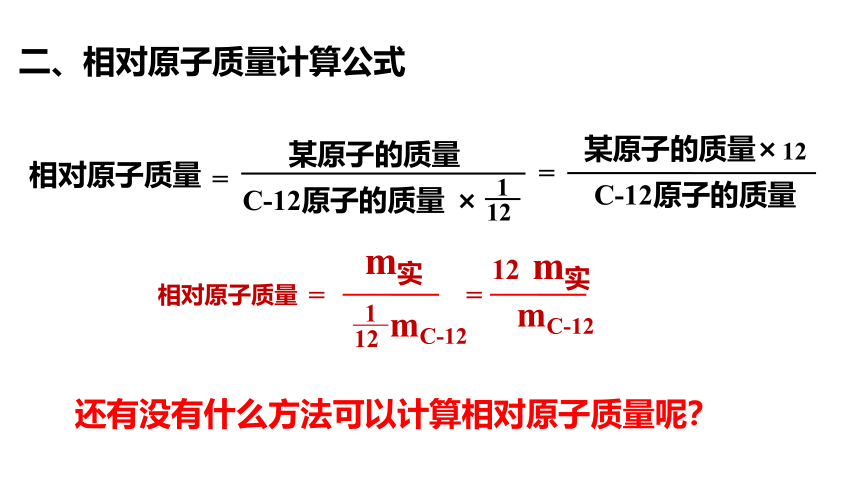
二、相对原子质量计算公式
相对原子质量
=
某原子的质量
C-12原子的质量
×
1
12
=
某原子的质量
C-12原子的质量
×
12
m实
mC-12
相对原子质量
=
1
12
=
m实
12
mC-12
还有没有什么方法可以计算相对原子质量呢?
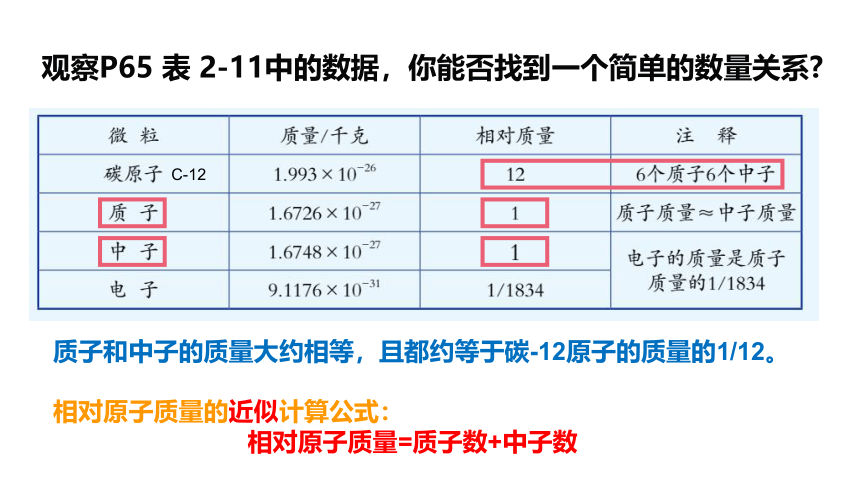
观察P65 表 2-11中的数据,你能否找到一个简单的数量关系
质子和中子的质量大约相等,且都约等于碳-12原子的质量的1/12。
相对原子质量的近似计算公式:
相对原子质量=质子数+中子数
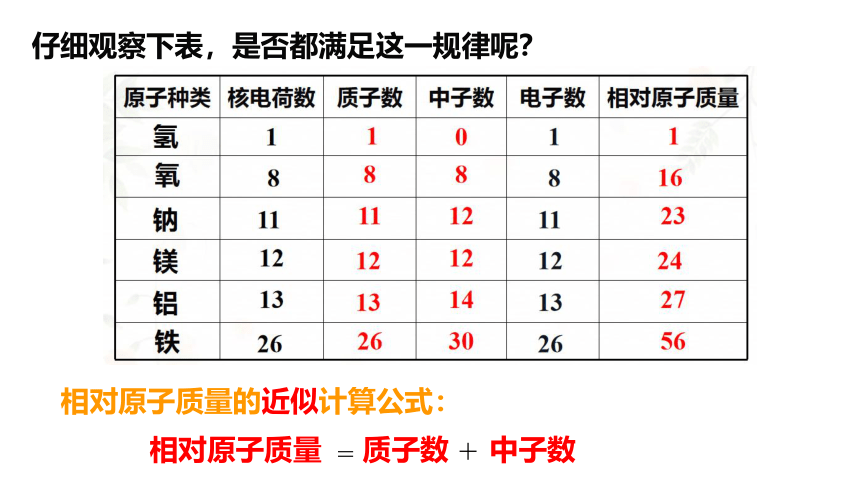
C-12
仔细观察下表,是否都满足这一规律呢?
相对原子质量
相对原子质量的近似计算公式:
质子数
中子数
=
+
1.相对原子质量是不是原子的实际质量?
它能否体现原子的实际质量大小?
回顾:
能,相对原子质量越大,原子的实际质量越大。
不是原子的实际质量。是一个比值。
2.我们要用到某原子的相对质量,是否都需要进行计算?
不需要。可以从相对原子质量表中(附录3)查出元素的相对原子质量。
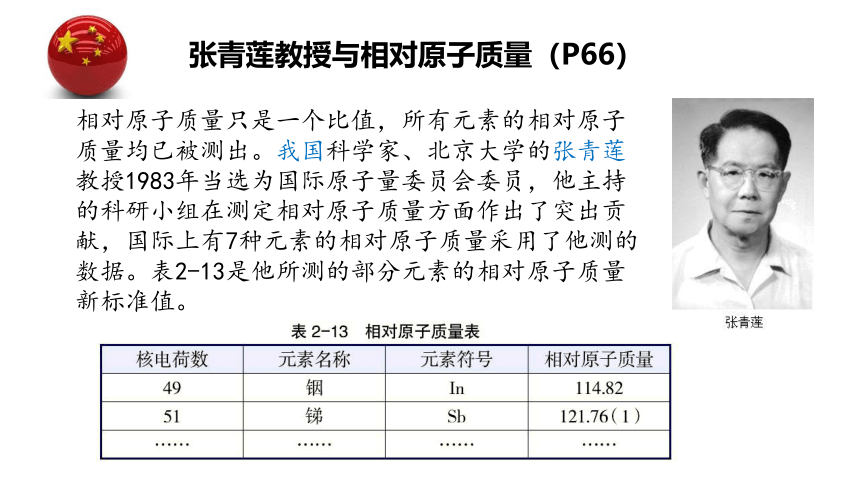
张青莲教授与相对原子质量(P66)
相对原子质量只是一个比值,所有元素的相对原子质量均已被测出。我国科学家、北京大学的张青莲教授1983年当选为国际原子量委员会委员,他主持的科研小组在测定相对原子质量方面作出了突出贡献,国际上有7种元素的相对原子质量采用了他测的数据。表2-13是他所测的部分元素的相对原子质量新标准值。
三、相对原子质量数值
①查阅相对原子质量的方法:
(2)从元素周期表(P171)中查。
(1)从相对原子质量表(P170)中查。
活动:查出 1-18号元素的相对原子质量填在P65表中。(一般取整数)
原子序数 1 2 3 4 5 6 7 8 9
相对质量
原子序数 10 11 12 13 14 15 16 17 18
相对质量
1
4
7
9
11
12
14
16
19
20
23
24
27
28
31
32
35.5
40
氯元素有35Cl和37Cl两种稳定同位素。
35Cl的相对原子质量为34.96,数量占全部氯原子的75.8%。
37Cl的相对原子质量为36.96,数量占全部氯原子的24.2%。
氯的相对原子原子质量是这两者按比例求出的。
思考:
分子由原子构成,一个水分子的质量约为多少千克?
(一个氢原子质量为1.674×10-27千克,
一个氧原子质量为2.657×10-26千克)
2×1.674×10-27千克 + 2.657×10-26千克
= 2.992×10-26千克
分子的质量也很小,
用实际质量计算也不方便。
分子质量也可以用相对分子质量表示。
四、相对分子质量
1.定义
一个分子中各原子的相对原子质量总和。
2.计算步骤
③求分子中各原子的相对原子质量总和
①写出正确的化学式
②查出各元素的相对原子质量
M分子 = 相对原子质量1×n1 +相对原子质量2×n2+……
例:求硫酸的相对分子质量
H2SO4(硫酸分子)的相对分子质量
1
×
2
32
×
1
=
98
16
×
4
=
+
+
已知:硫酸化学式为H2SO4
查表可知: O—16 H—1 S—32
巩固训练:P67
CO(一氧化碳分子)的相对分子质量
=
12
×
+
1
16
×
1
=
28
O2(氧分子)的相对分子质量
=
16
×
2
=
32
CO2(二氧化碳分子)的相对分子质量
=
12
×
+
1
16
×
2
=
44
氢氧
化钙
Ca(OH)2(氢氧化钙)的相对分子质量
=
40
×
+
1
(16+1)
×
2
=
74
1、什么物质的相对分子质量最小?
H2
思考与讨论:(P66)
2、化学式CO2还可以表示什么意义?
表示该物质的相对分子质量
(CO2的相对分子质量为44 )
小结:
一、相对原子质量
1.定义
以 的质量作为标准,其它原子质量跟它相比较所得的数值,就是该种原子的相对原子质量。
2.相对原子质量计算公式
某原子的质量
C-12原子的质量
×
1
12
=
某原子的质量
C-12原子的质量
×
12
相对原子质量的近似计算公式:
相对原子质量=质子数+中子数
比 较 原子的质量 相对原子质量
单 位
千克
是比值,无单位
二、相对分子质量
1.计算步骤
(3)求分子中各原子的相对原子质量总和
(1)写出正确的化学式
(2)查出各元素的相对原子质量
巩固训练:
2.已知某元素的原子与碳—12原子的质量比为9,
则该元素的相对原子质量为( )
A. 108 B. 1.33
C. 108克 D. 1.33克
A
1.小明在计算氧气分子的相对分子质量时,列了这样一条等式,
他列的正确吗?如果错误,哪里有问题?
O2:相对分子质量=16×2=32克
4.已知一个碳原子(质子数为6,中子数为6)的质量为m千克,某原子的相对原子质量为a,则该原子的质量为 。
am/12千克
3.某化合物的化学式为R2O3,它的相对分子质量是160,则R的相对原子质量是( )
A. 56 B. 112 C. 114 D. 72
A
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
1 0
氧 8 8
11 12 23
12 12
13 14 27
铁 26 30 56
氢
1
1
1
8
8
16
钠
11
11
镁
12
12
24
铝
13
13
26
26
5.完成下表
总结题型:
1.对公式 的应用
知道其中任意两个量的值,求第三个的值。
课A26
A
总结题型:
2.对变形公式 的应用。
知道一种原子的实际质量和其相对原子质量,
以及另一种原子的实际质量或相对原子质量中的一个,求另一个的值。
课A27
A
总结题型:
3.对公式 的应用
知道其中任意两个量的值,求第三个的值。
课A26
B
总结题型:
4.对公式 的应用
知道其他量的值,求最后一个量的值。
课A26
C
学习目标:
1.理解相对原子质量的定义
2.学会查阅相对原子质量表
3.能根据化学式计算物质的相对分子质量
2.7.1 元素符号表示的量
一个碳-12原子的质量:
1.993×10-26千克
一个氧原子的质量:
2.657×10-26 千克
请你计算一个二氧化碳分子的质量是多少?
7.307×10-26千克
有没有什么方法可以简化呢?
一、相对原子质量
国际上规定:(P64)
采用相对原子质量来表示原子的质量关系。
1.定义:
以碳-12原子质量的1/12作为标准,
其它原子质量跟它相比所得的数值,
就是该种原子的相对原子质量。
→比值
相对原子质量有没有单位?
思考与讨论:
1、如果以碳-12原子质量的1/10作为标准,
则氧原子的相对原子质量还是16吗?
如果不是16,那会是比16要大,还是小呢?
标准变 。
大
标准变了,相对原子质量也要改变。不是16。
相对原子质量变 。
小
比16小。
2、如果设C-12的质量是a,某原子的质量是b,
那么这个原子的相对质量可以怎样表示?
这个原子的相对质量
=
=
b
a
×
1
12
二、相对原子质量计算公式
相对原子质量
=
某原子的质量
C-12原子的质量
×
1
12
=
某原子的质量
C-12原子的质量
×
12
m实
mC-12
相对原子质量
=
1
12
=
m实
12
mC-12
还有没有什么方法可以计算相对原子质量呢?
观察P65 表 2-11中的数据,你能否找到一个简单的数量关系
质子和中子的质量大约相等,且都约等于碳-12原子的质量的1/12。
相对原子质量的近似计算公式:
相对原子质量=质子数+中子数
C-12
仔细观察下表,是否都满足这一规律呢?
相对原子质量
相对原子质量的近似计算公式:
质子数
中子数
=
+
1.相对原子质量是不是原子的实际质量?
它能否体现原子的实际质量大小?
回顾:
能,相对原子质量越大,原子的实际质量越大。
不是原子的实际质量。是一个比值。
2.我们要用到某原子的相对质量,是否都需要进行计算?
不需要。可以从相对原子质量表中(附录3)查出元素的相对原子质量。
张青莲教授与相对原子质量(P66)
相对原子质量只是一个比值,所有元素的相对原子质量均已被测出。我国科学家、北京大学的张青莲教授1983年当选为国际原子量委员会委员,他主持的科研小组在测定相对原子质量方面作出了突出贡献,国际上有7种元素的相对原子质量采用了他测的数据。表2-13是他所测的部分元素的相对原子质量新标准值。
三、相对原子质量数值
①查阅相对原子质量的方法:
(2)从元素周期表(P171)中查。
(1)从相对原子质量表(P170)中查。
活动:查出 1-18号元素的相对原子质量填在P65表中。(一般取整数)
原子序数 1 2 3 4 5 6 7 8 9
相对质量
原子序数 10 11 12 13 14 15 16 17 18
相对质量
1
4
7
9
11
12
14
16
19
20
23
24
27
28
31
32
35.5
40
氯元素有35Cl和37Cl两种稳定同位素。
35Cl的相对原子质量为34.96,数量占全部氯原子的75.8%。
37Cl的相对原子质量为36.96,数量占全部氯原子的24.2%。
氯的相对原子原子质量是这两者按比例求出的。
思考:
分子由原子构成,一个水分子的质量约为多少千克?
(一个氢原子质量为1.674×10-27千克,
一个氧原子质量为2.657×10-26千克)
2×1.674×10-27千克 + 2.657×10-26千克
= 2.992×10-26千克
分子的质量也很小,
用实际质量计算也不方便。
分子质量也可以用相对分子质量表示。
四、相对分子质量
1.定义
一个分子中各原子的相对原子质量总和。
2.计算步骤
③求分子中各原子的相对原子质量总和
①写出正确的化学式
②查出各元素的相对原子质量
M分子 = 相对原子质量1×n1 +相对原子质量2×n2+……
例:求硫酸的相对分子质量
H2SO4(硫酸分子)的相对分子质量
1
×
2
32
×
1
=
98
16
×
4
=
+
+
已知:硫酸化学式为H2SO4
查表可知: O—16 H—1 S—32
巩固训练:P67
CO(一氧化碳分子)的相对分子质量
=
12
×
+
1
16
×
1
=
28
O2(氧分子)的相对分子质量
=
16
×
2
=
32
CO2(二氧化碳分子)的相对分子质量
=
12
×
+
1
16
×
2
=
44
氢氧
化钙
Ca(OH)2(氢氧化钙)的相对分子质量
=
40
×
+
1
(16+1)
×
2
=
74
1、什么物质的相对分子质量最小?
H2
思考与讨论:(P66)
2、化学式CO2还可以表示什么意义?
表示该物质的相对分子质量
(CO2的相对分子质量为44 )
小结:
一、相对原子质量
1.定义
以 的质量作为标准,其它原子质量跟它相比较所得的数值,就是该种原子的相对原子质量。
2.相对原子质量计算公式
某原子的质量
C-12原子的质量
×
1
12
=
某原子的质量
C-12原子的质量
×
12
相对原子质量的近似计算公式:
相对原子质量=质子数+中子数
比 较 原子的质量 相对原子质量
单 位
千克
是比值,无单位
二、相对分子质量
1.计算步骤
(3)求分子中各原子的相对原子质量总和
(1)写出正确的化学式
(2)查出各元素的相对原子质量
巩固训练:
2.已知某元素的原子与碳—12原子的质量比为9,
则该元素的相对原子质量为( )
A. 108 B. 1.33
C. 108克 D. 1.33克
A
1.小明在计算氧气分子的相对分子质量时,列了这样一条等式,
他列的正确吗?如果错误,哪里有问题?
O2:相对分子质量=16×2=32克
4.已知一个碳原子(质子数为6,中子数为6)的质量为m千克,某原子的相对原子质量为a,则该原子的质量为 。
am/12千克
3.某化合物的化学式为R2O3,它的相对分子质量是160,则R的相对原子质量是( )
A. 56 B. 112 C. 114 D. 72
A
原子种类 核电荷数 质子数 中子数 电子数 相对原子质量
1 0
氧 8 8
11 12 23
12 12
13 14 27
铁 26 30 56
氢
1
1
1
8
8
16
钠
11
11
镁
12
12
24
铝
13
13
26
26
5.完成下表
总结题型:
1.对公式 的应用
知道其中任意两个量的值,求第三个的值。
课A26
A
总结题型:
2.对变形公式 的应用。
知道一种原子的实际质量和其相对原子质量,
以及另一种原子的实际质量或相对原子质量中的一个,求另一个的值。
课A27
A
总结题型:
3.对公式 的应用
知道其中任意两个量的值,求第三个的值。
课A26
B
总结题型:
4.对公式 的应用
知道其他量的值,求最后一个量的值。
课A26
C
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
