第6章基础实验5配制一定溶质质量分数的氯化钠溶液课后练习—2021-202学年九年级化学沪教版下册(word版 含答案)
文档属性
| 名称 | 第6章基础实验5配制一定溶质质量分数的氯化钠溶液课后练习—2021-202学年九年级化学沪教版下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 216.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-02-18 10:59:52 | ||
图片预览

文档简介
配制一定溶质质量分数的氯化钠溶液
一、单选题
1.配制6%的氯化钠溶液50 g,在量取所需的水时俯视读数(其他操作正确),则配制的溶液中溶质的质量分数( )
A.大于6%
B.小于6%
C.等于6%
D.无法判断
2. 下列叙述不正确的是( )
A. 在水净化的单一操作中,蒸馏是净化程度较高的方法之一
B. 常用肥皂水检验硬水和软水
C. 用密度约为1.04g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平
D. 用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
3.配制一定质量分数的食盐水,不需要使用的仪器是( )
A. 玻璃棒 B. 烧杯 C. 药匙 D. 量筒
4.下列实验符合规范要求的是( )
A. “高锰酸钾制取氧气”实验中,收集好气体后先将导管移出水槽后停止加热
B. “净化浑浊的河水”实验中,过滤时将悬浊液直接倒入漏斗里
C. “配制一定溶质质量分数的溶液”实验中,多余的药品应放回原瓶
D. “二氧化碳的制取和性质”实验中,用稀硫酸与石灰石反应
5.要配制100 g溶质质量分数为10%的氯化钠溶液,下列说法正确的是( )
A.配制步骤为称量、溶解、装瓶
B.称量10 g氯化钠固体,量取90 mL水
C.为加快固体溶解,用温度计搅拌溶液
D.需要的玻璃仪器有:烧杯、量筒、细口瓶
6.溶解硝酸钾固体,必须使用的一组仪器是( )
A.玻璃棒、烧杯 B.烧杯、石棉网
C.铁架台、蒸发皿 D.试管、漏斗
7.小丽在学习了某些化学知识后,梳理归纳了以下结论:
①“低碳”就是指降低二氧化碳的排放
②具有相同质子数的粒子是同种元素的原子
③配制0.9%的生理盐水,量取水时,仰视量筒刻度会使所配氯化钠溶液溶质质量分数偏低
④除去氧气中混有的一氧化碳,可通过灼热氧化铁
⑤合金的许多性能优于组成该合金的单一金属,如硬度大、强度大、熔点高、抗腐蚀性好,因此应用广泛
⑥微量元素在人体内含量很少,但作用不小,如缺钙元素会得骨质疏松,缺碘元素会得甲状腺肿大。其中正确的个数有( )
A.1个 B.2个 C.3个 D.4个
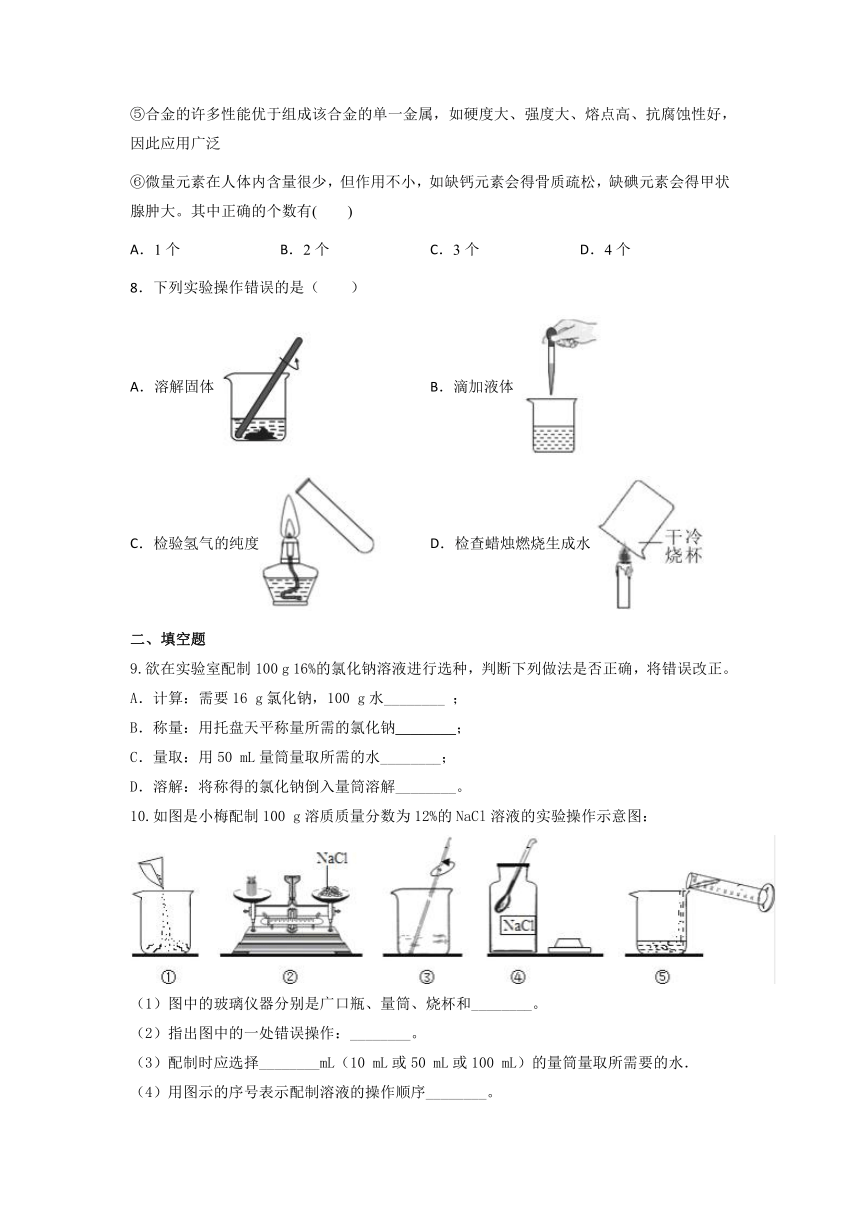
8.下列实验操作错误的是( )
A.溶解固体 B.滴加液体
C.检验氢气的纯度 D.检查蜡烛燃烧生成水
二、填空题
9.欲在实验室配制100 g 16%的氯化钠溶液进行选种,判断下列做法是否正确,将错误改正。
A.计算:需要16 g氯化钠,100 g水________ ;
B.称量:用托盘天平称量所需的氯化钠________;
C.量取:用50 mL量筒量取所需的水________;
D.溶解:将称得的氯化钠倒入量筒溶解________。
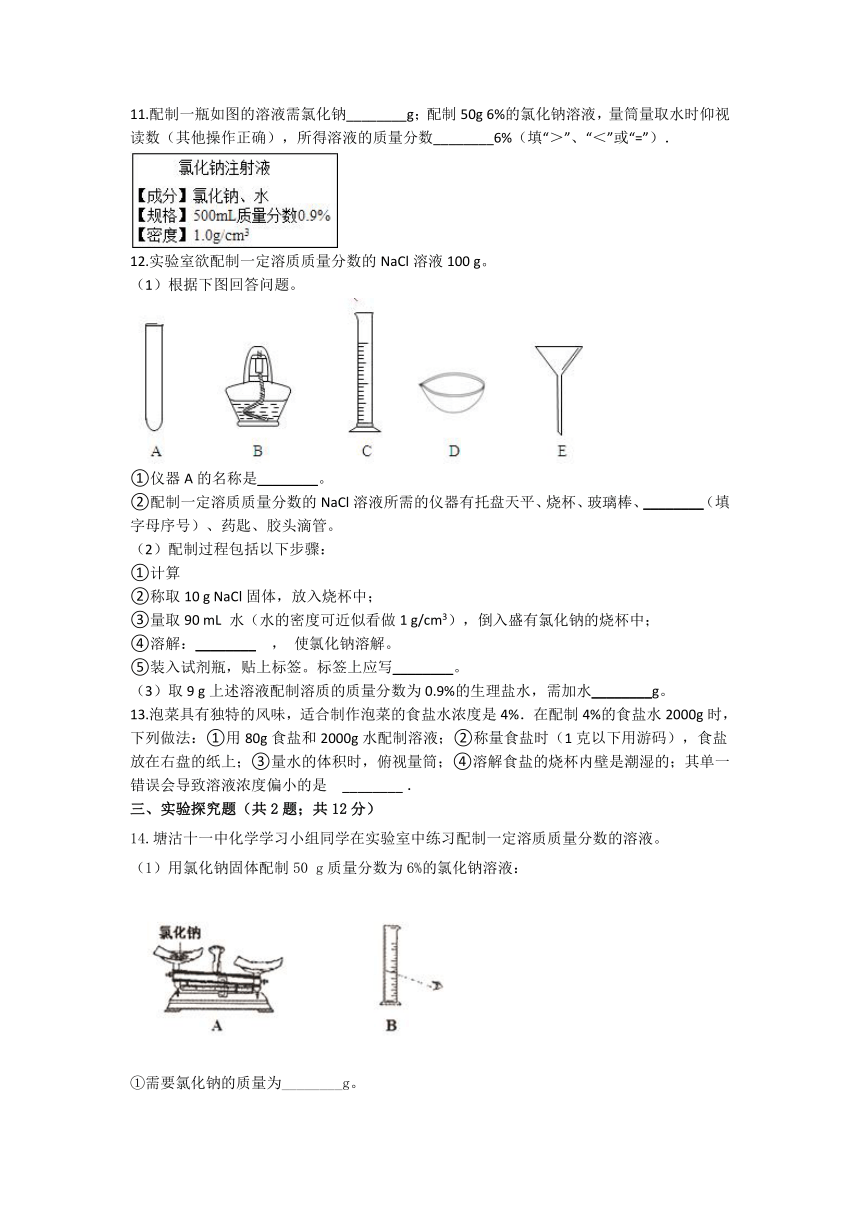
10.如图是小梅配制100 g溶质质量分数为12%的NaCl溶液的实验操作示意图:
(1)图中的玻璃仪器分别是广口瓶、量筒、烧杯和________。
(2)指出图中的一处错误操作:________。
(3)配制时应选择________mL(10 mL或50 mL或100 mL)的量筒量取所需要的水.
(4)用图示的序号表示配制溶液的操作顺序________。
11.配制一瓶如图的溶液需氯化钠________g;配制50g 6%的氯化钠溶液,量筒量取水时仰视读数(其他操作正确),所得溶液的质量分数________6%(填“>”、“<”或“=”).
12.实验室欲配制一定溶质质量分数的NaCl溶液100 g。
(1)根据下图回答问题。
①仪器A的名称是________。
②配制一定溶质质量分数的NaCl溶液所需的仪器有托盘天平、烧杯、玻璃棒、________(填字母序号)、药匙、胶头滴管。
(2)配制过程包括以下步骤:
①计算
②称取10 g NaCl固体,放入烧杯中;
③量取90 mL 水(水的密度可近似看做1 g/cm3),倒入盛有氯化钠的烧杯中;
④溶解:________ , 使氯化钠溶解。
⑤装入试剂瓶,贴上标签。标签上应写________。
(3)取9 g上述溶液配制溶质的质量分数为0.9%的生理盐水,需加水________g。
13.泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水2000g时,下列做法:①用80g食盐和2000g水配制溶液;②称量食盐时(1克以下用游码),食盐放在右盘的纸上;③量水的体积时,俯视量筒;④溶解食盐的烧杯内壁是潮湿的;其单一错误会导致溶液浓度偏小的是 ________ .
三、实验探究题(共2题;共12分)
14.塘沽十一中化学学习小组同学在实验室中练习配制一定溶质质量分数的溶液。
(1)用氯化钠固体配制50 g质量分数为6%的氯化钠溶液:
①需要氯化钠的质量为________g。
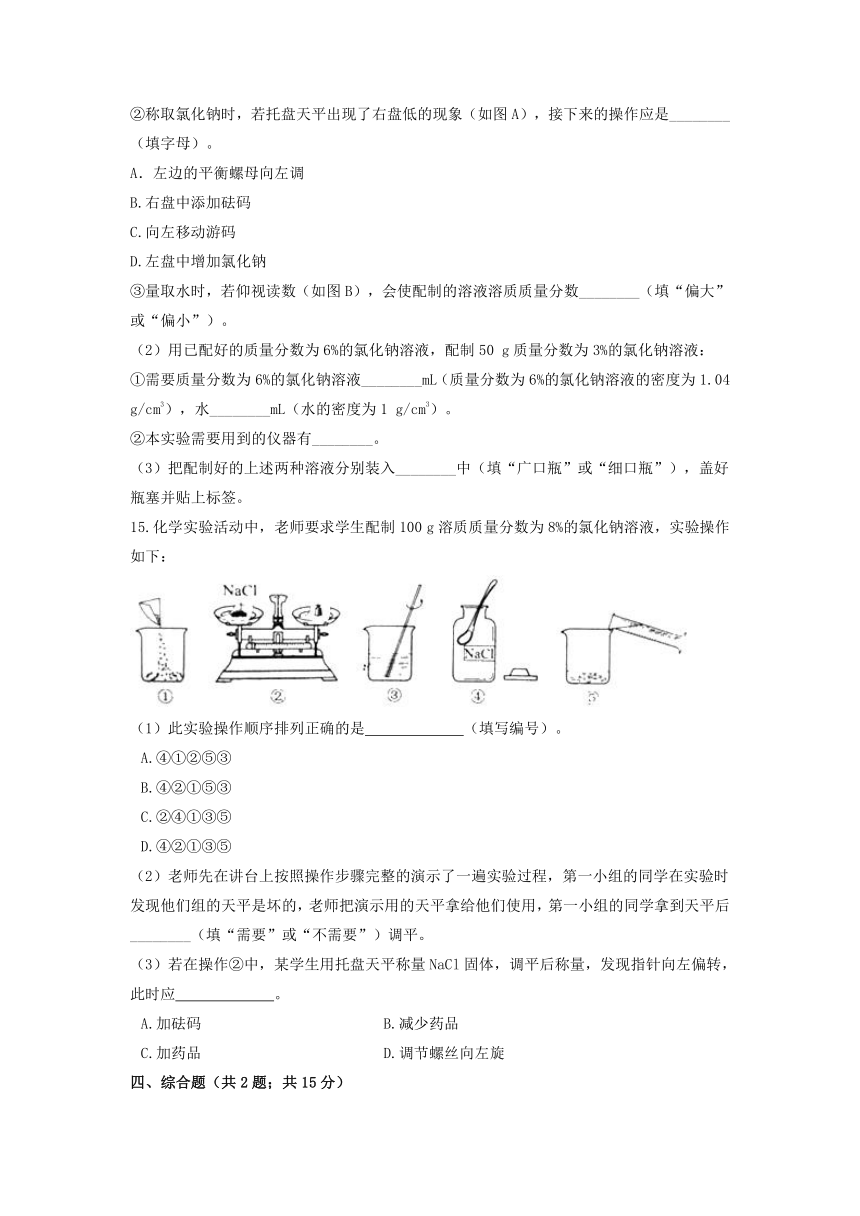
②称取氯化钠时,若托盘天平出现了右盘低的现象(如图A),接下来的操作应是________(填字母)。
A.左边的平衡螺母向左调
B.右盘中添加砝码
C.向左移动游码
D.左盘中增加氯化钠
③量取水时,若仰视读数(如图B),会使配制的溶液溶质质量分数________(填“偏大”或“偏小”)。
(2)用已配好的质量分数为6%的氯化钠溶液,配制50 g质量分数为3%的氯化钠溶液:
①需要质量分数为6%的氯化钠溶液________mL(质量分数为6%的氯化钠溶液的密度为1.04 g/cm3),水________mL(水的密度为1 g/cm3)。
②本实验需要用到的仪器有________。
(3)把配制好的上述两种溶液分别装入________中(填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签。
15.化学实验活动中,老师要求学生配制100 g溶质质量分数为8%的氯化钠溶液,实验操作如下:
(1)此实验操作顺序排列正确的是 (填写编号)。
A.④①②⑤③
B.④②①⑤③
C.②④①③⑤
D.④②①③⑤
(2)老师先在讲台上按照操作步骤完整的演示了一遍实验过程,第一小组的同学在实验时发现他们组的天平是坏的,老师把演示用的天平拿给他们使用,第一小组的同学拿到天平后________(填“需要”或“不需要”)调平。
(3)若在操作②中,某学生用托盘天平称量NaCl固体,调平后称量,发现指针向左偏转,此时应 。
A.加砝码 B.减少药品
C.加药品 D.调节螺丝向左旋
四、综合题(共2题;共15分)
16.酸、碱、盐在生产生活中具有广泛的用途。制作“叶脉书签”需要用到10%的氢氧化钠溶液,现要配制50克质量分数为10%的氢氧化钠溶液:
(1)若用固体氢氧化钠配制,需氢氧化钠固体_______克,水_______毫升(水的密度为1g/cm3)。
(2)固体氢氧化钠配制10%的氢氧化钠溶液过程中需要的仪器除了托盘天平、量筒、胶头滴管、药匙、试剂瓶外还需要 ________和________。配制50克质量分数为10%的氢氧化钠溶液时,应选用_____mL的量筒来量取水(填10mL或50mL)。
(3)配制溶液时,下列操作正确的是__________(填序号)
A.在托盘天平的左右托盘上垫滤纸称量氢氧化钠固体
B.称量氢氧化钠固体时,左盘放砝码
C.将称量准确的氢氧化钠固体放到装好水的量筒中溶解
D.将配好的氢氧化钠溶液装入试剂瓶中,塞好瓶塞,贴上标签
17.为配制的氯化钠饱和溶液,并粗略测定时氯化钠的溶解度。进行了下列实验操作:
称取 氯化钠粉末。
量取的水密度可视为倒入烧杯中。
将氯化钠逐步加入水中,用玻璃棒搅拌至不能溶解。
过滤出未溶解的氯化钠,并称得剩余氯化钠质量为。
步骤、、中不必用到的仪器是______。写字母序号
步骤中用玻璃棒搅拌的目的是______。
本实验中氯化钠的溶解度为______。
步骤中,若量取水时俯视读数。将导致所配制的饱和溶液中氯化钠的质量分数______填“偏大”、“偏小”或“不变”。
为保证实验温度是,有人建议将氯化钠投入70g冷水和30g冰组成的冰水混合物中搅拌至冰块恰好消失时再进行步骤。
小明认为该建议不合理,他的理由是______。
参考答案
一、单选题
1.A 2.C 3.C 4.A 5.B 6.A7.A8.C
二、填空题
9.错误 水的质量应为84 g 正确 错误;应用100 mL量筒 错误;应将称得的氯化钠倒入烧杯中溶解
10.玻璃棒 ②中氯化钠与砝码的位置颠倒 100 ④②①⑤③
11.【答案】4.5;<
【解析】【解答】解:500mL=500cm3 , 溶质质量=溶液质量×溶质的质量分数,配制一瓶如图的溶液需氯化钠的质量为1.0g/cm3×500cm3×0.9%=4.5g. 配制50g6%的氯化钠溶液,用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小.
故答案为:4.5;<.
【分析】根据溶质质量=溶液质量×溶质的质量分数,用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,进行分析解答.
12.【答案】试管 ;C;用玻璃棒搅拌;10% NaCl溶液(或10%氯化钠溶液);91
【解析】【解答】(1)①根据实验室常用仪器回答,仪器A的名称是试管;
②根据配制一定溶质质量分数的溶液的步骤(计算、称量、溶解),来确定所用的仪器,配制一定溶质质量分数的溶液,需要药匙、胶头滴管、量筒、玻璃棒和烧杯。故选C
(2)④在配制溶液的过程中,溶解时,常用玻璃棒搅拌,以加速溶解。
⑤根据题意,标签上应写明溶液的组成,以及其溶质质量分数,故填写10%氯化钠溶液。
(3)根据溶质质量分数= ×100%可知,该实验配制的溶液的溶质质量分数=×100%=10%,而用上述溶液配制溶质的质量分数为0.9%的生理盐水,是对溶液的稀释,在溶液稀释的前后,改变的是溶剂的质量,而溶质质量不变。
设取9g上述溶液配制溶质的质量分数为0.9%的生理盐水,需加水xg
则9g×10%=(9g+x)×0.9%
解得x=91g
【分析】化学是以实验为基础的学科,熟悉常见仪器的使用方法与注意事项,掌握化学实验基本操作是解答此类题目的关键。
13.【答案】①④
【解析】【解答】①用80g食盐和2000g水配制溶液,而实际需用的水是1920g,因此结果偏小;
②称量食盐时(1克以下用游码),食盐放在右盘的纸上,而食盐需用是80g,不要游码,因此不影响;
③量水的体积时,俯视量筒,会使水少,结果偏大;
④溶解食盐的烧杯内壁是潮湿的,相当于水多了,因此结果偏小;
故答案为:①④.
【分析】溶质氯化钠质量偏小或溶剂水的体积偏大,是导致配制氯化钠溶液时溶质质量分数偏小即溶液中NaCl质量分数小于4%的原因.三、实验探究题
14.(1)3 D 偏小
(2)24 25 量筒、烧杯、玻璃棒、胶头滴管
(3)细口瓶
15.(1)B (2)需要 (3)B
四、综合题
16.545玻璃棒烧杯50D
【解析】
【详解】
(1)需要氢氧化钠固体的质量=50g×10%=5g;因溶液质量为50g,故需要溶剂水的质量为45g,水的密度为1g/cm3,故水的体积为45毫升;
(2)配制溶液时还需要在烧杯中进行溶解,同时利用玻璃棒搅拌,加速溶解,故需要烧杯和玻璃棒;由(1)可知,需要水的体积为45毫升,故需要用50毫升的量筒;
(3)A、在托盘天平的左右托盘上垫滤纸称量氢氧化钠固体,会腐蚀纸,应该放在小烧杯中称量,故操作错误; B.称量氢氧化钠固体时,应该砝码放在右盘,氢氧化钠放在左边,故操作错误; C.将准确称量的氢氧化钠固体放入装有水的烧杯中溶解,而不能在量筒内溶解,故操作错误;D.将配制好的氢氧化钠溶液装入试剂瓶中,塞好瓶塞并贴上标签,故操作正确。故本题选D。
17. A 加快氯化钠的溶解 不变 氯化钠可以降低水的凝固点
【解析】(1)称取固体用托盘天平和药匙、量取液体用量筒和胶头滴管、溶解需要的仪器是烧杯和玻璃棒,都不必用到的仪器是酒精灯;(2)溶解中用玻璃棒搅拌的目的是加速溶解;(3) 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量;本实验中氯化钠的溶解度为40g-4.3g=35.7g;(4) ,影响溶解度的因素有:温度、溶质和溶剂的性质(或种类)。步骤②中,若量取水时俯视读数,导致量取水的体积偏小,但所配制的饱和溶液中氯化钠的质量分数不变;(5)冰水混合物的温度为0℃;形成混合物,可以是物质的熔点降低,沸点升高。 故加入氯化钠后,水的凝固点 降低,所得溶液的温度可能低于
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
一、单选题
1.配制6%的氯化钠溶液50 g,在量取所需的水时俯视读数(其他操作正确),则配制的溶液中溶质的质量分数( )
A.大于6%
B.小于6%
C.等于6%
D.无法判断
2. 下列叙述不正确的是( )
A. 在水净化的单一操作中,蒸馏是净化程度较高的方法之一
B. 常用肥皂水检验硬水和软水
C. 用密度约为1.04g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平
D. 用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
3.配制一定质量分数的食盐水,不需要使用的仪器是( )
A. 玻璃棒 B. 烧杯 C. 药匙 D. 量筒
4.下列实验符合规范要求的是( )
A. “高锰酸钾制取氧气”实验中,收集好气体后先将导管移出水槽后停止加热
B. “净化浑浊的河水”实验中,过滤时将悬浊液直接倒入漏斗里
C. “配制一定溶质质量分数的溶液”实验中,多余的药品应放回原瓶
D. “二氧化碳的制取和性质”实验中,用稀硫酸与石灰石反应
5.要配制100 g溶质质量分数为10%的氯化钠溶液,下列说法正确的是( )
A.配制步骤为称量、溶解、装瓶
B.称量10 g氯化钠固体,量取90 mL水
C.为加快固体溶解,用温度计搅拌溶液
D.需要的玻璃仪器有:烧杯、量筒、细口瓶
6.溶解硝酸钾固体,必须使用的一组仪器是( )
A.玻璃棒、烧杯 B.烧杯、石棉网
C.铁架台、蒸发皿 D.试管、漏斗
7.小丽在学习了某些化学知识后,梳理归纳了以下结论:
①“低碳”就是指降低二氧化碳的排放
②具有相同质子数的粒子是同种元素的原子
③配制0.9%的生理盐水,量取水时,仰视量筒刻度会使所配氯化钠溶液溶质质量分数偏低
④除去氧气中混有的一氧化碳,可通过灼热氧化铁
⑤合金的许多性能优于组成该合金的单一金属,如硬度大、强度大、熔点高、抗腐蚀性好,因此应用广泛
⑥微量元素在人体内含量很少,但作用不小,如缺钙元素会得骨质疏松,缺碘元素会得甲状腺肿大。其中正确的个数有( )
A.1个 B.2个 C.3个 D.4个
8.下列实验操作错误的是( )
A.溶解固体 B.滴加液体
C.检验氢气的纯度 D.检查蜡烛燃烧生成水
二、填空题
9.欲在实验室配制100 g 16%的氯化钠溶液进行选种,判断下列做法是否正确,将错误改正。
A.计算:需要16 g氯化钠,100 g水________ ;
B.称量:用托盘天平称量所需的氯化钠________;
C.量取:用50 mL量筒量取所需的水________;
D.溶解:将称得的氯化钠倒入量筒溶解________。
10.如图是小梅配制100 g溶质质量分数为12%的NaCl溶液的实验操作示意图:
(1)图中的玻璃仪器分别是广口瓶、量筒、烧杯和________。
(2)指出图中的一处错误操作:________。
(3)配制时应选择________mL(10 mL或50 mL或100 mL)的量筒量取所需要的水.
(4)用图示的序号表示配制溶液的操作顺序________。
11.配制一瓶如图的溶液需氯化钠________g;配制50g 6%的氯化钠溶液,量筒量取水时仰视读数(其他操作正确),所得溶液的质量分数________6%(填“>”、“<”或“=”).
12.实验室欲配制一定溶质质量分数的NaCl溶液100 g。
(1)根据下图回答问题。
①仪器A的名称是________。
②配制一定溶质质量分数的NaCl溶液所需的仪器有托盘天平、烧杯、玻璃棒、________(填字母序号)、药匙、胶头滴管。
(2)配制过程包括以下步骤:
①计算
②称取10 g NaCl固体,放入烧杯中;
③量取90 mL 水(水的密度可近似看做1 g/cm3),倒入盛有氯化钠的烧杯中;
④溶解:________ , 使氯化钠溶解。
⑤装入试剂瓶,贴上标签。标签上应写________。
(3)取9 g上述溶液配制溶质的质量分数为0.9%的生理盐水,需加水________g。
13.泡菜具有独特的风味,适合制作泡菜的食盐水浓度是4%.在配制4%的食盐水2000g时,下列做法:①用80g食盐和2000g水配制溶液;②称量食盐时(1克以下用游码),食盐放在右盘的纸上;③量水的体积时,俯视量筒;④溶解食盐的烧杯内壁是潮湿的;其单一错误会导致溶液浓度偏小的是 ________ .
三、实验探究题(共2题;共12分)
14.塘沽十一中化学学习小组同学在实验室中练习配制一定溶质质量分数的溶液。
(1)用氯化钠固体配制50 g质量分数为6%的氯化钠溶液:
①需要氯化钠的质量为________g。
②称取氯化钠时,若托盘天平出现了右盘低的现象(如图A),接下来的操作应是________(填字母)。
A.左边的平衡螺母向左调
B.右盘中添加砝码
C.向左移动游码
D.左盘中增加氯化钠
③量取水时,若仰视读数(如图B),会使配制的溶液溶质质量分数________(填“偏大”或“偏小”)。
(2)用已配好的质量分数为6%的氯化钠溶液,配制50 g质量分数为3%的氯化钠溶液:
①需要质量分数为6%的氯化钠溶液________mL(质量分数为6%的氯化钠溶液的密度为1.04 g/cm3),水________mL(水的密度为1 g/cm3)。
②本实验需要用到的仪器有________。
(3)把配制好的上述两种溶液分别装入________中(填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签。
15.化学实验活动中,老师要求学生配制100 g溶质质量分数为8%的氯化钠溶液,实验操作如下:
(1)此实验操作顺序排列正确的是 (填写编号)。
A.④①②⑤③
B.④②①⑤③
C.②④①③⑤
D.④②①③⑤
(2)老师先在讲台上按照操作步骤完整的演示了一遍实验过程,第一小组的同学在实验时发现他们组的天平是坏的,老师把演示用的天平拿给他们使用,第一小组的同学拿到天平后________(填“需要”或“不需要”)调平。
(3)若在操作②中,某学生用托盘天平称量NaCl固体,调平后称量,发现指针向左偏转,此时应 。
A.加砝码 B.减少药品
C.加药品 D.调节螺丝向左旋
四、综合题(共2题;共15分)
16.酸、碱、盐在生产生活中具有广泛的用途。制作“叶脉书签”需要用到10%的氢氧化钠溶液,现要配制50克质量分数为10%的氢氧化钠溶液:
(1)若用固体氢氧化钠配制,需氢氧化钠固体_______克,水_______毫升(水的密度为1g/cm3)。
(2)固体氢氧化钠配制10%的氢氧化钠溶液过程中需要的仪器除了托盘天平、量筒、胶头滴管、药匙、试剂瓶外还需要 ________和________。配制50克质量分数为10%的氢氧化钠溶液时,应选用_____mL的量筒来量取水(填10mL或50mL)。
(3)配制溶液时,下列操作正确的是__________(填序号)
A.在托盘天平的左右托盘上垫滤纸称量氢氧化钠固体
B.称量氢氧化钠固体时,左盘放砝码
C.将称量准确的氢氧化钠固体放到装好水的量筒中溶解
D.将配好的氢氧化钠溶液装入试剂瓶中,塞好瓶塞,贴上标签
17.为配制的氯化钠饱和溶液,并粗略测定时氯化钠的溶解度。进行了下列实验操作:
称取 氯化钠粉末。
量取的水密度可视为倒入烧杯中。
将氯化钠逐步加入水中,用玻璃棒搅拌至不能溶解。
过滤出未溶解的氯化钠,并称得剩余氯化钠质量为。
步骤、、中不必用到的仪器是______。写字母序号
步骤中用玻璃棒搅拌的目的是______。
本实验中氯化钠的溶解度为______。
步骤中,若量取水时俯视读数。将导致所配制的饱和溶液中氯化钠的质量分数______填“偏大”、“偏小”或“不变”。
为保证实验温度是,有人建议将氯化钠投入70g冷水和30g冰组成的冰水混合物中搅拌至冰块恰好消失时再进行步骤。
小明认为该建议不合理,他的理由是______。
参考答案
一、单选题
1.A 2.C 3.C 4.A 5.B 6.A7.A8.C
二、填空题
9.错误 水的质量应为84 g 正确 错误;应用100 mL量筒 错误;应将称得的氯化钠倒入烧杯中溶解
10.玻璃棒 ②中氯化钠与砝码的位置颠倒 100 ④②①⑤③
11.【答案】4.5;<
【解析】【解答】解:500mL=500cm3 , 溶质质量=溶液质量×溶质的质量分数,配制一瓶如图的溶液需氯化钠的质量为1.0g/cm3×500cm3×0.9%=4.5g. 配制50g6%的氯化钠溶液,用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,则使溶质质量分数偏小.
故答案为:4.5;<.
【分析】根据溶质质量=溶液质量×溶质的质量分数,用量筒量取水时,仰视液面,读数比实际液体体积小,会造成实际量取的水的体积偏大,进行分析解答.
12.【答案】试管 ;C;用玻璃棒搅拌;10% NaCl溶液(或10%氯化钠溶液);91
【解析】【解答】(1)①根据实验室常用仪器回答,仪器A的名称是试管;
②根据配制一定溶质质量分数的溶液的步骤(计算、称量、溶解),来确定所用的仪器,配制一定溶质质量分数的溶液,需要药匙、胶头滴管、量筒、玻璃棒和烧杯。故选C
(2)④在配制溶液的过程中,溶解时,常用玻璃棒搅拌,以加速溶解。
⑤根据题意,标签上应写明溶液的组成,以及其溶质质量分数,故填写10%氯化钠溶液。
(3)根据溶质质量分数= ×100%可知,该实验配制的溶液的溶质质量分数=×100%=10%,而用上述溶液配制溶质的质量分数为0.9%的生理盐水,是对溶液的稀释,在溶液稀释的前后,改变的是溶剂的质量,而溶质质量不变。
设取9g上述溶液配制溶质的质量分数为0.9%的生理盐水,需加水xg
则9g×10%=(9g+x)×0.9%
解得x=91g
【分析】化学是以实验为基础的学科,熟悉常见仪器的使用方法与注意事项,掌握化学实验基本操作是解答此类题目的关键。
13.【答案】①④
【解析】【解答】①用80g食盐和2000g水配制溶液,而实际需用的水是1920g,因此结果偏小;
②称量食盐时(1克以下用游码),食盐放在右盘的纸上,而食盐需用是80g,不要游码,因此不影响;
③量水的体积时,俯视量筒,会使水少,结果偏大;
④溶解食盐的烧杯内壁是潮湿的,相当于水多了,因此结果偏小;
故答案为:①④.
【分析】溶质氯化钠质量偏小或溶剂水的体积偏大,是导致配制氯化钠溶液时溶质质量分数偏小即溶液中NaCl质量分数小于4%的原因.三、实验探究题
14.(1)3 D 偏小
(2)24 25 量筒、烧杯、玻璃棒、胶头滴管
(3)细口瓶
15.(1)B (2)需要 (3)B
四、综合题
16.545玻璃棒烧杯50D
【解析】
【详解】
(1)需要氢氧化钠固体的质量=50g×10%=5g;因溶液质量为50g,故需要溶剂水的质量为45g,水的密度为1g/cm3,故水的体积为45毫升;
(2)配制溶液时还需要在烧杯中进行溶解,同时利用玻璃棒搅拌,加速溶解,故需要烧杯和玻璃棒;由(1)可知,需要水的体积为45毫升,故需要用50毫升的量筒;
(3)A、在托盘天平的左右托盘上垫滤纸称量氢氧化钠固体,会腐蚀纸,应该放在小烧杯中称量,故操作错误; B.称量氢氧化钠固体时,应该砝码放在右盘,氢氧化钠放在左边,故操作错误; C.将准确称量的氢氧化钠固体放入装有水的烧杯中溶解,而不能在量筒内溶解,故操作错误;D.将配制好的氢氧化钠溶液装入试剂瓶中,塞好瓶塞并贴上标签,故操作正确。故本题选D。
17. A 加快氯化钠的溶解 不变 氯化钠可以降低水的凝固点
【解析】(1)称取固体用托盘天平和药匙、量取液体用量筒和胶头滴管、溶解需要的仪器是烧杯和玻璃棒,都不必用到的仪器是酒精灯;(2)溶解中用玻璃棒搅拌的目的是加速溶解;(3) 溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量;本实验中氯化钠的溶解度为40g-4.3g=35.7g;(4) ,影响溶解度的因素有:温度、溶质和溶剂的性质(或种类)。步骤②中,若量取水时俯视读数,导致量取水的体积偏小,但所配制的饱和溶液中氯化钠的质量分数不变;(5)冰水混合物的温度为0℃;形成混合物,可以是物质的熔点降低,沸点升高。 故加入氯化钠后,水的凝固点 降低,所得溶液的温度可能低于
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
