第三章 空气与生命 单元测试(含答案)
文档属性
| 名称 | 第三章 空气与生命 单元测试(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 406.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-02-18 19:21:18 | ||
图片预览


文档简介
空气与生命 单元测试
一,单项选择题(本题共16小题,共32分。每小题给出的四个选项中,只有一个选项正确,选对得2分)
1.如图是特色菜“纸锅烧豆腐”。将盛有豆腐、水和调味品的纸锅直接放在固体酒精上烧,发现纸锅不会被烧坏;小明认为是纸锅里的水在沸腾时到达沸点后温度不变,达不到使纸燃烧的温度。下列操作能证明小明观点的是
A.把空纸锅放在酒精上烧 B.把纸锅换成铁锅
C.把固体酒精换成煤气灶 D.用扇子加大火力
2.小科用研钵将约20克氢氧化钡[Ba(OH)2]晶体磨成粉末,倒入一小烧杯。在玻璃片上洒上少量水,并将小烧杯放在玻璃片上、再向小烧杯中加入约10克氯化铵[NHCl]晶体,并用玻璃棒迅速搅拌,烧杯中产生刺激性气味的气体,静止片刻,提起小烧杯,观察到如图所示现象。下列对现象的观察分析中正确的是( )
A.用手触摸烧杯外壁,能感觉到发热
B.化学反应中,不同形式的能之间可以相互转化
C.把氢氧化钡晶体磨成粉末可以增加最终产生气体的质量
D.该反应和燃烧一样,反应物总的化学能高于生成物总的化学能
3.与有氧呼吸相比,生物的无氧呼吸特点是( )
A.不需要酶的参与
B.一定产生乳酸
C.没有二氧化碳生成
D.产生能量较少
4.如图,“白沙”是塘栖枇杷名种。要获得优质高产的枇杷,需经过幼苗移栽、嫁接和合理密植等过程,以下认识正确的是( )
A.图中A所示结构是由胚珠发育而来的
B.合理密植能让植株充分接受光照,提高总产量
C.幼苗带土移栽是为了使根能更好地从土壤中吸收有机物
D.嫁接能保持亲本的优良性状,但繁殖速度慢
5.运用科学知识可以解决许多生活实际问题,下列有关做法正确的是( )
A.室内起火,及时打开门窗通风
B.发现煤气泄漏时,立即打开排气扇电源开关
C.电器或电线着火时,立即用水扑灭
D.室内浓烟密布时,用湿毛巾掩住口鼻俯身撤离
6.下图实验能证明土壤中含有空气的是( )
A. B.
C. D.
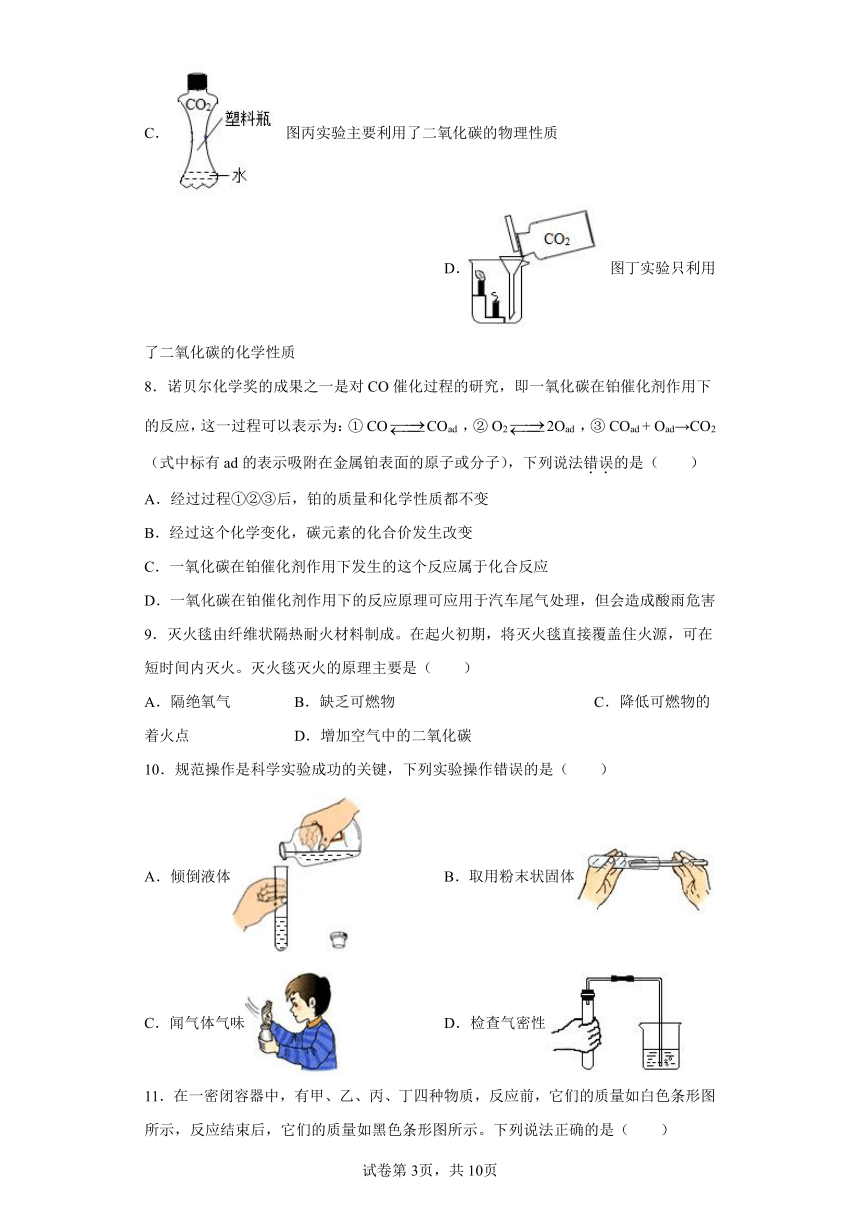
7.课堂上,老师给同学们做了如下几个演示实验。下列说法错误的是( )
A. 图甲实验可观察到澄清石灰水变浑浊 B. 图乙实验可观察到液体由紫色变红色
C. 图丙实验主要利用了二氧化碳的物理性质 D. 图丁实验只利用了二氧化碳的化学性质
8.诺贝尔化学奖的成果之一是对CO催化过程的研究,即一氧化碳在铂催化剂作用下的反应,这一过程可以表示为:① COCOad ,② O22Oad ,③ COad + Oad→CO2(式中标有ad的表示吸附在金属铂表面的原子或分子),下列说法错误的是( )
A.经过过程①②③后,铂的质量和化学性质都不变
B.经过这个化学变化,碳元素的化合价发生改变
C.一氧化碳在铂催化剂作用下发生的这个反应属于化合反应
D.一氧化碳在铂催化剂作用下的反应原理可应用于汽车尾气处理,但会造成酸雨危害
9.灭火毯由纤维状隔热耐火材料制成。在起火初期,将灭火毯直接覆盖住火源,可在短时间内灭火。灭火毯灭火的原理主要是( )
A.隔绝氧气 B.缺乏可燃物 C.降低可燃物的着火点 D.增加空气中的二氧化碳
10.规范操作是科学实验成功的关键,下列实验操作错误的是( )
A.倾倒液体 B.取用粉末状固体
C.闻气体气味 D.检查气密性
11.在一密闭容器中,有甲、乙、丙、丁四种物质,反应前,它们的质量如白色条形图所示,反应结束后,它们的质量如黑色条形图所示。下列说法正确的是( )
A.该反应为化合反应 B.丙一定是该反应的催化剂
C.甲、乙的相对分子质量之比一定为2∶3
D.反应过程中甲和丁变化的质量比为2∶1
12.2020年节能减排主题“携手节能低碳,共建碧水蓝天”,下列做法符合这一主题的是( )
A.冬天使用热空调时调高1℃ B.购买使用能效等级较高的冰箱
C.燃放烟花爆竹,增强节日气氛 D.提倡骑自行车或步行的方式出行
13.呼吸运动是人体重要的生命活动,下列有关说法正确的是( )
A.呼气时肺内气压小于外界大气压
B.吸气时,膈肌收缩,膈顶部上升,胸腔容积扩大
C.呼吸时,呼出的气体成分中二氧化碳多于氧气
D.空气从外界进入肺的路线:鼻→咽→喉→气管→支气管→肺泡
14.生活垃圾一般可分为四大类:可回收垃圾、厨余垃圾、有害垃圾和其他垃圾。分类的目的是提高垃圾的资源价值和经济价值,力争物尽其用。下列垃圾分类合理的是( )
A.可回收垃圾:旧报纸、矿泉水瓶
B.厨余垃圾:菜根烂叶、饮料包装盒
C.有害垃圾:破碎玻璃、废铜烂铁
D.其他垃圾:废旧电池、卫生间废纸
15.在一定条件下,某反应的微观示意图如下,下列说法正确的是( )
A.该反应属于分解反应 B.反应前后各元素的化合价都未发生改变
C.反应前后分子的种类和个数没变 D.该反应的化学方程式为:
16.工业上可以用甲烷制合成气,如图所示是反应的微观示意图。下列说法不正确的是( )
A.图中甲为甲烷,化学式为CH4 B.乙和丙都属于氧化物
C.参加反应的甲和乙的质量比是5:3 D.生成的丙和丁的分子个数比为1:3
二、填空题(共6小题,共32分)
17.如图所示,用坩埚钳夹取一小块木炭,在酒精灯上加热后插入到盛有氧气的集气瓶中,当木炭燃尽后,向集气瓶中倒入足量澄清石灰水,请回答下列问题:
(1)B、C两实验操作观察到的现象有所不同,B操作中的现象是___________;
(2)写出D实验操作中涉及的化学方程式___________。
18.我们依据反应事实,通过比较、推理等方法可以总结归纳出灭火的规律并加以应用,请回答下列问题:图A.所示的“火三角”可表示燃烧的条件,图中缺少的一个条件是___________;图B所示的灭火原理是:___________;点燃篝火时,常将木柴架空以促进燃烧,是利用了增大___________的方法。
19.氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。如图所示是硫、红磷、光亮的细铁丝在氧气中燃烧的实验装置:
在反应基本类型方面,三个化学反应都是______反应。乙中生成物的名称是______;甲中观察到的反应现象是______。小明还总结出:三个实验的集气瓶底部都放有少量水,其中丙集气瓶底部放少量水的目的是______。
20.2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为下图所示的4类:
(1)可回收物将被运输到再生资源企业进行分拣和资源化利用,实现变废为宝。以下四种物品中属于可回收垃圾的是___________
A.破碎的砖瓦陶瓷B.过期的化妆品
C.用过的报刊书籍 D.吃剩的瓜皮果核
(2)厨房垃圾经过处理会产生沼气,沼气可以作为燃料。已知沼气的主要成分是甲烷(CH4),甲烷完全燃烧会生成二氧化碳和水,请写出甲烷完全燃烧的化学方程式___________。
(3)其它垃圾也称为干垃圾,最后被运输到生活垃圾焚烧发电厂进行焚烧发电,该过程的主要能量转化是___________。
(4)废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属___________(选填“元素”或“单质”)。
21.在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量数据如下表所示,请填写下列未知数据:
②______③______④______。
物质 a b c d
反应前的质量(g) 10 10 0 0
反应中的质量(g) 6 2 2 ①
反应后的质量(g) ② 0 ③ ④
22.小金对物质燃烧知识进行了整理并探究。
(1)按如图甲所示进行木炭燃烧的实验:
①木炭在氧气中燃烧的现象是___________;②检验集气瓶中木炭燃烧产物的方法是___________。
(2)按如图乙所示进行燃烧条件的相关探究:(已知:白磷的着火点为40℃,红磷的着火点为260℃,两者都能燃烧生成有毒的五氧化二磷)
①图a是甲同学设计的方案示意图,根据___________的现象,说明可燃物燃烧需要氧气。
②乙同学设计的另一方案如图b所示,与甲同学的方案相比,该方案的优点是___________。
三、探究题(每空2分,共22分)
23.小刚同学在帮妈妈做饭时观察到液化气燃烧的现象,他认为液化气燃烧应属于化学变化。小刚在妈妈的帮助下对此展开了探究。请你参与他的探究过程并回答有关问题。
【提出问题】液化气燃烧是化学变化吗?
【查阅资料】液化气是由碳、氢两种元素组成的混合物。
【猜想与假设】(1)对于液化气燃烧是否为化学变化,小刚首先做出假设。
【收集证据】小刚设计了下列实验来验证自己的猜想:
(2)打开液化气,并将其调至小火,把一只干冷的玻璃杯罩在火焰上,观察到:
①玻璃杯内壁出现__________;②手摸玻璃杯壁有__________感觉。
③将玻璃杯迅速倒置,向其中加入少量澄清石灰水,振荡。观察到___________。
(3)分析:液化气燃烧产生的新物质是___________。
【获得结论】
(4)液化气燃烧为化学变化
24.某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)根据下列制取氧气的装置图回答问题。
写出实验仪器③的名称______。
(2)乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的质量 双氧水的浓度 的质量 相同的时间内产生的体积
Ⅰ 1%
Ⅱ 2%
Ⅲ 4%
本实验中,测量氧气的装置是(如图甲)______(从、和中选择合适的编号)
实验结论:在相同条件下,______,双氧水分解得越快。
用图乙装置进行出的三个实验,也能得到相同的实验结论,你认为他称量的是:______。
A.分别称量反应前后双氧水的质量
B.分别称量反应前后二氧化锰的质量
C.记录相同时间天平读数差值
25.人体内有很多种酶,不同的酶催化体内不同的化学反应。例如过氧化氢酶能催化H2O2分解,这种酶在马铃薯体内也存在。某同学将马铃薯块茎磨碎、过滤得到提取液进行了两组实验:
实验Ⅰ:在温度30℃的条件下,取等量提取液分别加到四支盛有等量等浓度的H2O2溶液、pH分别为3、5、7、9的试管中,结果每一支试管都产生气体。
实验Ⅱ:将加入四支试管中的马铃薯提取液的量减半,重复实验Ⅰ。
分别测定实验Ⅰ、Ⅱ中H2O2在相同时间内的含量变化,绘制成如图所示曲线,请回答:
(1)实验Ⅰ和实验Ⅱ的变量是___________;
(2)曲线A是实验___________(选填“Ⅰ”、“Ⅱ”)的结果;
(3)曲线A和B中,H2O2的含量的最低点位于横坐标同一位置的原因是___________。
四、简答题
26.(6分)某学习小组在实验室中用加热和混合物的方法制取,反应过程中固体质量变化如图所示,请计算。
(1)制取的质量是多少克?______
(2)混合物中的质量分数______。(写出计算过程,计算结果精确到0.1%)
27.(8分)由氯酸钾和二氧化锰组成的混合物的质量为29.5g。把该混合物放到试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为19.9g。
(1)求生成氧气的质量
(2)求原混合物中氯酸钾的质量。
(3)反应后试管中固体物质是什么?它们的质量各是多少?试卷第1页,共3页
试卷第1页,共3页
参考答案:
1-5 ABDBD 6-10ADDAA 11-15 DDAAD 16 C
17.发出红光,放出热量 CO2+Ca(OH)2=CaCO3↓+H2O
18.可燃物 使可燃物与氧气隔绝 可燃物与氧气的接触面积
19. 化合 五氧化二磷 产生蓝紫色火焰 防止铁燃烧生成的高温熔融物溅落,
20. C CH4+2O2CO2+2H2O 化学能转化为电能 元素
21. 5 2.5 12.5
22. 发出白光,放热 反应结束后,向集气瓶中加入澄清石灰水,石灰水变浑浊,说明产物是二氧化碳 铜片上的白磷燃烧,热水中的白磷不能燃烧 无污染
23. 水雾 发烫 澄清石灰水变浑浊 水和二氧化碳
24. 分液漏斗 c 双氧水的浓度越大 C
25. 马铃薯提取液的多少(或过氧化氢酶的的含量) Ⅱ 同一种酶的最适pH值是一定的,不会由于浓度的不同而改变
(1)由题意可知,实验Ⅰ和实验Ⅱ的变量是马铃薯提取液的多少(或过氧化氢酶的的含量)。
(2)将加入四支试管中的马铃薯提取液的量减半时,过氧化氢酶的量也减半,催化效果减弱,因此曲线A是实验Ⅱ的结果。
(3)曲线A和B中,H2O2的含量的最低点位于横坐标同一位置的原因是同一种酶的最适pH值是一定的,不会由于浓度的不同而改变。
26. 19.2克 解:设参加反应的氯酸钾的质量为x
=
x=49g
混合物中氯酸钾的质量分数=×100%≈81.7%
答:混合物中氯酸钾的质量分数为81.7%。
27. 9.6g 24.5g 氯化钾和二氧化锰 14.9g、5g
(1)在加热条件和二氧化锰的催化作用下,氯酸钾分解生成氯化钾和氧气。催化剂在化学反应前后化学性质和质量不发生改变,因此,反应后试管中的固体是生成的氯化钾和催化剂二氧化锰的混合物共19.9g,反应前氯酸钾和二氧化锰的总质量为29.5g,减少9.6g就是生成的氧气的质量,故填:9.6g;
(2)设原混合物中氯酸钾的质量为x
x=24.5g
故填:24.5g;
(3)根据质量守恒定律知,参加反应的氯酸钾的质量等于生成氯化钾和氧气的质量,因此氯化钾的质量为:24.5g-9.6g=14.9g,二氧化锰的质量为:29.5g-24.5g=5g;故填:氯化钾和二氧化锰;14.9g、5g。
答案第1页,共2页
答案第1页,共2页
一,单项选择题(本题共16小题,共32分。每小题给出的四个选项中,只有一个选项正确,选对得2分)
1.如图是特色菜“纸锅烧豆腐”。将盛有豆腐、水和调味品的纸锅直接放在固体酒精上烧,发现纸锅不会被烧坏;小明认为是纸锅里的水在沸腾时到达沸点后温度不变,达不到使纸燃烧的温度。下列操作能证明小明观点的是
A.把空纸锅放在酒精上烧 B.把纸锅换成铁锅
C.把固体酒精换成煤气灶 D.用扇子加大火力
2.小科用研钵将约20克氢氧化钡[Ba(OH)2]晶体磨成粉末,倒入一小烧杯。在玻璃片上洒上少量水,并将小烧杯放在玻璃片上、再向小烧杯中加入约10克氯化铵[NHCl]晶体,并用玻璃棒迅速搅拌,烧杯中产生刺激性气味的气体,静止片刻,提起小烧杯,观察到如图所示现象。下列对现象的观察分析中正确的是( )
A.用手触摸烧杯外壁,能感觉到发热
B.化学反应中,不同形式的能之间可以相互转化
C.把氢氧化钡晶体磨成粉末可以增加最终产生气体的质量
D.该反应和燃烧一样,反应物总的化学能高于生成物总的化学能
3.与有氧呼吸相比,生物的无氧呼吸特点是( )
A.不需要酶的参与
B.一定产生乳酸
C.没有二氧化碳生成
D.产生能量较少
4.如图,“白沙”是塘栖枇杷名种。要获得优质高产的枇杷,需经过幼苗移栽、嫁接和合理密植等过程,以下认识正确的是( )
A.图中A所示结构是由胚珠发育而来的
B.合理密植能让植株充分接受光照,提高总产量
C.幼苗带土移栽是为了使根能更好地从土壤中吸收有机物
D.嫁接能保持亲本的优良性状,但繁殖速度慢
5.运用科学知识可以解决许多生活实际问题,下列有关做法正确的是( )
A.室内起火,及时打开门窗通风
B.发现煤气泄漏时,立即打开排气扇电源开关
C.电器或电线着火时,立即用水扑灭
D.室内浓烟密布时,用湿毛巾掩住口鼻俯身撤离
6.下图实验能证明土壤中含有空气的是( )
A. B.
C. D.
7.课堂上,老师给同学们做了如下几个演示实验。下列说法错误的是( )
A. 图甲实验可观察到澄清石灰水变浑浊 B. 图乙实验可观察到液体由紫色变红色
C. 图丙实验主要利用了二氧化碳的物理性质 D. 图丁实验只利用了二氧化碳的化学性质
8.诺贝尔化学奖的成果之一是对CO催化过程的研究,即一氧化碳在铂催化剂作用下的反应,这一过程可以表示为:① COCOad ,② O22Oad ,③ COad + Oad→CO2(式中标有ad的表示吸附在金属铂表面的原子或分子),下列说法错误的是( )
A.经过过程①②③后,铂的质量和化学性质都不变
B.经过这个化学变化,碳元素的化合价发生改变
C.一氧化碳在铂催化剂作用下发生的这个反应属于化合反应
D.一氧化碳在铂催化剂作用下的反应原理可应用于汽车尾气处理,但会造成酸雨危害
9.灭火毯由纤维状隔热耐火材料制成。在起火初期,将灭火毯直接覆盖住火源,可在短时间内灭火。灭火毯灭火的原理主要是( )
A.隔绝氧气 B.缺乏可燃物 C.降低可燃物的着火点 D.增加空气中的二氧化碳
10.规范操作是科学实验成功的关键,下列实验操作错误的是( )
A.倾倒液体 B.取用粉末状固体
C.闻气体气味 D.检查气密性
11.在一密闭容器中,有甲、乙、丙、丁四种物质,反应前,它们的质量如白色条形图所示,反应结束后,它们的质量如黑色条形图所示。下列说法正确的是( )
A.该反应为化合反应 B.丙一定是该反应的催化剂
C.甲、乙的相对分子质量之比一定为2∶3
D.反应过程中甲和丁变化的质量比为2∶1
12.2020年节能减排主题“携手节能低碳,共建碧水蓝天”,下列做法符合这一主题的是( )
A.冬天使用热空调时调高1℃ B.购买使用能效等级较高的冰箱
C.燃放烟花爆竹,增强节日气氛 D.提倡骑自行车或步行的方式出行
13.呼吸运动是人体重要的生命活动,下列有关说法正确的是( )
A.呼气时肺内气压小于外界大气压
B.吸气时,膈肌收缩,膈顶部上升,胸腔容积扩大
C.呼吸时,呼出的气体成分中二氧化碳多于氧气
D.空气从外界进入肺的路线:鼻→咽→喉→气管→支气管→肺泡
14.生活垃圾一般可分为四大类:可回收垃圾、厨余垃圾、有害垃圾和其他垃圾。分类的目的是提高垃圾的资源价值和经济价值,力争物尽其用。下列垃圾分类合理的是( )
A.可回收垃圾:旧报纸、矿泉水瓶
B.厨余垃圾:菜根烂叶、饮料包装盒
C.有害垃圾:破碎玻璃、废铜烂铁
D.其他垃圾:废旧电池、卫生间废纸
15.在一定条件下,某反应的微观示意图如下,下列说法正确的是( )
A.该反应属于分解反应 B.反应前后各元素的化合价都未发生改变
C.反应前后分子的种类和个数没变 D.该反应的化学方程式为:
16.工业上可以用甲烷制合成气,如图所示是反应的微观示意图。下列说法不正确的是( )
A.图中甲为甲烷,化学式为CH4 B.乙和丙都属于氧化物
C.参加反应的甲和乙的质量比是5:3 D.生成的丙和丁的分子个数比为1:3
二、填空题(共6小题,共32分)
17.如图所示,用坩埚钳夹取一小块木炭,在酒精灯上加热后插入到盛有氧气的集气瓶中,当木炭燃尽后,向集气瓶中倒入足量澄清石灰水,请回答下列问题:
(1)B、C两实验操作观察到的现象有所不同,B操作中的现象是___________;
(2)写出D实验操作中涉及的化学方程式___________。
18.我们依据反应事实,通过比较、推理等方法可以总结归纳出灭火的规律并加以应用,请回答下列问题:图A.所示的“火三角”可表示燃烧的条件,图中缺少的一个条件是___________;图B所示的灭火原理是:___________;点燃篝火时,常将木柴架空以促进燃烧,是利用了增大___________的方法。
19.氧气是一种化学性质比较活泼的气体,它可以和许多物质发生化学反应。如图所示是硫、红磷、光亮的细铁丝在氧气中燃烧的实验装置:
在反应基本类型方面,三个化学反应都是______反应。乙中生成物的名称是______;甲中观察到的反应现象是______。小明还总结出:三个实验的集气瓶底部都放有少量水,其中丙集气瓶底部放少量水的目的是______。
20.2019年6月21日,杭州市开始在全市范围稳步推进垃圾分类管理,将生活垃圾分为下图所示的4类:
(1)可回收物将被运输到再生资源企业进行分拣和资源化利用,实现变废为宝。以下四种物品中属于可回收垃圾的是___________
A.破碎的砖瓦陶瓷B.过期的化妆品
C.用过的报刊书籍 D.吃剩的瓜皮果核
(2)厨房垃圾经过处理会产生沼气,沼气可以作为燃料。已知沼气的主要成分是甲烷(CH4),甲烷完全燃烧会生成二氧化碳和水,请写出甲烷完全燃烧的化学方程式___________。
(3)其它垃圾也称为干垃圾,最后被运输到生活垃圾焚烧发电厂进行焚烧发电,该过程的主要能量转化是___________。
(4)废电池属于“有害垃圾”,主要是因为废电池里含有大量的汞、镉、锰、铅等重金属___________(选填“元素”或“单质”)。
21.在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量数据如下表所示,请填写下列未知数据:
②______③______④______。
物质 a b c d
反应前的质量(g) 10 10 0 0
反应中的质量(g) 6 2 2 ①
反应后的质量(g) ② 0 ③ ④
22.小金对物质燃烧知识进行了整理并探究。
(1)按如图甲所示进行木炭燃烧的实验:
①木炭在氧气中燃烧的现象是___________;②检验集气瓶中木炭燃烧产物的方法是___________。
(2)按如图乙所示进行燃烧条件的相关探究:(已知:白磷的着火点为40℃,红磷的着火点为260℃,两者都能燃烧生成有毒的五氧化二磷)
①图a是甲同学设计的方案示意图,根据___________的现象,说明可燃物燃烧需要氧气。
②乙同学设计的另一方案如图b所示,与甲同学的方案相比,该方案的优点是___________。
三、探究题(每空2分,共22分)
23.小刚同学在帮妈妈做饭时观察到液化气燃烧的现象,他认为液化气燃烧应属于化学变化。小刚在妈妈的帮助下对此展开了探究。请你参与他的探究过程并回答有关问题。
【提出问题】液化气燃烧是化学变化吗?
【查阅资料】液化气是由碳、氢两种元素组成的混合物。
【猜想与假设】(1)对于液化气燃烧是否为化学变化,小刚首先做出假设。
【收集证据】小刚设计了下列实验来验证自己的猜想:
(2)打开液化气,并将其调至小火,把一只干冷的玻璃杯罩在火焰上,观察到:
①玻璃杯内壁出现__________;②手摸玻璃杯壁有__________感觉。
③将玻璃杯迅速倒置,向其中加入少量澄清石灰水,振荡。观察到___________。
(3)分析:液化气燃烧产生的新物质是___________。
【获得结论】
(4)液化气燃烧为化学变化
24.某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)根据下列制取氧气的装置图回答问题。
写出实验仪器③的名称______。
(2)乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的质量 双氧水的浓度 的质量 相同的时间内产生的体积
Ⅰ 1%
Ⅱ 2%
Ⅲ 4%
本实验中,测量氧气的装置是(如图甲)______(从、和中选择合适的编号)
实验结论:在相同条件下,______,双氧水分解得越快。
用图乙装置进行出的三个实验,也能得到相同的实验结论,你认为他称量的是:______。
A.分别称量反应前后双氧水的质量
B.分别称量反应前后二氧化锰的质量
C.记录相同时间天平读数差值
25.人体内有很多种酶,不同的酶催化体内不同的化学反应。例如过氧化氢酶能催化H2O2分解,这种酶在马铃薯体内也存在。某同学将马铃薯块茎磨碎、过滤得到提取液进行了两组实验:
实验Ⅰ:在温度30℃的条件下,取等量提取液分别加到四支盛有等量等浓度的H2O2溶液、pH分别为3、5、7、9的试管中,结果每一支试管都产生气体。
实验Ⅱ:将加入四支试管中的马铃薯提取液的量减半,重复实验Ⅰ。
分别测定实验Ⅰ、Ⅱ中H2O2在相同时间内的含量变化,绘制成如图所示曲线,请回答:
(1)实验Ⅰ和实验Ⅱ的变量是___________;
(2)曲线A是实验___________(选填“Ⅰ”、“Ⅱ”)的结果;
(3)曲线A和B中,H2O2的含量的最低点位于横坐标同一位置的原因是___________。
四、简答题
26.(6分)某学习小组在实验室中用加热和混合物的方法制取,反应过程中固体质量变化如图所示,请计算。
(1)制取的质量是多少克?______
(2)混合物中的质量分数______。(写出计算过程,计算结果精确到0.1%)
27.(8分)由氯酸钾和二氧化锰组成的混合物的质量为29.5g。把该混合物放到试管中加热,反应完全后,冷却到反应前的温度,称得试管中固体物质的质量为19.9g。
(1)求生成氧气的质量
(2)求原混合物中氯酸钾的质量。
(3)反应后试管中固体物质是什么?它们的质量各是多少?试卷第1页,共3页
试卷第1页,共3页
参考答案:
1-5 ABDBD 6-10ADDAA 11-15 DDAAD 16 C
17.发出红光,放出热量 CO2+Ca(OH)2=CaCO3↓+H2O
18.可燃物 使可燃物与氧气隔绝 可燃物与氧气的接触面积
19. 化合 五氧化二磷 产生蓝紫色火焰 防止铁燃烧生成的高温熔融物溅落,
20. C CH4+2O2CO2+2H2O 化学能转化为电能 元素
21. 5 2.5 12.5
22. 发出白光,放热 反应结束后,向集气瓶中加入澄清石灰水,石灰水变浑浊,说明产物是二氧化碳 铜片上的白磷燃烧,热水中的白磷不能燃烧 无污染
23. 水雾 发烫 澄清石灰水变浑浊 水和二氧化碳
24. 分液漏斗 c 双氧水的浓度越大 C
25. 马铃薯提取液的多少(或过氧化氢酶的的含量) Ⅱ 同一种酶的最适pH值是一定的,不会由于浓度的不同而改变
(1)由题意可知,实验Ⅰ和实验Ⅱ的变量是马铃薯提取液的多少(或过氧化氢酶的的含量)。
(2)将加入四支试管中的马铃薯提取液的量减半时,过氧化氢酶的量也减半,催化效果减弱,因此曲线A是实验Ⅱ的结果。
(3)曲线A和B中,H2O2的含量的最低点位于横坐标同一位置的原因是同一种酶的最适pH值是一定的,不会由于浓度的不同而改变。
26. 19.2克 解:设参加反应的氯酸钾的质量为x
=
x=49g
混合物中氯酸钾的质量分数=×100%≈81.7%
答:混合物中氯酸钾的质量分数为81.7%。
27. 9.6g 24.5g 氯化钾和二氧化锰 14.9g、5g
(1)在加热条件和二氧化锰的催化作用下,氯酸钾分解生成氯化钾和氧气。催化剂在化学反应前后化学性质和质量不发生改变,因此,反应后试管中的固体是生成的氯化钾和催化剂二氧化锰的混合物共19.9g,反应前氯酸钾和二氧化锰的总质量为29.5g,减少9.6g就是生成的氧气的质量,故填:9.6g;
(2)设原混合物中氯酸钾的质量为x
x=24.5g
故填:24.5g;
(3)根据质量守恒定律知,参加反应的氯酸钾的质量等于生成氯化钾和氧气的质量,因此氯化钾的质量为:24.5g-9.6g=14.9g,二氧化锰的质量为:29.5g-24.5g=5g;故填:氯化钾和二氧化锰;14.9g、5g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
