2.2 物质的微观粒子模型 同步练习(含解析)
文档属性
| 名称 | 2.2 物质的微观粒子模型 同步练习(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 365.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-02-18 00:00:00 | ||
图片预览


文档简介
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
2.2 物质的微观粒子模型
一、单选题
1.“宏观—微观一符号”三重表征,是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如下所示,下列说法不正确的是( )
A. 从反应类型看:该反应属于置换反应 B. 从物质分类看:该反应涉及2种氧化物
C. 从微观构成看:四种物质均由分子构成 D. 从反应价值看:该反应能获取清洁能源和助燃剂
2.我国的一项科研成果:在一种新催化剂作用下可实现二氧化碳高效转化为甲醇,反应的微观示意图如图。下列说法正确的是( )
A. 图中单质的化学式为O2 B. 生成丙和丁的质量比为16:9
C. 反应前后,分子、原子的种类均不变 D. 该反应是置换反应
3.以下模型可以用来表示金属钠在氯气中燃烧形成氯化钠的是( )
A. B.
C. D.
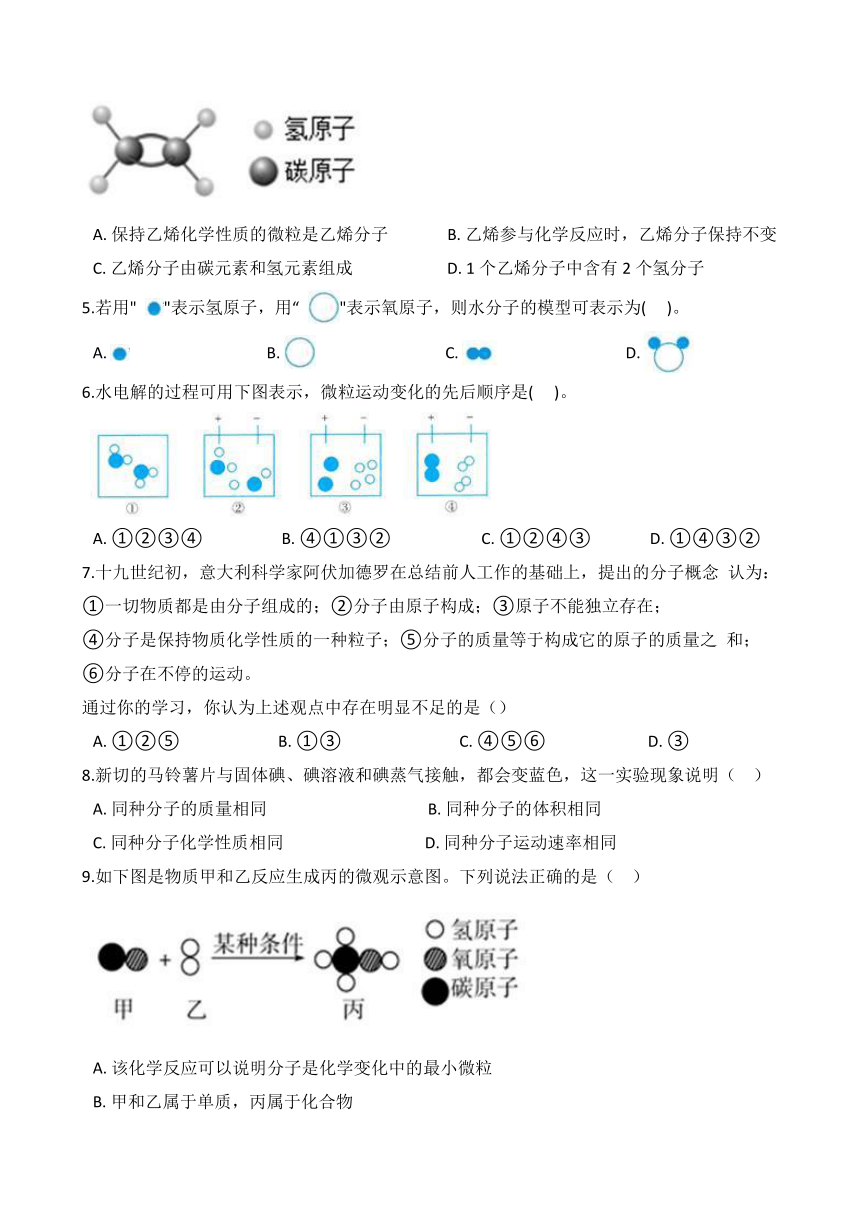
4.乙烯是脐橙等水果的环保催熟气体。乙烯的分子结构如图所示,则下列说法正确的是( )
A. 保持乙烯化学性质的微粒是乙烯分子 B. 乙烯参与化学反应时,乙烯分子保持不变
C. 乙烯分子由碳元素和氢元素组成 D. 1个乙烯分子中含有2个氢分子
5.若用" "表示氢原子,用“ "表示氧原子,则水分子的模型可表示为( )。
A. B. C. D.
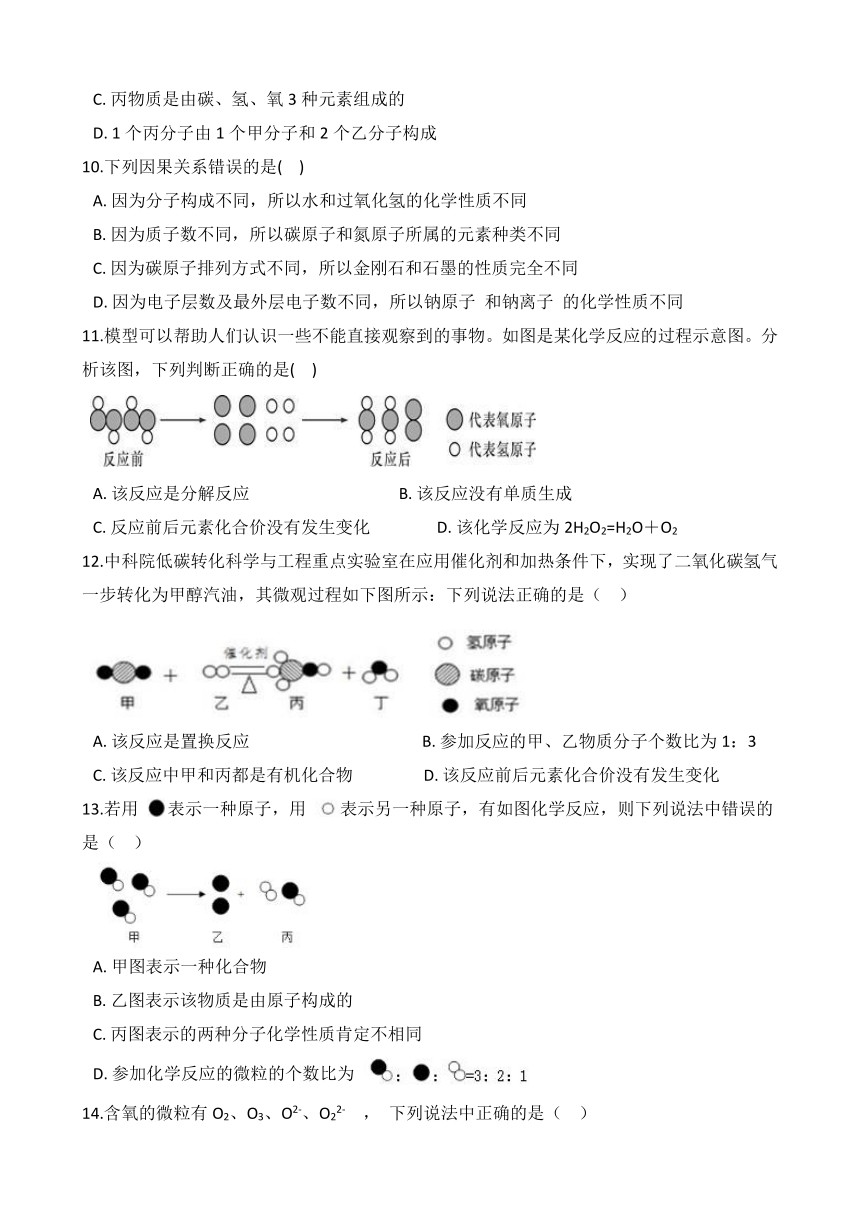
6.水电解的过程可用下图表示,微粒运动变化的先后顺序是( )。
A. ①②③④ B. ④①③② C. ①②④③ D. ①④③②
7.十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念 认为:
①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;
④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之 和;
⑥分子在不停的运动。
通过你的学习,你认为上述观点中存在明显不足的是()
A. ①②⑤ B. ①③ C. ④⑤⑥ D. ③
8.新切的马铃薯片与固体碘、碘溶液和碘蒸气接触,都会变蓝色,这一实验现象说明( )
A. 同种分子的质量相同 B. 同种分子的体积相同
C. 同种分子化学性质相同 D. 同种分子运动速率相同
9.如下图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
A. 该化学反应可以说明分子是化学变化中的最小微粒
B. 甲和乙属于单质,丙属于化合物
C. 丙物质是由碳、氢、氧3种元素组成的
D. 1个丙分子由1个甲分子和2个乙分子构成
10.下列因果关系错误的是( )
A. 因为分子构成不同,所以水和过氧化氢的化学性质不同
B. 因为质子数不同,所以碳原子和氮原子所属的元素种类不同
C. 因为碳原子排列方式不同,所以金刚石和石墨的性质完全不同
D. 因为电子层数及最外层电子数不同,所以钠原子 和钠离子 的化学性质不同
11.模型可以帮助人们认识一些不能直接观察到的事物。如图是某化学反应的过程示意图。分析该图,下列判断正确的是( )
A. 该反应是分解反应 B. 该反应没有单质生成
C. 反应前后元素化合价没有发生变化 D. 该化学反应为2H2O2=H2O+O2
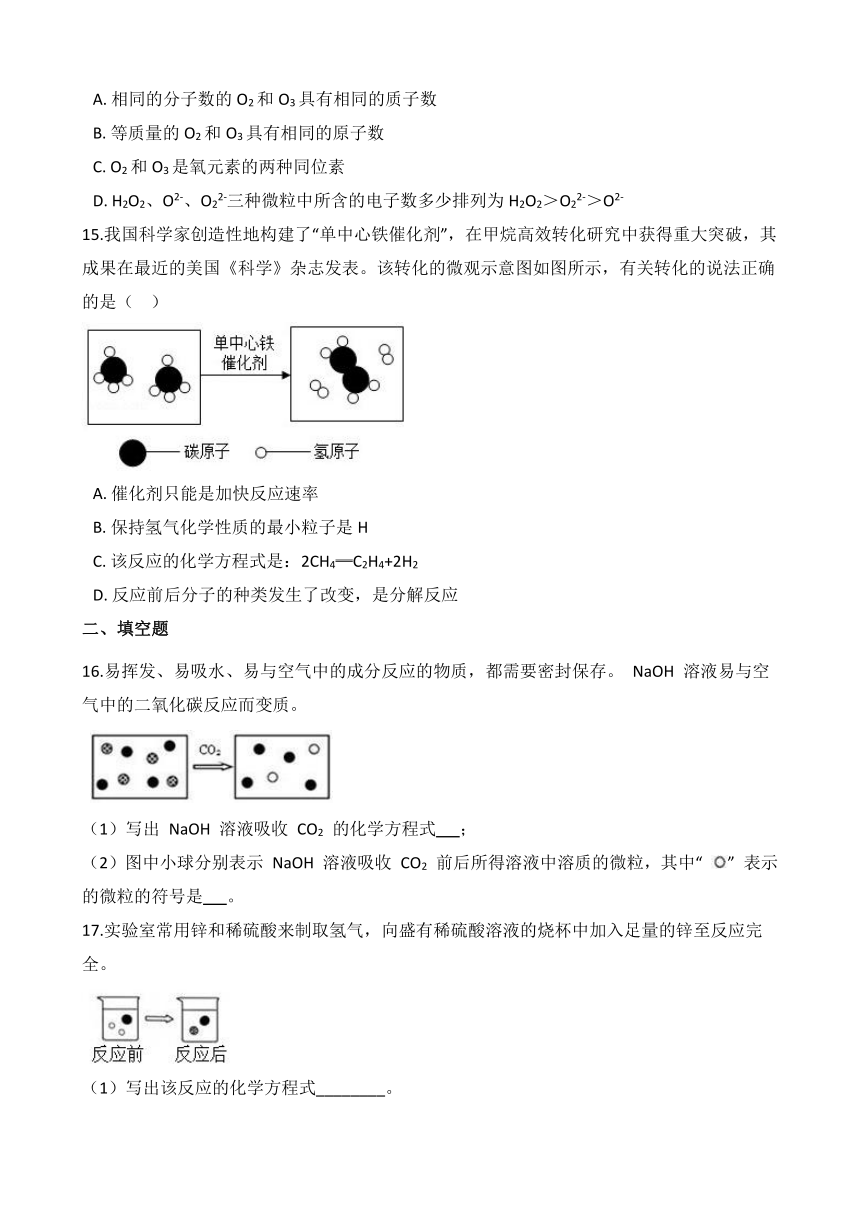
12.中科院低碳转化科学与工程重点实验室在应用催化剂和加热条件下,实现了二氧化碳氢气一步转化为甲醇汽油,其微观过程如下图所示:下列说法正确的是( )
A. 该反应是置换反应 B. 参加反应的甲、乙物质分子个数比为1:3
C. 该反应中甲和丙都是有机化合物 D. 该反应前后元素化合价没有发生变化
13.若用 表示一种原子,用 表示另一种原子,有如图化学反应,则下列说法中错误的是( )
A. 甲图表示一种化合物
B. 乙图表示该物质是由原子构成的
C. 丙图表示的两种分子化学性质肯定不相同
D. 参加化学反应的微粒的个数比为
14.含氧的微粒有O2、O3、O2-、O22- , 下列说法中正确的是( )
A. 相同的分子数的O2和O3具有相同的质子数
B. 等质量的O2和O3具有相同的原子数
C. O2和O3是氧元素的两种同位素
D. H2O2、O2-、O22-三种微粒中所含的电子数多少排列为H2O2>O22->O2-
15.我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破,其成果在最近的美国《科学》杂志发表。该转化的微观示意图如图所示,有关转化的说法正确的是( )
A. 催化剂只能是加快反应速率
B. 保持氢气化学性质的最小粒子是H
C. 该反应的化学方程式是:2CH4═C2H4+2H2
D. 反应前后分子的种类发生了改变,是分解反应
二、填空题
16.易挥发、易吸水、易与空气中的成分反应的物质,都需要密封保存。 NaOH 溶液易与空气中的二氧化碳反应而变质。
(1)写出 NaOH 溶液吸收 CO2 的化学方程式 ;
(2)图中小球分别表示 NaOH 溶液吸收 CO2 前后所得溶液中溶质的微粒,其中“ ” 表示的微粒的符号是 。
17.实验室常用锌和稀硫酸来制取氢气,向盛有稀硫酸溶液的烧杯中加入足量的锌至反应完全。
(1)写出该反应的化学方程式________。
(2)如图的 表示溶液中由溶质电离产生的不同离子,则“●”表示________(填写离子符号)
18.宏观与微观统一研究物质,是科学研究的基本方法。如图表示治理汽车尾气所涉及反应的微观过程,请根据该微观模型回答下列问题。
(1)该反应的化学方程式是 。
(2)该反应生成物中的“ ”,在物质分类上属于纯净物中的 。
19.有水(H2O)、双氧水(H2O2)、重水(D2O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有 种; 水与双氧水的化学性质 (选填“不相同”、“相同”);重水中氢元素的质量分数是 。
20.氢气是环保的清洁能源,但用电解水的方法制氢气成本很高。科学家研制出了一种氮化镓-锑合金,能促进水在太阳光下分解,从而获得氢气,且可重复使用。
(1)如图是水分解为氢气和氧气的过程中出现的微粒示意图,请按它们的化学变化过程中出现的顺序排列________。(用图中甲乙丙表示)
(2)氮化镓-锑合金在利用太阳光分解水的反应中起________作用。
21.形象的微观示意图有助于我们认识化学物质,理解化学反应。
(1)若用●表示氧原子,用〇表示氢原子。 表示 (填化学符号)。
(2)如图是某化学反应的微观示意图。请写出该反应的化学方程式 。
22.化学可以从微观角度认识世界,请用微粒的观点回答问题。
(1)氧气和液氧都是由 (填具体粒子的名称)构成的。
(2)氧气可压缩为液氧储存于钢瓶中,说明 。
(3)空气中的氧气无处不在,是 的结果。
(4)氧气与碳发生化学反应时,没有改变的两种粒子是 。
23.德国化学家洛哈德·埃特尔在固体表面化学的研究中取得了非凡的成就,其成果之一是揭示了氮气与氢气在催化剂表面合成氨的反应过程(下图所示)。
(1)其中表示氨分子的符号是________。
(2)通过该模型分析可知,在化学反应中,原子与分子主要区别是________ 。
(3)根据模型写出该反应的化学方程式 ________。
24. 3月22日是“批界水日”。水与人类的生活和生产密切相关。请回答以下问题:
(1)生理盐水中的溶剂是 , 溶质是 。
(2)保护水环境、珍爱水资源,是每个公民应尽的责任和义务。下列做法有利于保护水资源的是 (填序号)。
A. 大量使用化肥农药 B. 业废水处理达标后排放 C. 使用含磷洗衣粉 D. 生活污水直接排放
(3)在水蒸发的过程中,下列说法正确的是 (填序号)。
A. 水分子不断运动 B. 水分子之间间隔不变
C. 水分子分解成氢原子和氧原子 D. 水分子可以保持水的物理性质
(4)课外活动中,同学们玩起了以水为主题的“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,如图所示。仿照示例完成下列反应的化学方程式。
示例:①分解反应:电解水2H2O 2H2↑+O2↑
②置换反应
③化合反应
④复分解反应 。
25.盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是________。盐酸所属的物质类别是________ ;(填“有机物”或“无机物”)下列物质能与盐酸反应的是________:
A.铁锈 B.水垢 C.硝酸钾 D.苛性钠
在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是________。
②下图表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):
代表________;
代表________。
三、实验探究题
26.如图是水分子分解的示意图,其中“ ”表示氧原子,“●”表示氢原子。
根据图可以获得的化学信息有:
(1)在水电解的过程中,发生改变的微粒是________,不变的微粒是________,生成新物质的微粒是________;(请说出具体分子、原子的名称)
(2)分子和原子的本质区别是________;
27.
(1)“用微粒的眼光看世界”,是我们学习科学的重要思想方法。试根据以下材料,结合你所学知识,简要回答问题:
材料一:微波炉的工作原理是利用微波穿透食物达5cm深,使食物中的水分子产生高频率震动,并摩擦,产生大量的热量,达到运动式加热或烹饪食物的目的。
材料二:一滴水里大约有15万亿亿个水分子,如果10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要数3万多年才能数完。
材料三:某同学在课后做如图所示的实验:在一个玻璃容器中加入100mL水,向水中放入一块糖,立即在容器外壁沿液面画一水平线,过一会儿发现糖块溶解,液面比原来水平线降低了。
①材料一说明:________;
②材料二说明:________;
③材料三说明:________;
④分子是由原子构成的。
请谈谈你对“原子是化学变化的最小粒子”这句话的认识:________。
(2)在科学学习过程中,常常要用到分类的方法,利用分类的方法学习科学,可以起到事半功倍的效果。现有①人体呼出的气体;②五氧化二磷;③酒精;④液态氮;⑤四氧化二氮;⑥固体二氧化碳;⑦氩气;⑧澄清石灰水。用序号填空:含有氮分子的是________;由原子直接构成的物质是________。
28.碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:
①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色;
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。(提示:碘分子能使馒头中的淀粉变蓝色)则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头________变蓝色(选填“会”或“不会”)。
(2)把碘溶解在酒精中,可以得到用来消毒用的碘酒,用馒头去沾取少量的碘酒,馒头________(选填“会”或“不会”)变蓝色。
(3)请用分子的观点来解释实验中的现象________。
(4)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐中________(存在或不存在)碘分子。
29.利用分子的性质解释下列事实:
(1)把糖块放在水里,糖块逐渐消失,而水却有甜味: 。
(2)气体容易压缩,而液体、固态难以压缩: 。
(3)液氧和氧气状态不同,但具有相同的化学性质: 。
(4)蜡烛燃烧后生成二氧化碳和水: 。
四、解答题
30.机动车“双限”政策出台、全民参与“五水共治”一项项举措正在使杭州的天更蓝、水更清、路更畅。请回答下列问题:
(1)PM2.5吸入人体后,一部分会携带有害物质进入血液,对血管尤其是最内层的血管内膜层造成损伤,由此会产生血管内膜增厚、血管狭窄等症状,从而易诱发的疾病是
A.遗传病
B.冠心病
C.艾滋病
D.糖尿病
(2)利用科技手段处理汽车尾气能有效减少污染,如图是某种汽车尾气处理装置中发生化学反应的微观示意图,请据图写出图中所有含氮元素化合物的化学式________,同时书写装置中发生反应的化学方程式________(反应条件省略)。
31.化学是在分子、原子层面上认识和创造物质的一门科学。
(1)下列有关分子、原子、离子说法正确的是____________;
A. 分子是化学变化中最小的粒子 B. 蔗糖溶于水是由于蔗糖分子发生了改变
C. 分子的质量总比原子质量大 D. 分子、原子、离子都能直接构成物质
(2)过氧化氢溶液是一种常用的杀菌消毒剂,其原因是过氧化氢分子含有“过氧基”(﹣O﹣O﹣),据此推测,下列物质中如图3,可用作杀菌消毒剂的是 (填序号)。
(3)气体A和气体B接触可发生反应,其微观过程如图2
该反应过程中,属于氧化物的是 (填字母)。
32.在高温条件下,A,B两种物质可以发生化学反应生成C和D。反应前后分子种类变化的微观示意图如图所示。
(1)一个A分子中共含有________个原子;
(2)四种物质中,属于单质的是________(填图中的字母序号);
(3)关于该反应,以下叙述正确的是 。
A.分子的个数没有改变
B.原子种类没有改变
C.分子的个数发生改变
33.读图回答下列问题。
(1)比较氢分子(或氧分子)与水分子,可得出什么结论?________。
(2)比较过氧化氢和水分子、乙炔分子和甲烷分子,可得出什么结论?________。
34.“o”代表氢原子,“○”代表氧原子。由氢、氧两种原子构成的分子如下:
(1)比较A、B、D可知:________;
(2)比较C、E可知:________;
(3)比较B、D可知:________。
五、综合说理题
35.用细线把很干净的玻璃板吊在弹簧测力计的下面,记住测力计的读数。使玻璃板水平接触水面,然后稍稍用力向上拉玻璃板。弹簧测力计的读数有什么变化?解释产生这个现象的原因。
答案解析部分
一、单选题
1.答案: A
考点:构成物质的粒子模型
分析:根据图示中反应物和生成物的分子构成,结合置换反应、氧化物定义及物质的粒子构成分析。
解答:A、该反应中反应物无单质,不属于置换反应,符合题意;
B、 该反应涉及二氧化碳和水2种氧化物 ,不符合题意;
C、 四种物质均由分子构成 ,不符合题意;
D、 该反应生成物为甲烷和氧气,能获取清洁能源和助燃剂 ,不符合题意;
故选A。
2.答案: B
考点:构成物质的粒子模型,质量守恒定律及其应用,置换反应及其应用
分析:根据图示中各粒子的分子构成书写化学式,并按方程式书写原则书写出方程式,结合化学反应实质及置换反应定义分析。
解答:A、图中乙为单质,化学式为H2 , 不符合题意;
B、该反应方程形式为CO2+3H2=CH4O+H2O,则丙和丁的质量比为32:18=16:9,符合题意;
C、 反应前后,分子种类发生改变,原子的种类不变 ,不符合题意;
D、该反应中生成物都是化合物,不属于置换反应,不符合题意;
故选B。
3.答案: A
考点:构成物质的粒子模型
分析:原子得到电子带负电荷,失去电子带正电荷,据此分析判断。
解答:在NaCl中,Na的化合价为+1价,带一个单位的正电荷,即失去一个电子;Cl的化合价为-1价,带一个单位的负电荷,即得到一个电子,故A正确,而B、C、D错误。
故选A。
4.答案: A
考点:分子的定义与分子的特性
分析:(1)分子是保持物质化学性质的最小微粒;
(2)化学变化的本质:分子分解为原子,原子再重新组合成分子的过程;
(3)分子由原子构成;
(4)物质由分子构成,而分子由原子构成。
解答:A.保持乙烯化学性质的微粒是乙烯分子,故A正确;
B.乙烯参与化学反应时,乙烯分子分解为原子,再与其它原子组合成新的分子,故B错误;
C. 乙烯分子由碳原子和氢原子组成,故C错误;
D. 1个乙烯分子中含有4个氢原子,故D错误。
故选A。
5.答案: D
考点:构成物质的粒子模型
分析:根据一个水分子是由2个氢原子和1个氧原子构成分析。
解答:一个水分子是由2个氢原子和1个氧原子构成,所以水分子的模型为;
故选D。
6.答案: A
考点:构成物质的粒子模型
分析:根据电解水时先水分子分解,然后氢、氧原子再重新组合分析。
解答:电解水时先水分子分解生成氢原子和氧原子,然后氢、氧原子再重新组合,生成氢分子和氧分子,所以变化的顺序为①②③④;
故选A。
7.答案: B
考点:分子和原子的区别和联系
分析:根据对分子和原子的认识分析判断。
解答:①分子、原子和离子,都是构成物质的基本微粒,因此物质不一定是由分子构成的,故①错误;
②分子由原子构成,故②正确;、
③原子可以独立存在,例如金属就是由原子直接构成的物质,故③错误;
④分子是保持物质化学性质的一种粒子,故④正确;
⑤分子的质量等于构成它的原子的质量之和,故⑤正确;
⑥分子在不停的运动,故⑥正确。
那么存在明显不足的是①③。
故选B。
8.答案: C
考点:分子的定义与分子的特性
分析: 无论是固体碘还是碘蒸气其构成都是由碘分子构成的,碘具有能使淀粉变蓝的性质,据此分析判断。
解答:固态碘和碘蒸气中含有相同的碘分子,都能使淀粉溶液变蓝,说明相同的物质具有相同的分子,其化学性质也相同,与分子的质量、 体积、运动速度无关。
故C正确,而A、B、D错误。
故选C。
9.答案: C
考点:分子和原子的区别和联系,化学式的书写及意义,常见物质的分类
分析:(1)根据示意图分析分子和原子是否改变即可;
(2)只由一种元素组成的纯净物叫单质,由多种元素组成的纯净物叫化合物;
(3)根据丙的化学式分析它的元素组成;
(4)分子由原子构成。
解答:A.在实验中,反应后和反应前分子的种类改变,而原子的种类不变,因此原子是化学变化中的最小微粒,故A错误;
B.甲由两种元素组成,为化合物,而乙只由一种元素组成,为单质,丙由三种元素组成也是化合物,故B错误;
C.根据图片可知,丙由碳、氢和氧三种元素组成,故C正确;
D.一个丙分子由1个氧原子、1个碳原子和4个氢原子构成,故D错误。
故选C。
10.答案: C
考点:分子的定义与分子的特性,元素的概念
分析:(1)同种分子化学性质相同,不同分子化学性质不同;
(2)决定元素种类的是核内质子数;
(3) 分子的排列方式不会影响化学性质,只会影响物理性质;
(4)决定元素化学性质的是最外层电子数。
解答: A.同种分子化学性质相同,不同分子化学性质不同,因为分子构成不同,所以水和过氧化氢的化学性质不同,故A正确不合题意;
B.决定元素种类的是核内质子数,碳原子和氮原子的质子数不同,所以所属的元素种类不同,故B正确不合题意;
C.因为碳原子排列方式不同,所以金刚石和石墨的化学性质相同,而物理性质不同,故C错误符合题意;
D.决定元素化学性质的是最外层电子数,钠原子和钠离子的最外层电子数不同,所以钠原子和钠离子的化学性质不同,故D正确不合题意。
故选C。
11.答案: A
考点:构成物质的粒子模型,分子、原子、离子、元素与物质之间的关系,单质和化合物,化合反应和分解反应
分析:(1)一种物质生成两种或多种物质的反应,叫分解反应;
(2)只由一种元素组成的纯净物叫单质;
(3)计算出反应前后元素的化合价,然后进行比较即可;
(4)根据示意图确定反应物和生成物,据此写出反应的方程式。
解答:A.反应物只有一种, 生成物为和, 该反应为分解反应,故A正确;
B.反应物只由一种元素组成,为单质,故B错误;
C.反应前,氧元素的化合价为-2价;反应后,氧元素的化合价为0价,故C错误;
D.该反应的化学方程式为: 2H2O2=2H2O+O2 ,故D错误。
故选A。
12.答案: B
考点:构成物质的粒子模型,书写化学方程式、文字表达式
分析:有关微观模拟图的题目在解答时,先根据反应前后各微粒的构成确定反应物和生成物,写出反应方程式,然后按方程式进行解答,书写方程式时要注意配平。
解答:该反应方程式为CO2+3H2=CH4O+H2O;
A、该反应生成物中无单质,不是置换反应,不符合题意;
B、参加反应的甲、乙物质分子个数比为1:3 ,符合题意;
C、甲为二氧化碳,不是有机物,不符合题意;
D、该反应前后氢元素化合价发生变化 ,不符合题意;
故选B。
13.答案: D
考点:分子的定义与分子的特性,常见物质的分类
分析:(1)由两种或多种元素组成的纯净物叫化合物;
(2)根据乙图分析物质的构成情况;
(3)分析两种分子的构成是否相同;
(4)根据图片确定参加反应的粒子个数。
解答:A.根据甲图可知,该物质由两种元素组成,为化合物,故A正确不合题意;
B.根据乙图可知,两个原子各自独立,互不相干,因此该物质由原子构成,故B正确不合题意;
C.根据丙图可知,两种分子的构成明显不同,因此它们的化学性质不同,故C正确不合题意;
D.比较反应前后,反应前后都有一个, 将其去掉,那么参加化学反应的微粒的个数比为 =2:2:1,故D错误符合题意。
故选D。
14.答案: B
考点:分子和原子的区别和联系,同位素
分析:(1)根据O2和O3化学式的含义进行分析;
(2)一个氧分子由2个氧原子构成,一个臭氧分子由3个氧原子构成,故3个氧分子和2个臭氧分子的质量相等;
(3)具有相同质子数和不同中子数的原子成为同位素;
(4)根据各种微粒中含有的电子数分析判断.
解答:A.设分子数为n,那么O2和O3的氧原子个数之比为:2n:3n=2:3;一个氧原子含有8个质子,那么它们质子数的比值为:(8×2):(8×3)=2:3,故A错误;
B.一个氧分子由2个氧原子构成,一个臭氧分子由3个氧原子构成,故3个氧分子和2个臭氧分子的质量相等,而3个氧气分子和2个臭氧分子都含6个氧原子,故所含原子数目相同,故B正确;
C.O2和O3中氧原子的质子数和中子数相等,不是同位素,故C错误;
D.H2O2、O2-、O22- 三种微粒中所含的电子数分别为18、10、18,所以三种微粒中所含的电子数多少排列为H2O2=O22->O2- , 故D错误。
故选B。
15.答案: D
考点:分子和原子的区别和联系,催化剂在化学反应中的作用,化合反应和分解反应,书写化学方程式、文字表达式
分析:(1)根据催化剂的作用分析;
(2)分子是保持物质化学性质的最小微粒;
(3)根据微观示意图确定反应物和生成物,进而写出方程式;
(4)一种物质生成多种物质的反应叫分解反应、
解答:A.催化剂可能加快反应速率,也可能减慢反应速率,故A错误;
B.保持氢气化学性质的最小粒子是H2 , 故B错误;
C.该反应的化学方程式是: 2CH4C2H4+2H2 ,故C错误;
D.反应前后分子的种类发生了改变,由于反应物有一种,而生成物有两种,因此为分解反应,故D正确。
故选D。
二、填空题
16.答案: (1)2NaOH +CO2=Na2CO3+H2O
(2)
考点:构成物质的粒子模型,书写化学方程式、文字表达式
分析:(1)根据氢氧化钠与二氧化碳反应生成碳酸钠和水分析;
(2)根据反应前后溶液中溶质成分及离子种类分析。
解答:(1)氢氧化钠与二氧化碳反应生成碳酸钠和水,反应方程式为2NaOH +CO2=Na2CO3+H2O ;
(2)该反应反应后溶液溶质为碳酸钠,反应前为氢氧化钠,反应前后相同的粒子为钠离子,所以“”表示的微粒 。
故答案为:(1)2NaOH +CO2=Na2CO3+H2O ;(2)。
17.答案: (1)Zn+H2SO4=ZnSO4 +H2↑
(2)SO42-
考点:构成物质的粒子模型,酸的化学性质
分析:(1)根据锌与硫酸反应生成硫酸锌和氢气分析;
(2)根据反应前后烧杯中离子种类分析。
解答:(1)锌与硫酸反应生成硫酸锌和氢气,反应方程式为Zn+H2SO4=ZnSO4 +H2↑ ;
(2)反应前烧杯中为氢离子和硫酸根离子,反应后为锌离子和硫酸根离子,则“●”表示SO42- ;
故答案为:(1)Zn+H2SO4=ZnSO4 +H2↑ ;(2) SO42- 。
18.答案: (1)2NO+2CO = N2+2CO2
(2)单质
考点:构成物质的粒子模型,单质和化合物
分析:(1)由微观图示中各分子构成结合方程式书写原则分析;
(2)根据由同种元素组成的纯净物为单质分析。
解答:(1)由微观图示可知,该反应的方程式为 2NO+2CON2+2CO2 ;
(2) 该反应生成物中的“”由一种元素组成,属于单质;
故答案为:(1) 2NO+2CON2+2CO2 ;(2)单质。
19.答案: 2种;不相同;20%
考点:分子的定义与分子的特性,有关化学式的计算和推断
分析:(1)在化学式中,一种符号代表一种元素;
(2)分子是保持物质化学式性质的最小微粒,分子不同,则化学性质不同;
(3)元素的质量分数=。
解答:(1)根据化学式 H2O 、 H2O2 和 D2O 可知,这三种物质所含的元素只由2种,即氢元素和氧元素;
(2)水与双氧水的分子不同,则它们的化学性质不同;
(3)重水中氢元素的质量分数是:。
20.答案: (1)丙→甲 →乙
(2)催化
考点:构成物质的粒子模型,催化剂在化学反应中的作用
分析:(1)根据化学反应实质分析;
(2)根据氮化镓-锑合金为催化剂分析。
解答:(1)电解水时水分子先分成氢原子氧原子,然后氢氧原子再重新结合成氢分子和氧分子,所以反应过程为 丙→甲 →乙 ;
(2) 氮化镓-锑合金在利用太阳光分解水的反应中起催化作用;
故答案为:(1) 丙→甲 →乙 ;(2)催化。
21.答案: (1)H2O
(2)6NO+4NH3=5N2+6H2O
考点:构成物质的粒子模型
分析:(1)根据水分子的构成分析;
(2)根据微观图示中反应物和生成物的分子构成书写方程式分析。
解答:(1) 用●表示氧原子,用〇表示氢原子,则表示水分子,化学式为H2O ;
(2)由反应图示可知,该反应的方程式为6NO+4NH35N2+6H2O。
故答案为:(1) H2O ;(2)6NO+4NH35N2+6H2O。
22.答案: (1)氧分子
(2)受压时氧气分子间的间隔变小(或分子间有空隙)
(3)分子运动
(4)氧原子和碳原子
考点:分子之间存在空隙,分子的定义与分子的特性,分子、原子、离子、元素与物质之间的关系
分析:(1)物质由分子、原子或离子构成;
(2)物质在固、液、气三态之间相互转化时,分子的种类不变,改变的就是分子之间的空隙;
(3)根据分子运动论的知识解答;
(4)在化学变化中,分子分解为原子,原子再重新组合成分子,据此分析解答。
解答:(1)氧气和液氧都是由氧分子构成的。
(2)氧气可压缩为液氧储存于钢瓶中,说明受压时氧气分子间的间隔变小(或分子间有空隙);
(3)空气中的氧气无处不在,是分子运动的结果。
(4)氧气与碳发生化学反应时,没有改变的两种粒子是氧原子和碳原子。
23.答案: (1)C
(2)原子在化学反应中不能再分,分子可以再分
(3)3H2+N2 2NH3
考点:分子和原子的区别和联系,书写化学方程式、文字表达式
分析:(1)根据反应的示意图判断即可;
(2)分析反应前后原子和分子的种类是否发生改变即可;
(3)根据示意图确定反应物和生成物,以及反应条件,最后写出反应的化学方程式。
解答:(1)因为为氮原子,所以为氮气分子;因为为氢原子,所以为氢气分子;因为生成物为氨气,所以为氨气分子,故选C。
(2)将反应物和生成物比较可知,原子的种类和个数保持不变,而分子的种类和个数都发生了变化,因此原子和分子的主要区别是:原子在化学反应中不能再分,分子可以再分。
(3)氢气和氮气在高温、高压和催化剂的作用下,生成氨气,反应的方程式为:。
24.答案: (1)水;氯化钠
(2)B
(3)A
(4)H2+CuO Cu+H2O;CaO+H2O=Ca(OH)2;Ca(OH)2 + 2HCl = CaCl2+2H2O
考点:水资源的保护,溶液的组成及特点,分子的定义与分子的特性,书写化学方程式、文字表达式
分析:(1)根据固体与水形成溶液,固体是溶质,水是溶剂分析;
(2)根据水体污染的原因分析;
(3)根据水蒸发是分子间隔发生改变分析;
(4)根据反应方程式的书写及反应类型的特点分析。
解答:(1) 生理盐水中的溶剂是水,溶质是氯化钠;
(2) 大量使用化肥农药会造成水体污染,A错误;工业废水处理达标后排放可防止水污染,B正确;使用含磷洗衣粉会使水富营养化,造成污染,C错误;生活污水直接排放会污染水体,D错误;
(3) 在水蒸发的过程中水分子运动加速,分子间间隔变大,而水分子本身不发生变化,水分子只能保持水的化学性质,故A正确;
(4)根据游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环。反应①中生成的H2可以作还原剂,则②置换反应可以是氢气与金属氧化物的反应生成金属和水,如氢气与氧化铜反应生成铜和水,然后利用水与氧化钙反应生成氢氧化钙书写③化合反应的化学方程式,最后利用氢氧化钙与盐酸发生复分解反应写出④复分解反应的化学方程式。
故答案为:(1)水;氯化钠;(2)B;(3)A;(4)
H2+CuO Cu+H2O;CaO+H2O=Ca(OH)2;Ca(OH)2 + 2HCl = CaCl2+2H2O。
25.答案: 分子间空隙;无机物;ABD;固体溶解,溶液由无色变为浅绿色,有气泡产生;Cl-;Fe2+
考点:构成物质的粒子模型,有机物与无机物的区别,酸的化学性质
分析:根据状态改变是分子间隔改变、盐酸属于无机物、酸的化学性质、铁与盐酸反应时氯离子反应前后未改变及盐酸和氯化亚铁溶液中粒子构成分析。
解答: HCl由气态变为液态, 是分子间隔发生改变;盐酸属于无机物,铁锈成分为氧化铁,能与盐酸反应,A正确;水垢成分为碳酸钙,能与盐酸反应,B正确;硝酸钾不能与盐酸反应,C错误;苛性钠为氢氧化钠,能与盐酸反应,D正确; 在盐酸中加入过量的铁粉,可观察到有气泡产生,溶液变成浅绿色;铁与盐酸反应,氯离子不变,由反应前后粒子种类可知,为氯离子,为氢离子,为亚铁离子;
故答案为:分子间空隙;无机物;ABD;固体溶解,溶液由无色变为浅绿色,有气泡产生;Cl-;Fe2+ 。
三、实验探究题
26.答案: (1)水分子;氢原子、氧原子;氢分子、氧分子
(2)在化学变化中,分子可分,原子不可分
考点:分子和原子的区别和联系
分析:(1)在化学变化中,分子分解为原子,原子再重新组合成分子,因此变化的是分子,而保持不变的是原子,据此分析解答;
(2)从分子和原子在化学变化中是否可以再分的角度分析二者的区别。
解答:(1)在水电解的过程中,发生改变的微粒是水分子, 不变的微粒是氢原子、氧原子, 生成新物质的微粒是氢分子、氧分子;
(2)分子和原子的本质区别是:在化学变化中,分子可分,原子不可分。
27.答案: (1)分子是不断运动的;分子的体积和质量都很小;分子之间存在空隙;化学变化中分子可以再分,而原子不可再分
(2)①④;⑦
考点:分子的热运动,分子之间存在空隙,分子的定义与分子的特性
分析:(1)①根据“使食物中的水分子产生高频率震动,并摩擦,产生大量的热量”分析;
②一滴水的体积和质量本就很小,而组成一滴水的分子个数却很多很多,那么平均下来,一个分子的体积和质量就会很小很小;
③水面下降,说明水和块糖的总体积减小了,只能是因为糖分子跑到水分子的空隙里面去了,即分子有空隙;
④可从化学变化中分子和原子是否能够再分解答。
(2)氮气由氮分子构成;由原子直接构成的物质有:金属单质和少数的非金属单质,稀有气体、
解答:(1)①材料一说明:、分子是不断运动的;
②材料二说明:分子的体积和质量都很小;
③材料三说明:分子之间存在空隙;
④分子是由原子构成的。
我对“原子是化学变化的最小粒子”这句话的认识:化学变化中分子可以再分,而原子不可再分。
(2)含有氮分子的只能是氮气,人体呼出的气体中含有氮气,液态氮是氮气的液态形式,故选①④;
由原子直接构成的物质:氩气,故选⑦。
28.答案: (1)会
(2)会
(3)分子是保持化学性质的最小微粒,碘的升华和溶解都是物理变化,碘分子不变 ,所以化学性质不变
(4)不存在
考点:分子的热运动,分子的定义与分子的特性
分析:(1)碘蒸气也是由碘分子构成;(2)发生物理变化时,分子本身不变,变化的是分子之间的间隔;(3)化合物中存在的碘元素。
解答:(1)碘升华变成碘蒸气都是由碘分子构成,都能使淀粉变蓝色,所以馒头会变蓝;
(2)发生物理变化时,实质是构成碘的分子之间的间隔发生了变化,碘分子并没有发生变化,所以馒头也会变蓝色;
(3)解释: 分子是保持化学性质的最小微粒,碘的升华和溶解都是物理变化,碘分子不变 ,所以化学性质不变;
(4)根据碘遇淀粉变蓝色的原理,加碘盐不能使馒头变蓝色,说明不含碘分子。
故答案为:(1)会;(2)会;(3)
分子是保持化学性质的最小微粒,碘的升华和溶解都是物理变化,碘分子不变 ,所以化学性质不变 ;(4)不存在。
29.答案: (1)糖块溶解在水中后,糖分子不断地运动,扩散到水分子中去了
(2)气体分子间间隔大,液体、固体分子间间隔较小
(3)同种物质的分子化学性质相同
(4)分子在化学变化中分成原子,原子又重新组合成新的分子
考点:分子的热运动,分子间的作用力,分子之间存在空隙,分子和原子的区别和联系
解答:回答本题首先要熟悉分子的性质:分子质量和体积都很小;分子间有间隔;分子在不断地运动;同种物质的分子化学性质相同,不同种物质的分子化学性质不同;分子在化学变化中可分为原子,原子又重新组合成新的分子。
分析:该题考查了分子的性质。
四、解答题
30.答案: (1)B
(2)NO、NH3;4NH3 + 6NO=5N2 + 6H2O
考点:非传染性疾病,构成物质的粒子模型,书写化学方程式、文字表达式
分析:(1)PM2.5吸入人体后,通过血液循环对人体造成伤害 。
(2)化学反应中,化合价升高的元素在反应中被氧化,化合价降低的元素在反应中被还原。
解答:(1)冠心病是由于身体内的某条血管管壁硬化、管腔变窄,导致心肌细胞缺血而引起的病变, PM2.5吸入人体导致冠状动脉病变,因此容易诱发冠心病,B符合题意。
(2)图中所有含氮元素化合物的化学式为: NO、NH3, 氨气与一氧化氮反应的方程式为:4NH3 + 6NO=5N2 + 6H2O。
故答案为:(1)B(2)NO、NH3; 4NH3 + 6NO=5N2 + 6H2O ;
31.答案: (1)D
(2)④
(3)BD
考点:构成物质的粒子模型,分子、原子、离子、元素与物质之间的关系,单质和化合物
分析:(1)从构成物质的微观粒子切入解答。
(2)含有“过氧基”(-O-O-)有杀菌消毒作用。
(3)由两种元素组成,且其中一种元素是O.属于氧化物。
解答:(1)A、化学变化的实质是分子分裂成原子,原子又重新组合成新分子,故化学变化中的最小粒子是原子,A不符合题意;
B、蔗糖放入水中一段时间后,蔗糖不见了,是因为蔗糖分子不断运动,进入到水分子的间隔中,所以蔗糖不见了,但蔗糖分子没有发生变化,B不符合题意;
C、有些大原子的质量要比小分子的质量大, 一个铁原子的质量是9.288×10-26kg,一个氢分子的质量为3.3×10-27kg,因此一个铁原子就比一个氢分子质量大,C不符合题意;
D、分子、原子、离子都可以直接构成物质,离子构成的物质有:大多数盐、碱和活泼金属氧化物。如氯化钠由钠离子和氯离子构成,氢氧化钾由钾离子和氢氧根离子构成,D符合题意。
(2)根据含有“过氧基”(-O-O-)有杀菌消毒,观察选项可知④中含有过氧基,所以可用作杀菌消毒剂。
(3)①氧化物是由两种元素组成其中一种是氧元素,所以可知B为SO2、D为H2O,都属于氧化物。
故答案为:(1)D(2)④(3)BD
32.答案: (1)5
(2)D
(3)B,C
考点:化学变化与物理变化的判别,构成物质的粒子模型,单质和化合物
分析:由模型推出化学反应方程式:CH4+H2O=CO+3H2
解答:(1)由分子模型可以看出,一个A分子由1个碳原子和4个氢原子构成,共5个原子;
(2)由同种元素构成的纯净物叫单质,只有D满足单质的条件;
(3)化学反应的实质是分子的种类改变,分子的个数可能改变;原子的种类和个数都不变,故BC正确。
由CH4+H2O=CO+3H2 , 分子个数改变,原子种类不变。
故答案为:(1)5;(2)D;(3)BC
33.答案: (1)构成分子的原子可以是同种原子,也可以是不同种原子。
(2)同种原子、不同的个数可以构成不同的分子。
考点:分子和原子的区别和联系
分析:(1)根据分子的结构来分析;
(2)根据不同分子的结构来分析。
解答:(1)氢分子只由氢原子构成,水分子由氢原子和氧原子构成,可以得到结论:构成分子的原子可以是同种原子,也可以是不同种原子;
(2)过氧化氢分子由2个氧原子和2个氢原子构成,而水分子由1个氢原子和2个氢原子构成,发现它们原子种类相同,但原子个数不同,得到结论:同种原子、不同的个数可以构成不同的分子。
34.答案: (1)分子可以由同种原子构成
(2)分子可以由不同种原子构成
(3)数量不相同的原子可以构成不同的分子
考点:分子的定义与分子的特性
分析:根据图示中各分子的构成情况分析。
解答: (1)、A、B、D都是同种原子构成的分子,所以由此可知分子可以由同种原子构成;
(2)C和E中分子都是由不同种原子构成,所以由此可知分子可以由不同种原子构成;
(3)B和D是同种原子构成的不同种分子,由此可知 数量不相同的原子可以构成不同的分子 。
五、综合说理题
35.答案: 弹簧测力计的读数会变大,因为玻璃和水两种物质的分子间存在着引力。
考点:分子的热运动,分子间的作用力,分子之间存在空隙,分子的定义与分子的特性
解答:由于玻璃和水两种物质的分子间存在着引力,因此弹簧测力计的读数会变大。
分析:该题考查分子动理论的基本观点,分子间存在着引力,所以弹簧测力计的示数会变大。
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
2.2 物质的微观粒子模型
一、单选题
1.“宏观—微观一符号”三重表征,是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如下所示,下列说法不正确的是( )
A. 从反应类型看:该反应属于置换反应 B. 从物质分类看:该反应涉及2种氧化物
C. 从微观构成看:四种物质均由分子构成 D. 从反应价值看:该反应能获取清洁能源和助燃剂
2.我国的一项科研成果:在一种新催化剂作用下可实现二氧化碳高效转化为甲醇,反应的微观示意图如图。下列说法正确的是( )
A. 图中单质的化学式为O2 B. 生成丙和丁的质量比为16:9
C. 反应前后,分子、原子的种类均不变 D. 该反应是置换反应
3.以下模型可以用来表示金属钠在氯气中燃烧形成氯化钠的是( )
A. B.
C. D.
4.乙烯是脐橙等水果的环保催熟气体。乙烯的分子结构如图所示,则下列说法正确的是( )
A. 保持乙烯化学性质的微粒是乙烯分子 B. 乙烯参与化学反应时,乙烯分子保持不变
C. 乙烯分子由碳元素和氢元素组成 D. 1个乙烯分子中含有2个氢分子
5.若用" "表示氢原子,用“ "表示氧原子,则水分子的模型可表示为( )。
A. B. C. D.
6.水电解的过程可用下图表示,微粒运动变化的先后顺序是( )。
A. ①②③④ B. ④①③② C. ①②④③ D. ①④③②
7.十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念 认为:
①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;
④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之 和;
⑥分子在不停的运动。
通过你的学习,你认为上述观点中存在明显不足的是()
A. ①②⑤ B. ①③ C. ④⑤⑥ D. ③
8.新切的马铃薯片与固体碘、碘溶液和碘蒸气接触,都会变蓝色,这一实验现象说明( )
A. 同种分子的质量相同 B. 同种分子的体积相同
C. 同种分子化学性质相同 D. 同种分子运动速率相同
9.如下图是物质甲和乙反应生成丙的微观示意图。下列说法正确的是( )
A. 该化学反应可以说明分子是化学变化中的最小微粒
B. 甲和乙属于单质,丙属于化合物
C. 丙物质是由碳、氢、氧3种元素组成的
D. 1个丙分子由1个甲分子和2个乙分子构成
10.下列因果关系错误的是( )
A. 因为分子构成不同,所以水和过氧化氢的化学性质不同
B. 因为质子数不同,所以碳原子和氮原子所属的元素种类不同
C. 因为碳原子排列方式不同,所以金刚石和石墨的性质完全不同
D. 因为电子层数及最外层电子数不同,所以钠原子 和钠离子 的化学性质不同
11.模型可以帮助人们认识一些不能直接观察到的事物。如图是某化学反应的过程示意图。分析该图,下列判断正确的是( )
A. 该反应是分解反应 B. 该反应没有单质生成
C. 反应前后元素化合价没有发生变化 D. 该化学反应为2H2O2=H2O+O2
12.中科院低碳转化科学与工程重点实验室在应用催化剂和加热条件下,实现了二氧化碳氢气一步转化为甲醇汽油,其微观过程如下图所示:下列说法正确的是( )
A. 该反应是置换反应 B. 参加反应的甲、乙物质分子个数比为1:3
C. 该反应中甲和丙都是有机化合物 D. 该反应前后元素化合价没有发生变化
13.若用 表示一种原子,用 表示另一种原子,有如图化学反应,则下列说法中错误的是( )
A. 甲图表示一种化合物
B. 乙图表示该物质是由原子构成的
C. 丙图表示的两种分子化学性质肯定不相同
D. 参加化学反应的微粒的个数比为
14.含氧的微粒有O2、O3、O2-、O22- , 下列说法中正确的是( )
A. 相同的分子数的O2和O3具有相同的质子数
B. 等质量的O2和O3具有相同的原子数
C. O2和O3是氧元素的两种同位素
D. H2O2、O2-、O22-三种微粒中所含的电子数多少排列为H2O2>O22->O2-
15.我国科学家创造性地构建了“单中心铁催化剂”,在甲烷高效转化研究中获得重大突破,其成果在最近的美国《科学》杂志发表。该转化的微观示意图如图所示,有关转化的说法正确的是( )
A. 催化剂只能是加快反应速率
B. 保持氢气化学性质的最小粒子是H
C. 该反应的化学方程式是:2CH4═C2H4+2H2
D. 反应前后分子的种类发生了改变,是分解反应
二、填空题
16.易挥发、易吸水、易与空气中的成分反应的物质,都需要密封保存。 NaOH 溶液易与空气中的二氧化碳反应而变质。
(1)写出 NaOH 溶液吸收 CO2 的化学方程式 ;
(2)图中小球分别表示 NaOH 溶液吸收 CO2 前后所得溶液中溶质的微粒,其中“ ” 表示的微粒的符号是 。
17.实验室常用锌和稀硫酸来制取氢气,向盛有稀硫酸溶液的烧杯中加入足量的锌至反应完全。
(1)写出该反应的化学方程式________。
(2)如图的 表示溶液中由溶质电离产生的不同离子,则“●”表示________(填写离子符号)
18.宏观与微观统一研究物质,是科学研究的基本方法。如图表示治理汽车尾气所涉及反应的微观过程,请根据该微观模型回答下列问题。
(1)该反应的化学方程式是 。
(2)该反应生成物中的“ ”,在物质分类上属于纯净物中的 。
19.有水(H2O)、双氧水(H2O2)、重水(D2O)(“D”表示原子核中有一个质子和一个中子的氢原子)三种物质,从物质组成的角度看,这三种物质所含的元素共有 种; 水与双氧水的化学性质 (选填“不相同”、“相同”);重水中氢元素的质量分数是 。
20.氢气是环保的清洁能源,但用电解水的方法制氢气成本很高。科学家研制出了一种氮化镓-锑合金,能促进水在太阳光下分解,从而获得氢气,且可重复使用。
(1)如图是水分解为氢气和氧气的过程中出现的微粒示意图,请按它们的化学变化过程中出现的顺序排列________。(用图中甲乙丙表示)
(2)氮化镓-锑合金在利用太阳光分解水的反应中起________作用。
21.形象的微观示意图有助于我们认识化学物质,理解化学反应。
(1)若用●表示氧原子,用〇表示氢原子。 表示 (填化学符号)。
(2)如图是某化学反应的微观示意图。请写出该反应的化学方程式 。
22.化学可以从微观角度认识世界,请用微粒的观点回答问题。
(1)氧气和液氧都是由 (填具体粒子的名称)构成的。
(2)氧气可压缩为液氧储存于钢瓶中,说明 。
(3)空气中的氧气无处不在,是 的结果。
(4)氧气与碳发生化学反应时,没有改变的两种粒子是 。
23.德国化学家洛哈德·埃特尔在固体表面化学的研究中取得了非凡的成就,其成果之一是揭示了氮气与氢气在催化剂表面合成氨的反应过程(下图所示)。
(1)其中表示氨分子的符号是________。
(2)通过该模型分析可知,在化学反应中,原子与分子主要区别是________ 。
(3)根据模型写出该反应的化学方程式 ________。
24. 3月22日是“批界水日”。水与人类的生活和生产密切相关。请回答以下问题:
(1)生理盐水中的溶剂是 , 溶质是 。
(2)保护水环境、珍爱水资源,是每个公民应尽的责任和义务。下列做法有利于保护水资源的是 (填序号)。
A. 大量使用化肥农药 B. 业废水处理达标后排放 C. 使用含磷洗衣粉 D. 生活污水直接排放
(3)在水蒸发的过程中,下列说法正确的是 (填序号)。
A. 水分子不断运动 B. 水分子之间间隔不变
C. 水分子分解成氢原子和氧原子 D. 水分子可以保持水的物理性质
(4)课外活动中,同学们玩起了以水为主题的“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,如图所示。仿照示例完成下列反应的化学方程式。
示例:①分解反应:电解水2H2O 2H2↑+O2↑
②置换反应
③化合反应
④复分解反应 。
25.盐酸是一种重要的化工产品,也是实验室中重要的化学试剂。
增大压强,HCl由气态变为液态,从微观的角度分析该变化过程中改变的是________。盐酸所属的物质类别是________ ;(填“有机物”或“无机物”)下列物质能与盐酸反应的是________:
A.铁锈 B.水垢 C.硝酸钾 D.苛性钠
在盐酸中加入过量的铁粉充分反应。
①可以看到的现象是________。
②下图表示该反应前后溶液中存在的主要离子,请写出下列图形代表的离子(填离子符号):
代表________;
代表________。
三、实验探究题
26.如图是水分子分解的示意图,其中“ ”表示氧原子,“●”表示氢原子。
根据图可以获得的化学信息有:
(1)在水电解的过程中,发生改变的微粒是________,不变的微粒是________,生成新物质的微粒是________;(请说出具体分子、原子的名称)
(2)分子和原子的本质区别是________;
27.
(1)“用微粒的眼光看世界”,是我们学习科学的重要思想方法。试根据以下材料,结合你所学知识,简要回答问题:
材料一:微波炉的工作原理是利用微波穿透食物达5cm深,使食物中的水分子产生高频率震动,并摩擦,产生大量的热量,达到运动式加热或烹饪食物的目的。
材料二:一滴水里大约有15万亿亿个水分子,如果10亿人来数一滴水里的水分子,每人每分钟数100个,日夜不停,需要数3万多年才能数完。
材料三:某同学在课后做如图所示的实验:在一个玻璃容器中加入100mL水,向水中放入一块糖,立即在容器外壁沿液面画一水平线,过一会儿发现糖块溶解,液面比原来水平线降低了。
①材料一说明:________;
②材料二说明:________;
③材料三说明:________;
④分子是由原子构成的。
请谈谈你对“原子是化学变化的最小粒子”这句话的认识:________。
(2)在科学学习过程中,常常要用到分类的方法,利用分类的方法学习科学,可以起到事半功倍的效果。现有①人体呼出的气体;②五氧化二磷;③酒精;④液态氮;⑤四氧化二氮;⑥固体二氧化碳;⑦氩气;⑧澄清石灰水。用序号填空:含有氮分子的是________;由原子直接构成的物质是________。
28.碘是一种由碘分子构成的非金属,某同学利用碘进行了如下的实验:
①把少量的固体碘放在湿润的馒头上,发现馒头会变蓝色;
②再取少量的碘溶解在水中,用馒头去蘸取碘液,发现馒头也会变蓝色。(提示:碘分子能使馒头中的淀粉变蓝色)则:
(1)取少量的碘放入烧杯中,用酒精灯加热,碘升华变成碘蒸气,把湿润的馒头放在碘蒸气中,馒头________变蓝色(选填“会”或“不会”)。
(2)把碘溶解在酒精中,可以得到用来消毒用的碘酒,用馒头去沾取少量的碘酒,馒头________(选填“会”或“不会”)变蓝色。
(3)请用分子的观点来解释实验中的现象________。
(4)现在市场上买来的食盐都是加碘盐,用馒头沾取少量的食盐水,馒头不变蓝色,由此可知,食盐中________(存在或不存在)碘分子。
29.利用分子的性质解释下列事实:
(1)把糖块放在水里,糖块逐渐消失,而水却有甜味: 。
(2)气体容易压缩,而液体、固态难以压缩: 。
(3)液氧和氧气状态不同,但具有相同的化学性质: 。
(4)蜡烛燃烧后生成二氧化碳和水: 。
四、解答题
30.机动车“双限”政策出台、全民参与“五水共治”一项项举措正在使杭州的天更蓝、水更清、路更畅。请回答下列问题:
(1)PM2.5吸入人体后,一部分会携带有害物质进入血液,对血管尤其是最内层的血管内膜层造成损伤,由此会产生血管内膜增厚、血管狭窄等症状,从而易诱发的疾病是
A.遗传病
B.冠心病
C.艾滋病
D.糖尿病
(2)利用科技手段处理汽车尾气能有效减少污染,如图是某种汽车尾气处理装置中发生化学反应的微观示意图,请据图写出图中所有含氮元素化合物的化学式________,同时书写装置中发生反应的化学方程式________(反应条件省略)。
31.化学是在分子、原子层面上认识和创造物质的一门科学。
(1)下列有关分子、原子、离子说法正确的是____________;
A. 分子是化学变化中最小的粒子 B. 蔗糖溶于水是由于蔗糖分子发生了改变
C. 分子的质量总比原子质量大 D. 分子、原子、离子都能直接构成物质
(2)过氧化氢溶液是一种常用的杀菌消毒剂,其原因是过氧化氢分子含有“过氧基”(﹣O﹣O﹣),据此推测,下列物质中如图3,可用作杀菌消毒剂的是 (填序号)。
(3)气体A和气体B接触可发生反应,其微观过程如图2
该反应过程中,属于氧化物的是 (填字母)。
32.在高温条件下,A,B两种物质可以发生化学反应生成C和D。反应前后分子种类变化的微观示意图如图所示。
(1)一个A分子中共含有________个原子;
(2)四种物质中,属于单质的是________(填图中的字母序号);
(3)关于该反应,以下叙述正确的是 。
A.分子的个数没有改变
B.原子种类没有改变
C.分子的个数发生改变
33.读图回答下列问题。
(1)比较氢分子(或氧分子)与水分子,可得出什么结论?________。
(2)比较过氧化氢和水分子、乙炔分子和甲烷分子,可得出什么结论?________。
34.“o”代表氢原子,“○”代表氧原子。由氢、氧两种原子构成的分子如下:
(1)比较A、B、D可知:________;
(2)比较C、E可知:________;
(3)比较B、D可知:________。
五、综合说理题
35.用细线把很干净的玻璃板吊在弹簧测力计的下面,记住测力计的读数。使玻璃板水平接触水面,然后稍稍用力向上拉玻璃板。弹簧测力计的读数有什么变化?解释产生这个现象的原因。
答案解析部分
一、单选题
1.答案: A
考点:构成物质的粒子模型
分析:根据图示中反应物和生成物的分子构成,结合置换反应、氧化物定义及物质的粒子构成分析。
解答:A、该反应中反应物无单质,不属于置换反应,符合题意;
B、 该反应涉及二氧化碳和水2种氧化物 ,不符合题意;
C、 四种物质均由分子构成 ,不符合题意;
D、 该反应生成物为甲烷和氧气,能获取清洁能源和助燃剂 ,不符合题意;
故选A。
2.答案: B
考点:构成物质的粒子模型,质量守恒定律及其应用,置换反应及其应用
分析:根据图示中各粒子的分子构成书写化学式,并按方程式书写原则书写出方程式,结合化学反应实质及置换反应定义分析。
解答:A、图中乙为单质,化学式为H2 , 不符合题意;
B、该反应方程形式为CO2+3H2=CH4O+H2O,则丙和丁的质量比为32:18=16:9,符合题意;
C、 反应前后,分子种类发生改变,原子的种类不变 ,不符合题意;
D、该反应中生成物都是化合物,不属于置换反应,不符合题意;
故选B。
3.答案: A
考点:构成物质的粒子模型
分析:原子得到电子带负电荷,失去电子带正电荷,据此分析判断。
解答:在NaCl中,Na的化合价为+1价,带一个单位的正电荷,即失去一个电子;Cl的化合价为-1价,带一个单位的负电荷,即得到一个电子,故A正确,而B、C、D错误。
故选A。
4.答案: A
考点:分子的定义与分子的特性
分析:(1)分子是保持物质化学性质的最小微粒;
(2)化学变化的本质:分子分解为原子,原子再重新组合成分子的过程;
(3)分子由原子构成;
(4)物质由分子构成,而分子由原子构成。
解答:A.保持乙烯化学性质的微粒是乙烯分子,故A正确;
B.乙烯参与化学反应时,乙烯分子分解为原子,再与其它原子组合成新的分子,故B错误;
C. 乙烯分子由碳原子和氢原子组成,故C错误;
D. 1个乙烯分子中含有4个氢原子,故D错误。
故选A。
5.答案: D
考点:构成物质的粒子模型
分析:根据一个水分子是由2个氢原子和1个氧原子构成分析。
解答:一个水分子是由2个氢原子和1个氧原子构成,所以水分子的模型为;
故选D。
6.答案: A
考点:构成物质的粒子模型
分析:根据电解水时先水分子分解,然后氢、氧原子再重新组合分析。
解答:电解水时先水分子分解生成氢原子和氧原子,然后氢、氧原子再重新组合,生成氢分子和氧分子,所以变化的顺序为①②③④;
故选A。
7.答案: B
考点:分子和原子的区别和联系
分析:根据对分子和原子的认识分析判断。
解答:①分子、原子和离子,都是构成物质的基本微粒,因此物质不一定是由分子构成的,故①错误;
②分子由原子构成,故②正确;、
③原子可以独立存在,例如金属就是由原子直接构成的物质,故③错误;
④分子是保持物质化学性质的一种粒子,故④正确;
⑤分子的质量等于构成它的原子的质量之和,故⑤正确;
⑥分子在不停的运动,故⑥正确。
那么存在明显不足的是①③。
故选B。
8.答案: C
考点:分子的定义与分子的特性
分析: 无论是固体碘还是碘蒸气其构成都是由碘分子构成的,碘具有能使淀粉变蓝的性质,据此分析判断。
解答:固态碘和碘蒸气中含有相同的碘分子,都能使淀粉溶液变蓝,说明相同的物质具有相同的分子,其化学性质也相同,与分子的质量、 体积、运动速度无关。
故C正确,而A、B、D错误。
故选C。
9.答案: C
考点:分子和原子的区别和联系,化学式的书写及意义,常见物质的分类
分析:(1)根据示意图分析分子和原子是否改变即可;
(2)只由一种元素组成的纯净物叫单质,由多种元素组成的纯净物叫化合物;
(3)根据丙的化学式分析它的元素组成;
(4)分子由原子构成。
解答:A.在实验中,反应后和反应前分子的种类改变,而原子的种类不变,因此原子是化学变化中的最小微粒,故A错误;
B.甲由两种元素组成,为化合物,而乙只由一种元素组成,为单质,丙由三种元素组成也是化合物,故B错误;
C.根据图片可知,丙由碳、氢和氧三种元素组成,故C正确;
D.一个丙分子由1个氧原子、1个碳原子和4个氢原子构成,故D错误。
故选C。
10.答案: C
考点:分子的定义与分子的特性,元素的概念
分析:(1)同种分子化学性质相同,不同分子化学性质不同;
(2)决定元素种类的是核内质子数;
(3) 分子的排列方式不会影响化学性质,只会影响物理性质;
(4)决定元素化学性质的是最外层电子数。
解答: A.同种分子化学性质相同,不同分子化学性质不同,因为分子构成不同,所以水和过氧化氢的化学性质不同,故A正确不合题意;
B.决定元素种类的是核内质子数,碳原子和氮原子的质子数不同,所以所属的元素种类不同,故B正确不合题意;
C.因为碳原子排列方式不同,所以金刚石和石墨的化学性质相同,而物理性质不同,故C错误符合题意;
D.决定元素化学性质的是最外层电子数,钠原子和钠离子的最外层电子数不同,所以钠原子和钠离子的化学性质不同,故D正确不合题意。
故选C。
11.答案: A
考点:构成物质的粒子模型,分子、原子、离子、元素与物质之间的关系,单质和化合物,化合反应和分解反应
分析:(1)一种物质生成两种或多种物质的反应,叫分解反应;
(2)只由一种元素组成的纯净物叫单质;
(3)计算出反应前后元素的化合价,然后进行比较即可;
(4)根据示意图确定反应物和生成物,据此写出反应的方程式。
解答:A.反应物只有一种, 生成物为和, 该反应为分解反应,故A正确;
B.反应物只由一种元素组成,为单质,故B错误;
C.反应前,氧元素的化合价为-2价;反应后,氧元素的化合价为0价,故C错误;
D.该反应的化学方程式为: 2H2O2=2H2O+O2 ,故D错误。
故选A。
12.答案: B
考点:构成物质的粒子模型,书写化学方程式、文字表达式
分析:有关微观模拟图的题目在解答时,先根据反应前后各微粒的构成确定反应物和生成物,写出反应方程式,然后按方程式进行解答,书写方程式时要注意配平。
解答:该反应方程式为CO2+3H2=CH4O+H2O;
A、该反应生成物中无单质,不是置换反应,不符合题意;
B、参加反应的甲、乙物质分子个数比为1:3 ,符合题意;
C、甲为二氧化碳,不是有机物,不符合题意;
D、该反应前后氢元素化合价发生变化 ,不符合题意;
故选B。
13.答案: D
考点:分子的定义与分子的特性,常见物质的分类
分析:(1)由两种或多种元素组成的纯净物叫化合物;
(2)根据乙图分析物质的构成情况;
(3)分析两种分子的构成是否相同;
(4)根据图片确定参加反应的粒子个数。
解答:A.根据甲图可知,该物质由两种元素组成,为化合物,故A正确不合题意;
B.根据乙图可知,两个原子各自独立,互不相干,因此该物质由原子构成,故B正确不合题意;
C.根据丙图可知,两种分子的构成明显不同,因此它们的化学性质不同,故C正确不合题意;
D.比较反应前后,反应前后都有一个, 将其去掉,那么参加化学反应的微粒的个数比为 =2:2:1,故D错误符合题意。
故选D。
14.答案: B
考点:分子和原子的区别和联系,同位素
分析:(1)根据O2和O3化学式的含义进行分析;
(2)一个氧分子由2个氧原子构成,一个臭氧分子由3个氧原子构成,故3个氧分子和2个臭氧分子的质量相等;
(3)具有相同质子数和不同中子数的原子成为同位素;
(4)根据各种微粒中含有的电子数分析判断.
解答:A.设分子数为n,那么O2和O3的氧原子个数之比为:2n:3n=2:3;一个氧原子含有8个质子,那么它们质子数的比值为:(8×2):(8×3)=2:3,故A错误;
B.一个氧分子由2个氧原子构成,一个臭氧分子由3个氧原子构成,故3个氧分子和2个臭氧分子的质量相等,而3个氧气分子和2个臭氧分子都含6个氧原子,故所含原子数目相同,故B正确;
C.O2和O3中氧原子的质子数和中子数相等,不是同位素,故C错误;
D.H2O2、O2-、O22- 三种微粒中所含的电子数分别为18、10、18,所以三种微粒中所含的电子数多少排列为H2O2=O22->O2- , 故D错误。
故选B。
15.答案: D
考点:分子和原子的区别和联系,催化剂在化学反应中的作用,化合反应和分解反应,书写化学方程式、文字表达式
分析:(1)根据催化剂的作用分析;
(2)分子是保持物质化学性质的最小微粒;
(3)根据微观示意图确定反应物和生成物,进而写出方程式;
(4)一种物质生成多种物质的反应叫分解反应、
解答:A.催化剂可能加快反应速率,也可能减慢反应速率,故A错误;
B.保持氢气化学性质的最小粒子是H2 , 故B错误;
C.该反应的化学方程式是: 2CH4C2H4+2H2 ,故C错误;
D.反应前后分子的种类发生了改变,由于反应物有一种,而生成物有两种,因此为分解反应,故D正确。
故选D。
二、填空题
16.答案: (1)2NaOH +CO2=Na2CO3+H2O
(2)
考点:构成物质的粒子模型,书写化学方程式、文字表达式
分析:(1)根据氢氧化钠与二氧化碳反应生成碳酸钠和水分析;
(2)根据反应前后溶液中溶质成分及离子种类分析。
解答:(1)氢氧化钠与二氧化碳反应生成碳酸钠和水,反应方程式为2NaOH +CO2=Na2CO3+H2O ;
(2)该反应反应后溶液溶质为碳酸钠,反应前为氢氧化钠,反应前后相同的粒子为钠离子,所以“”表示的微粒 。
故答案为:(1)2NaOH +CO2=Na2CO3+H2O ;(2)。
17.答案: (1)Zn+H2SO4=ZnSO4 +H2↑
(2)SO42-
考点:构成物质的粒子模型,酸的化学性质
分析:(1)根据锌与硫酸反应生成硫酸锌和氢气分析;
(2)根据反应前后烧杯中离子种类分析。
解答:(1)锌与硫酸反应生成硫酸锌和氢气,反应方程式为Zn+H2SO4=ZnSO4 +H2↑ ;
(2)反应前烧杯中为氢离子和硫酸根离子,反应后为锌离子和硫酸根离子,则“●”表示SO42- ;
故答案为:(1)Zn+H2SO4=ZnSO4 +H2↑ ;(2) SO42- 。
18.答案: (1)2NO+2CO = N2+2CO2
(2)单质
考点:构成物质的粒子模型,单质和化合物
分析:(1)由微观图示中各分子构成结合方程式书写原则分析;
(2)根据由同种元素组成的纯净物为单质分析。
解答:(1)由微观图示可知,该反应的方程式为 2NO+2CON2+2CO2 ;
(2) 该反应生成物中的“”由一种元素组成,属于单质;
故答案为:(1) 2NO+2CON2+2CO2 ;(2)单质。
19.答案: 2种;不相同;20%
考点:分子的定义与分子的特性,有关化学式的计算和推断
分析:(1)在化学式中,一种符号代表一种元素;
(2)分子是保持物质化学式性质的最小微粒,分子不同,则化学性质不同;
(3)元素的质量分数=。
解答:(1)根据化学式 H2O 、 H2O2 和 D2O 可知,这三种物质所含的元素只由2种,即氢元素和氧元素;
(2)水与双氧水的分子不同,则它们的化学性质不同;
(3)重水中氢元素的质量分数是:。
20.答案: (1)丙→甲 →乙
(2)催化
考点:构成物质的粒子模型,催化剂在化学反应中的作用
分析:(1)根据化学反应实质分析;
(2)根据氮化镓-锑合金为催化剂分析。
解答:(1)电解水时水分子先分成氢原子氧原子,然后氢氧原子再重新结合成氢分子和氧分子,所以反应过程为 丙→甲 →乙 ;
(2) 氮化镓-锑合金在利用太阳光分解水的反应中起催化作用;
故答案为:(1) 丙→甲 →乙 ;(2)催化。
21.答案: (1)H2O
(2)6NO+4NH3=5N2+6H2O
考点:构成物质的粒子模型
分析:(1)根据水分子的构成分析;
(2)根据微观图示中反应物和生成物的分子构成书写方程式分析。
解答:(1) 用●表示氧原子,用〇表示氢原子,则表示水分子,化学式为H2O ;
(2)由反应图示可知,该反应的方程式为6NO+4NH35N2+6H2O。
故答案为:(1) H2O ;(2)6NO+4NH35N2+6H2O。
22.答案: (1)氧分子
(2)受压时氧气分子间的间隔变小(或分子间有空隙)
(3)分子运动
(4)氧原子和碳原子
考点:分子之间存在空隙,分子的定义与分子的特性,分子、原子、离子、元素与物质之间的关系
分析:(1)物质由分子、原子或离子构成;
(2)物质在固、液、气三态之间相互转化时,分子的种类不变,改变的就是分子之间的空隙;
(3)根据分子运动论的知识解答;
(4)在化学变化中,分子分解为原子,原子再重新组合成分子,据此分析解答。
解答:(1)氧气和液氧都是由氧分子构成的。
(2)氧气可压缩为液氧储存于钢瓶中,说明受压时氧气分子间的间隔变小(或分子间有空隙);
(3)空气中的氧气无处不在,是分子运动的结果。
(4)氧气与碳发生化学反应时,没有改变的两种粒子是氧原子和碳原子。
23.答案: (1)C
(2)原子在化学反应中不能再分,分子可以再分
(3)3H2+N2 2NH3
考点:分子和原子的区别和联系,书写化学方程式、文字表达式
分析:(1)根据反应的示意图判断即可;
(2)分析反应前后原子和分子的种类是否发生改变即可;
(3)根据示意图确定反应物和生成物,以及反应条件,最后写出反应的化学方程式。
解答:(1)因为为氮原子,所以为氮气分子;因为为氢原子,所以为氢气分子;因为生成物为氨气,所以为氨气分子,故选C。
(2)将反应物和生成物比较可知,原子的种类和个数保持不变,而分子的种类和个数都发生了变化,因此原子和分子的主要区别是:原子在化学反应中不能再分,分子可以再分。
(3)氢气和氮气在高温、高压和催化剂的作用下,生成氨气,反应的方程式为:。
24.答案: (1)水;氯化钠
(2)B
(3)A
(4)H2+CuO Cu+H2O;CaO+H2O=Ca(OH)2;Ca(OH)2 + 2HCl = CaCl2+2H2O
考点:水资源的保护,溶液的组成及特点,分子的定义与分子的特性,书写化学方程式、文字表达式
分析:(1)根据固体与水形成溶液,固体是溶质,水是溶剂分析;
(2)根据水体污染的原因分析;
(3)根据水蒸发是分子间隔发生改变分析;
(4)根据反应方程式的书写及反应类型的特点分析。
解答:(1) 生理盐水中的溶剂是水,溶质是氯化钠;
(2) 大量使用化肥农药会造成水体污染,A错误;工业废水处理达标后排放可防止水污染,B正确;使用含磷洗衣粉会使水富营养化,造成污染,C错误;生活污水直接排放会污染水体,D错误;
(3) 在水蒸发的过程中水分子运动加速,分子间间隔变大,而水分子本身不发生变化,水分子只能保持水的化学性质,故A正确;
(4)根据游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环。反应①中生成的H2可以作还原剂,则②置换反应可以是氢气与金属氧化物的反应生成金属和水,如氢气与氧化铜反应生成铜和水,然后利用水与氧化钙反应生成氢氧化钙书写③化合反应的化学方程式,最后利用氢氧化钙与盐酸发生复分解反应写出④复分解反应的化学方程式。
故答案为:(1)水;氯化钠;(2)B;(3)A;(4)
H2+CuO Cu+H2O;CaO+H2O=Ca(OH)2;Ca(OH)2 + 2HCl = CaCl2+2H2O。
25.答案: 分子间空隙;无机物;ABD;固体溶解,溶液由无色变为浅绿色,有气泡产生;Cl-;Fe2+
考点:构成物质的粒子模型,有机物与无机物的区别,酸的化学性质
分析:根据状态改变是分子间隔改变、盐酸属于无机物、酸的化学性质、铁与盐酸反应时氯离子反应前后未改变及盐酸和氯化亚铁溶液中粒子构成分析。
解答: HCl由气态变为液态, 是分子间隔发生改变;盐酸属于无机物,铁锈成分为氧化铁,能与盐酸反应,A正确;水垢成分为碳酸钙,能与盐酸反应,B正确;硝酸钾不能与盐酸反应,C错误;苛性钠为氢氧化钠,能与盐酸反应,D正确; 在盐酸中加入过量的铁粉,可观察到有气泡产生,溶液变成浅绿色;铁与盐酸反应,氯离子不变,由反应前后粒子种类可知,为氯离子,为氢离子,为亚铁离子;
故答案为:分子间空隙;无机物;ABD;固体溶解,溶液由无色变为浅绿色,有气泡产生;Cl-;Fe2+ 。
三、实验探究题
26.答案: (1)水分子;氢原子、氧原子;氢分子、氧分子
(2)在化学变化中,分子可分,原子不可分
考点:分子和原子的区别和联系
分析:(1)在化学变化中,分子分解为原子,原子再重新组合成分子,因此变化的是分子,而保持不变的是原子,据此分析解答;
(2)从分子和原子在化学变化中是否可以再分的角度分析二者的区别。
解答:(1)在水电解的过程中,发生改变的微粒是水分子, 不变的微粒是氢原子、氧原子, 生成新物质的微粒是氢分子、氧分子;
(2)分子和原子的本质区别是:在化学变化中,分子可分,原子不可分。
27.答案: (1)分子是不断运动的;分子的体积和质量都很小;分子之间存在空隙;化学变化中分子可以再分,而原子不可再分
(2)①④;⑦
考点:分子的热运动,分子之间存在空隙,分子的定义与分子的特性
分析:(1)①根据“使食物中的水分子产生高频率震动,并摩擦,产生大量的热量”分析;
②一滴水的体积和质量本就很小,而组成一滴水的分子个数却很多很多,那么平均下来,一个分子的体积和质量就会很小很小;
③水面下降,说明水和块糖的总体积减小了,只能是因为糖分子跑到水分子的空隙里面去了,即分子有空隙;
④可从化学变化中分子和原子是否能够再分解答。
(2)氮气由氮分子构成;由原子直接构成的物质有:金属单质和少数的非金属单质,稀有气体、
解答:(1)①材料一说明:、分子是不断运动的;
②材料二说明:分子的体积和质量都很小;
③材料三说明:分子之间存在空隙;
④分子是由原子构成的。
我对“原子是化学变化的最小粒子”这句话的认识:化学变化中分子可以再分,而原子不可再分。
(2)含有氮分子的只能是氮气,人体呼出的气体中含有氮气,液态氮是氮气的液态形式,故选①④;
由原子直接构成的物质:氩气,故选⑦。
28.答案: (1)会
(2)会
(3)分子是保持化学性质的最小微粒,碘的升华和溶解都是物理变化,碘分子不变 ,所以化学性质不变
(4)不存在
考点:分子的热运动,分子的定义与分子的特性
分析:(1)碘蒸气也是由碘分子构成;(2)发生物理变化时,分子本身不变,变化的是分子之间的间隔;(3)化合物中存在的碘元素。
解答:(1)碘升华变成碘蒸气都是由碘分子构成,都能使淀粉变蓝色,所以馒头会变蓝;
(2)发生物理变化时,实质是构成碘的分子之间的间隔发生了变化,碘分子并没有发生变化,所以馒头也会变蓝色;
(3)解释: 分子是保持化学性质的最小微粒,碘的升华和溶解都是物理变化,碘分子不变 ,所以化学性质不变;
(4)根据碘遇淀粉变蓝色的原理,加碘盐不能使馒头变蓝色,说明不含碘分子。
故答案为:(1)会;(2)会;(3)
分子是保持化学性质的最小微粒,碘的升华和溶解都是物理变化,碘分子不变 ,所以化学性质不变 ;(4)不存在。
29.答案: (1)糖块溶解在水中后,糖分子不断地运动,扩散到水分子中去了
(2)气体分子间间隔大,液体、固体分子间间隔较小
(3)同种物质的分子化学性质相同
(4)分子在化学变化中分成原子,原子又重新组合成新的分子
考点:分子的热运动,分子间的作用力,分子之间存在空隙,分子和原子的区别和联系
解答:回答本题首先要熟悉分子的性质:分子质量和体积都很小;分子间有间隔;分子在不断地运动;同种物质的分子化学性质相同,不同种物质的分子化学性质不同;分子在化学变化中可分为原子,原子又重新组合成新的分子。
分析:该题考查了分子的性质。
四、解答题
30.答案: (1)B
(2)NO、NH3;4NH3 + 6NO=5N2 + 6H2O
考点:非传染性疾病,构成物质的粒子模型,书写化学方程式、文字表达式
分析:(1)PM2.5吸入人体后,通过血液循环对人体造成伤害 。
(2)化学反应中,化合价升高的元素在反应中被氧化,化合价降低的元素在反应中被还原。
解答:(1)冠心病是由于身体内的某条血管管壁硬化、管腔变窄,导致心肌细胞缺血而引起的病变, PM2.5吸入人体导致冠状动脉病变,因此容易诱发冠心病,B符合题意。
(2)图中所有含氮元素化合物的化学式为: NO、NH3, 氨气与一氧化氮反应的方程式为:4NH3 + 6NO=5N2 + 6H2O。
故答案为:(1)B(2)NO、NH3; 4NH3 + 6NO=5N2 + 6H2O ;
31.答案: (1)D
(2)④
(3)BD
考点:构成物质的粒子模型,分子、原子、离子、元素与物质之间的关系,单质和化合物
分析:(1)从构成物质的微观粒子切入解答。
(2)含有“过氧基”(-O-O-)有杀菌消毒作用。
(3)由两种元素组成,且其中一种元素是O.属于氧化物。
解答:(1)A、化学变化的实质是分子分裂成原子,原子又重新组合成新分子,故化学变化中的最小粒子是原子,A不符合题意;
B、蔗糖放入水中一段时间后,蔗糖不见了,是因为蔗糖分子不断运动,进入到水分子的间隔中,所以蔗糖不见了,但蔗糖分子没有发生变化,B不符合题意;
C、有些大原子的质量要比小分子的质量大, 一个铁原子的质量是9.288×10-26kg,一个氢分子的质量为3.3×10-27kg,因此一个铁原子就比一个氢分子质量大,C不符合题意;
D、分子、原子、离子都可以直接构成物质,离子构成的物质有:大多数盐、碱和活泼金属氧化物。如氯化钠由钠离子和氯离子构成,氢氧化钾由钾离子和氢氧根离子构成,D符合题意。
(2)根据含有“过氧基”(-O-O-)有杀菌消毒,观察选项可知④中含有过氧基,所以可用作杀菌消毒剂。
(3)①氧化物是由两种元素组成其中一种是氧元素,所以可知B为SO2、D为H2O,都属于氧化物。
故答案为:(1)D(2)④(3)BD
32.答案: (1)5
(2)D
(3)B,C
考点:化学变化与物理变化的判别,构成物质的粒子模型,单质和化合物
分析:由模型推出化学反应方程式:CH4+H2O=CO+3H2
解答:(1)由分子模型可以看出,一个A分子由1个碳原子和4个氢原子构成,共5个原子;
(2)由同种元素构成的纯净物叫单质,只有D满足单质的条件;
(3)化学反应的实质是分子的种类改变,分子的个数可能改变;原子的种类和个数都不变,故BC正确。
由CH4+H2O=CO+3H2 , 分子个数改变,原子种类不变。
故答案为:(1)5;(2)D;(3)BC
33.答案: (1)构成分子的原子可以是同种原子,也可以是不同种原子。
(2)同种原子、不同的个数可以构成不同的分子。
考点:分子和原子的区别和联系
分析:(1)根据分子的结构来分析;
(2)根据不同分子的结构来分析。
解答:(1)氢分子只由氢原子构成,水分子由氢原子和氧原子构成,可以得到结论:构成分子的原子可以是同种原子,也可以是不同种原子;
(2)过氧化氢分子由2个氧原子和2个氢原子构成,而水分子由1个氢原子和2个氢原子构成,发现它们原子种类相同,但原子个数不同,得到结论:同种原子、不同的个数可以构成不同的分子。
34.答案: (1)分子可以由同种原子构成
(2)分子可以由不同种原子构成
(3)数量不相同的原子可以构成不同的分子
考点:分子的定义与分子的特性
分析:根据图示中各分子的构成情况分析。
解答: (1)、A、B、D都是同种原子构成的分子,所以由此可知分子可以由同种原子构成;
(2)C和E中分子都是由不同种原子构成,所以由此可知分子可以由不同种原子构成;
(3)B和D是同种原子构成的不同种分子,由此可知 数量不相同的原子可以构成不同的分子 。
五、综合说理题
35.答案: 弹簧测力计的读数会变大,因为玻璃和水两种物质的分子间存在着引力。
考点:分子的热运动,分子间的作用力,分子之间存在空隙,分子的定义与分子的特性
解答:由于玻璃和水两种物质的分子间存在着引力,因此弹簧测力计的读数会变大。
分析:该题考查分子动理论的基本观点,分子间存在着引力,所以弹簧测力计的示数会变大。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
