6.3物质的溶解性课时作业---2021_2022学年九年级化学沪教版(全国)下册(word版 含答案)
文档属性
| 名称 | 6.3物质的溶解性课时作业---2021_2022学年九年级化学沪教版(全国)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 111.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-02 09:33:53 | ||
图片预览

文档简介
6.3物质的溶解性课时作业
一、选择题:
1、影响固体物质溶解度大小的主要因素是( )
A.溶质和溶剂的性质 B.固体颗粒大小 C.溶质的质量 D.溶剂的质量
2、要使一杯氯化铵不饱和溶液变为饱和溶液,可采取的方法是( )
A.加水 B.不断搅拌
C.升高温度 D.加入氯化铵固体
3、冬天,人们喜欢喝热的可乐。打开可乐盖时可观察到有大量气泡冒出,而且能闻到可乐的香味,但加热之后就观察不到气泡了。对此合理的解释是( )
A.香料的分子在不停地运动
B.打开盖时,二氧化碳分子分成了原子
C.加热时,二氧化碳的溶解度增大
D.打开盖时,二氧化碳的溶解度增大
4、下列措施中,能够增强蔗糖在水中溶解性的是( )
A.加热 B.搅拌 C.增加水量 D.将蔗糖研碎
5、在20℃时,食盐的溶解度是36g,将5g食盐放入10g水中,在20℃时,所得食盐饱和溶液( )
A.15g B.14g C.13.6g D.12.5g
6、要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
7、建构模型是学习化学的重要方法。下列选项中不正确的是( )
A.金属化学性质 B.反应类型关系
C.地壳元素含量 D.溶液之间关系
8、关于溶解度说法正确的是( )
A.硝酸钾的溶解度为222g/100g水 B.溶解度随温度升高而升高
C.难溶物质的溶解度为零 D.溶解度可以定量的表示物质溶解性的大小
9、60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )
A.溶质质量:溶剂质量=10:11
B.溶剂质量:溶液质量=20:21
C.溶质质量:溶剂质量=11:10
D.溶液质量:溶质质量=21:10
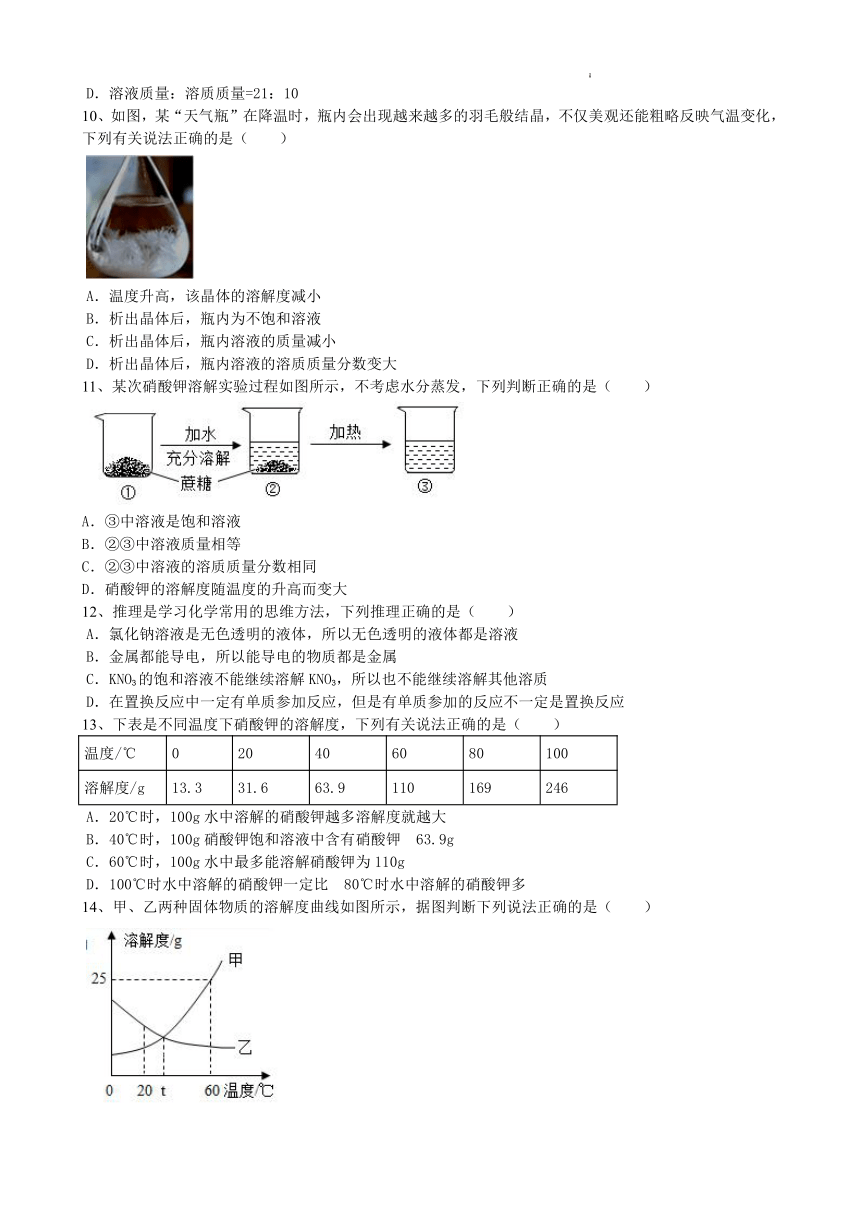
10、如图,某“天气瓶”在降温时,瓶内会出现越来越多的羽毛般结晶,不仅美观还能粗略反映气温变化,下列有关说法正确的是( )
A.温度升高,该晶体的溶解度减小
B.析出晶体后,瓶内为不饱和溶液
C.析出晶体后,瓶内溶液的质量减小
D.析出晶体后,瓶内溶液的溶质质量分数变大
11、某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
12、推理是学习化学常用的思维方法,下列推理正确的是( )
A.氯化钠溶液是无色透明的液体,所以无色透明的液体都是溶液
B.金属都能导电,所以能导电的物质都是金属
C.KNO3的饱和溶液不能继续溶解KNO3,所以也不能继续溶解其他溶质
D.在置换反应中一定有单质参加反应,但是有单质参加的反应不一定是置换反应
13、下表是不同温度下硝酸钾的溶解度,下列有关说法正确的是( )
温度/℃ 0 20 40 60 80 100
溶解度/g 13.3 31.6 63.9 110 169 246
A.20℃时,100g水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾 63.9g
C.60℃时,100g水中最多能溶解硝酸钾为110g
D.100℃时水中溶解的硝酸钾一定比 80℃时水中溶解的硝酸钾多
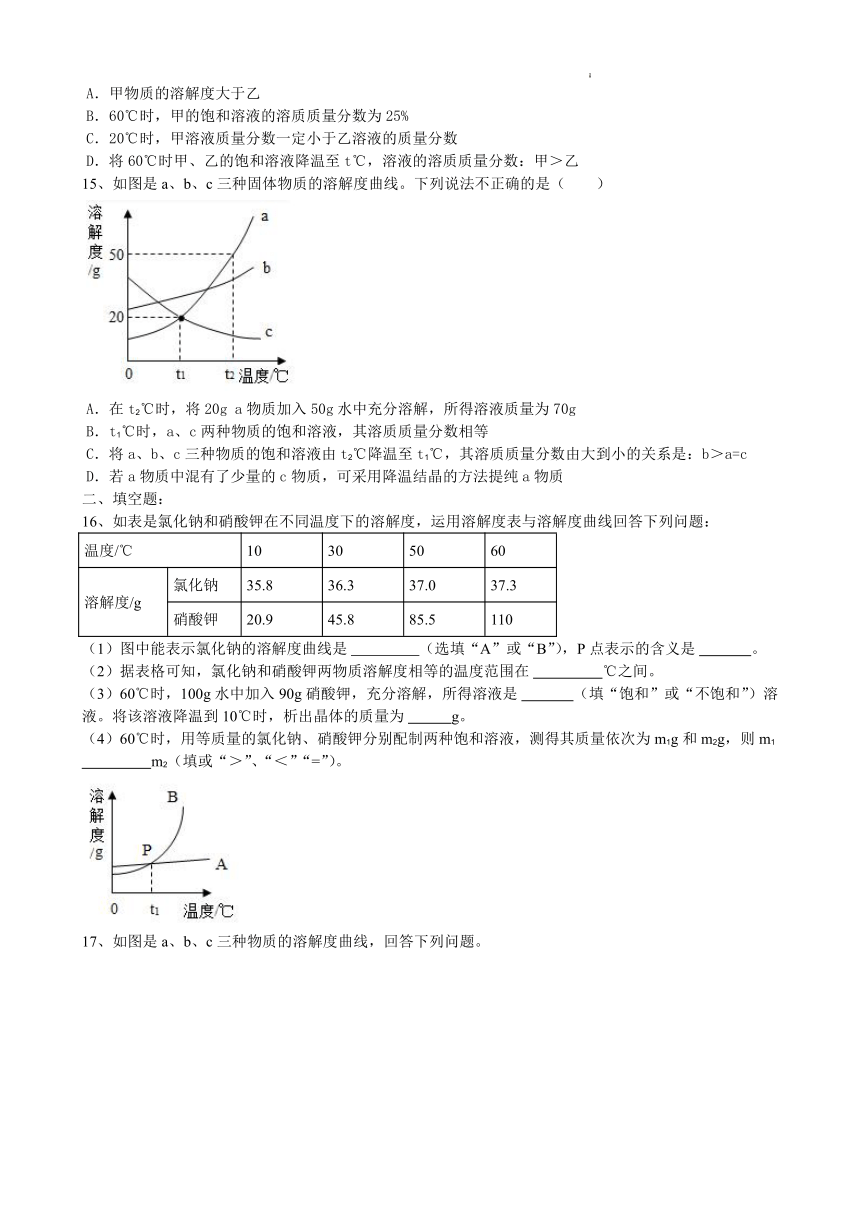
14、甲、乙两种固体物质的溶解度曲线如图所示,据图判断下列说法正确的是( )
A.甲物质的溶解度大于乙
B.60℃时,甲的饱和溶液的溶质质量分数为25%
C.20℃时,甲溶液质量分数一定小于乙溶液的质量分数
D.将60℃时甲、乙的饱和溶液降温至t℃,溶液的溶质质量分数:甲>乙
15、如图是a、b、c三种固体物质的溶解度曲线。下列说法不正确的是( )
A.在t2℃时,将20g a物质加入50g水中充分溶解,所得溶液质量为70g
B.t1℃时,a、c两种物质的饱和溶液,其溶质质量分数相等
C.将a、b、c三种物质的饱和溶液由t2℃降温至t1℃,其溶质质量分数由大到小的关系是:b>a=c
D.若a物质中混有了少量的c物质,可采用降温结晶的方法提纯a物质
二、填空题:
16、如表是氯化钠和硝酸钾在不同温度下的溶解度,运用溶解度表与溶解度曲线回答下列问题:
温度/℃ 10 30 50 60
溶解度/g 氯化钠 35.8 36.3 37.0 37.3
硝酸钾 20.9 45.8 85.5 110
(1)图中能表示氯化钠的溶解度曲线是 (选填“A”或“B”),P点表示的含义是 。
(2)据表格可知,氯化钠和硝酸钾两物质溶解度相等的温度范围在 ℃之间。
(3)60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是 (填“饱和”或“不饱和”)溶液。将该溶液降温到10℃时,析出晶体的质量为 g。
(4)60℃时,用等质量的氯化钠、硝酸钾分别配制两种饱和溶液,测得其质量依次为m1g和m2g,则m1
m2(填或“>”、“<”“=”)。
17、如图是a、b、c三种物质的溶解度曲线,回答下列问题。
(1)P点的含义是 。
(2)t2℃时,将60g a物质加入到100g水中,充分溶解后,所得溶液中溶质与溶液的质量比是 。
(3)t2℃时,要使接近饱和的c溶液变为饱和溶液,采用的方法是 。
(4)若b中含有少量a,提纯b的方法是 。
18、水和溶液与人类生产、生活密切相关。
(1)下列物质溶解或稀释过程中,溶液温度没有明显改变的是(填序号) 。
A.NaOH
B.NH4NO3
C. NaCl
(2)小金同学在t℃下用某固体溶质的溶液做恒温蒸发结晶实验,如图所示,请回答下列问题:
(a)溶液甲属于 溶液(填“饱和”或“不饱和”);
(b)溶液丙与丁溶质质量分数的大小关系是 ;
(c)该固体溶质在t℃时的溶解度为 。
三、实验题:
19、为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
(1)探究溶质的种类对物质溶解性的影响。
在实验中要改变的因素是 。要保持不变的因素是 、 、溶质的质量。
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:相同温度,相同溶剂的条件下, 。
(2)探究温度(以硝酸钾为例)对物质溶解性的影响。
在实验中要改变的因素是 。要保持不变的因素是溶质的种类(硝酸钾)和质量、 。
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5g硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论: 。
参考答案
一、选择题:
1、A 2、D 3、A 4、A 5、C 6、A 7、B 8、D 9、C 10、C
11、D 12、D 13、C 14、D 15、C
二、填空题:
16、答案:(1)A;t1℃时A、B(或氯化钠和硝酸钾)两物质的溶解度相同;
(2)10℃~30℃;
(3)不饱和;69.1;
(4)>。
17、答案:(1)t1℃时,a、c的溶解度相等。
(2)1:3。
(3)加入固体c,恒温蒸发溶剂。
(4)蒸发结晶。
18、答案:(1)C;
(2)(a)不饱和;(b)相等;(c)30g。
三、实验题:
19、答案:(1)溶质的种类;温度;溶剂的种类与体积;不同的固体物质的溶解性不同;
(2)温度;溶剂的种类与体积;在不同温度下,固体物质(KNO3)在水里的溶解性不同。
一、选择题:
1、影响固体物质溶解度大小的主要因素是( )
A.溶质和溶剂的性质 B.固体颗粒大小 C.溶质的质量 D.溶剂的质量
2、要使一杯氯化铵不饱和溶液变为饱和溶液,可采取的方法是( )
A.加水 B.不断搅拌
C.升高温度 D.加入氯化铵固体
3、冬天,人们喜欢喝热的可乐。打开可乐盖时可观察到有大量气泡冒出,而且能闻到可乐的香味,但加热之后就观察不到气泡了。对此合理的解释是( )
A.香料的分子在不停地运动
B.打开盖时,二氧化碳分子分成了原子
C.加热时,二氧化碳的溶解度增大
D.打开盖时,二氧化碳的溶解度增大
4、下列措施中,能够增强蔗糖在水中溶解性的是( )
A.加热 B.搅拌 C.增加水量 D.将蔗糖研碎
5、在20℃时,食盐的溶解度是36g,将5g食盐放入10g水中,在20℃时,所得食盐饱和溶液( )
A.15g B.14g C.13.6g D.12.5g
6、要想从食盐溶液中得到食盐晶体,宜采取的方法是( )
A.蒸发溶剂的方法 B.冷却热饱和溶液的方法
C.倒掉部分溶液的方法 D.升高温度的方法
7、建构模型是学习化学的重要方法。下列选项中不正确的是( )
A.金属化学性质 B.反应类型关系
C.地壳元素含量 D.溶液之间关系
8、关于溶解度说法正确的是( )
A.硝酸钾的溶解度为222g/100g水 B.溶解度随温度升高而升高
C.难溶物质的溶解度为零 D.溶解度可以定量的表示物质溶解性的大小
9、60℃时,硝酸钾的溶解度为110g,该温度下硝酸钾饱和溶液中有关质量关系正确的是( )
A.溶质质量:溶剂质量=10:11
B.溶剂质量:溶液质量=20:21
C.溶质质量:溶剂质量=11:10
D.溶液质量:溶质质量=21:10
10、如图,某“天气瓶”在降温时,瓶内会出现越来越多的羽毛般结晶,不仅美观还能粗略反映气温变化,下列有关说法正确的是( )
A.温度升高,该晶体的溶解度减小
B.析出晶体后,瓶内为不饱和溶液
C.析出晶体后,瓶内溶液的质量减小
D.析出晶体后,瓶内溶液的溶质质量分数变大
11、某次硝酸钾溶解实验过程如图所示,不考虑水分蒸发,下列判断正确的是( )
A.③中溶液是饱和溶液
B.②③中溶液质量相等
C.②③中溶液的溶质质量分数相同
D.硝酸钾的溶解度随温度的升高而变大
12、推理是学习化学常用的思维方法,下列推理正确的是( )
A.氯化钠溶液是无色透明的液体,所以无色透明的液体都是溶液
B.金属都能导电,所以能导电的物质都是金属
C.KNO3的饱和溶液不能继续溶解KNO3,所以也不能继续溶解其他溶质
D.在置换反应中一定有单质参加反应,但是有单质参加的反应不一定是置换反应
13、下表是不同温度下硝酸钾的溶解度,下列有关说法正确的是( )
温度/℃ 0 20 40 60 80 100
溶解度/g 13.3 31.6 63.9 110 169 246
A.20℃时,100g水中溶解的硝酸钾越多溶解度就越大
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾 63.9g
C.60℃时,100g水中最多能溶解硝酸钾为110g
D.100℃时水中溶解的硝酸钾一定比 80℃时水中溶解的硝酸钾多
14、甲、乙两种固体物质的溶解度曲线如图所示,据图判断下列说法正确的是( )
A.甲物质的溶解度大于乙
B.60℃时,甲的饱和溶液的溶质质量分数为25%
C.20℃时,甲溶液质量分数一定小于乙溶液的质量分数
D.将60℃时甲、乙的饱和溶液降温至t℃,溶液的溶质质量分数:甲>乙
15、如图是a、b、c三种固体物质的溶解度曲线。下列说法不正确的是( )
A.在t2℃时,将20g a物质加入50g水中充分溶解,所得溶液质量为70g
B.t1℃时,a、c两种物质的饱和溶液,其溶质质量分数相等
C.将a、b、c三种物质的饱和溶液由t2℃降温至t1℃,其溶质质量分数由大到小的关系是:b>a=c
D.若a物质中混有了少量的c物质,可采用降温结晶的方法提纯a物质
二、填空题:
16、如表是氯化钠和硝酸钾在不同温度下的溶解度,运用溶解度表与溶解度曲线回答下列问题:
温度/℃ 10 30 50 60
溶解度/g 氯化钠 35.8 36.3 37.0 37.3
硝酸钾 20.9 45.8 85.5 110
(1)图中能表示氯化钠的溶解度曲线是 (选填“A”或“B”),P点表示的含义是 。
(2)据表格可知,氯化钠和硝酸钾两物质溶解度相等的温度范围在 ℃之间。
(3)60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是 (填“饱和”或“不饱和”)溶液。将该溶液降温到10℃时,析出晶体的质量为 g。
(4)60℃时,用等质量的氯化钠、硝酸钾分别配制两种饱和溶液,测得其质量依次为m1g和m2g,则m1
m2(填或“>”、“<”“=”)。
17、如图是a、b、c三种物质的溶解度曲线,回答下列问题。
(1)P点的含义是 。
(2)t2℃时,将60g a物质加入到100g水中,充分溶解后,所得溶液中溶质与溶液的质量比是 。
(3)t2℃时,要使接近饱和的c溶液变为饱和溶液,采用的方法是 。
(4)若b中含有少量a,提纯b的方法是 。
18、水和溶液与人类生产、生活密切相关。
(1)下列物质溶解或稀释过程中,溶液温度没有明显改变的是(填序号) 。
A.NaOH
B.NH4NO3
C. NaCl
(2)小金同学在t℃下用某固体溶质的溶液做恒温蒸发结晶实验,如图所示,请回答下列问题:
(a)溶液甲属于 溶液(填“饱和”或“不饱和”);
(b)溶液丙与丁溶质质量分数的大小关系是 ;
(c)该固体溶质在t℃时的溶解度为 。
三、实验题:
19、为了探究影响物质溶解性的因素,小林设计并进行了如下实验。
(1)探究溶质的种类对物质溶解性的影响。
在实验中要改变的因素是 。要保持不变的因素是 、 、溶质的质量。
操作步骤:在常温下,用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入氯化钠、硝酸钾、氢氧化钙各2g,振荡,观察各物质的溶解情况。
实验现象:试管①中有少量氯化钠未溶,试管②中硝酸钾全部溶解,试管③中有多量氢氧化钙未溶。
实验结论:相同温度,相同溶剂的条件下, 。
(2)探究温度(以硝酸钾为例)对物质溶解性的影响。
在实验中要改变的因素是 。要保持不变的因素是溶质的种类(硝酸钾)和质量、 。
操作步骤:用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5g硝酸钾晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中硝酸钾的溶解情况。
实验现象:试管①中有多量硝酸钾未溶,试管②中有少量硝酸钾未溶,试管③中硝酸钾全部溶解。
实验结论: 。
参考答案
一、选择题:
1、A 2、D 3、A 4、A 5、C 6、A 7、B 8、D 9、C 10、C
11、D 12、D 13、C 14、D 15、C
二、填空题:
16、答案:(1)A;t1℃时A、B(或氯化钠和硝酸钾)两物质的溶解度相同;
(2)10℃~30℃;
(3)不饱和;69.1;
(4)>。
17、答案:(1)t1℃时,a、c的溶解度相等。
(2)1:3。
(3)加入固体c,恒温蒸发溶剂。
(4)蒸发结晶。
18、答案:(1)C;
(2)(a)不饱和;(b)相等;(c)30g。
三、实验题:
19、答案:(1)溶质的种类;温度;溶剂的种类与体积;不同的固体物质的溶解性不同;
(2)温度;溶剂的种类与体积;在不同温度下,固体物质(KNO3)在水里的溶解性不同。
