第7章应用广泛的酸、碱、盐 第2节 常见的酸和碱 夯实提升(word版含解析)
文档属性
| 名称 | 第7章应用广泛的酸、碱、盐 第2节 常见的酸和碱 夯实提升(word版含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 278.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-05 23:03:34 | ||
图片预览

文档简介
第7章应用广泛的酸、碱、盐
第2节常见的酸和碱
基础过关
1.(2020·临沂中考·知识点1、3)下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )。
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
2.(2021·雅安月考·知识点2、3)下列反应的化学方程式书写正确的是( )。
A.铁和稀盐酸反应:2Fe+6HCl2FeCl3+3H2↑
B.熟石灰和盐酸反应:CaO+2HClCaCl2+H2O
C.洗去试管壁上附着的铜:Cu+H2SO4CuSO4+H2↑
D.氢氧化钠溶液与硫酸铜溶液混合:2NaOH+CuSO4Cu(OH)2↓+Na2SO4
3.(2020·杭州中考·知识点2)在①氧化铁、②金属锌、③氢氧化铜、④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )。
A.①②③④ B.①②③
C.①③④ D.②③④
4.(知识点3·题型2)如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已略去),请问答问题。
(1)X的物质类别: 。
(2)根据性质①写出检验CO2的化学反应方程式: 。
(3)根据性质②写出能体现碱的相似化学性质的化学方程式: 。
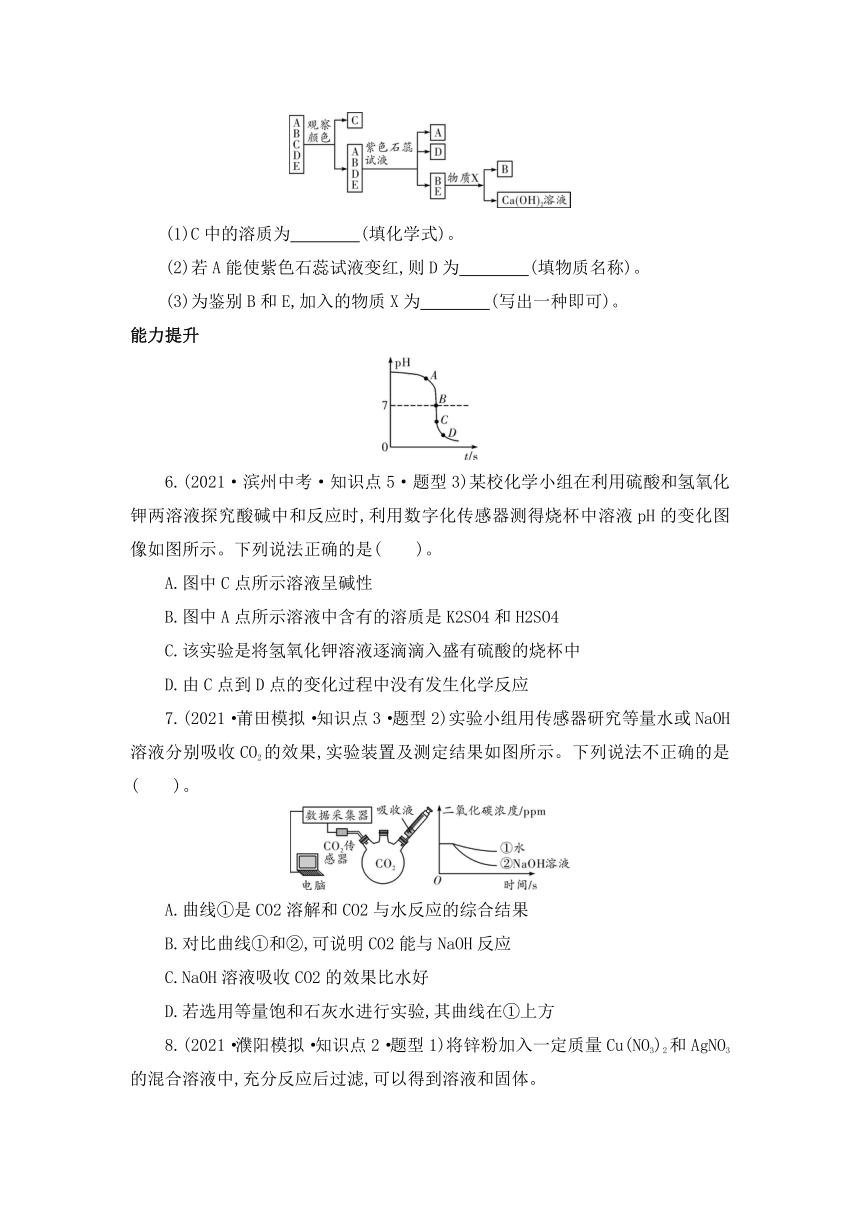
5.(2021·聊城中考·知识点2、3)已知A、B、C、D、E分别为稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、硫酸铜溶液中的一种,为鉴别这五种溶液,化学兴趣小组的同学设计绘制的思维导图如图所示:
(1)C中的溶质为 (填化学式)。
(2)若A能使紫色石蕊试液变红,则D为 (填物质名称)。
(3)为鉴别B和E,加入的物质X为 (写出一种即可)。
能力提升
6.(2021·滨州中考·知识点5·题型3)某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )。
A.图中C点所示溶液呈碱性
B.图中A点所示溶液中含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入盛有硫酸的烧杯中
D.由C点到D点的变化过程中没有发生化学反应
7.(2021·莆田模拟·知识点3·题型2)实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如图所示。下列说法不正确的是( )。
A.曲线①是CO2溶解和CO2与水反应的综合结果
B.对比曲线①和②,可说明CO2能与NaOH反应
C.NaOH溶液吸收CO2的效果比水好
D.若选用等量饱和石灰水进行实验,其曲线在①上方
8.(2021·濮阳模拟·知识点2·题型1)将锌粉加入一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)写出会导致溶液质量变小的有关反应的化学方程式: 。
(2)若所得溶液中只含有一种溶质,则所得固体中一定含有 ,可能含有 。
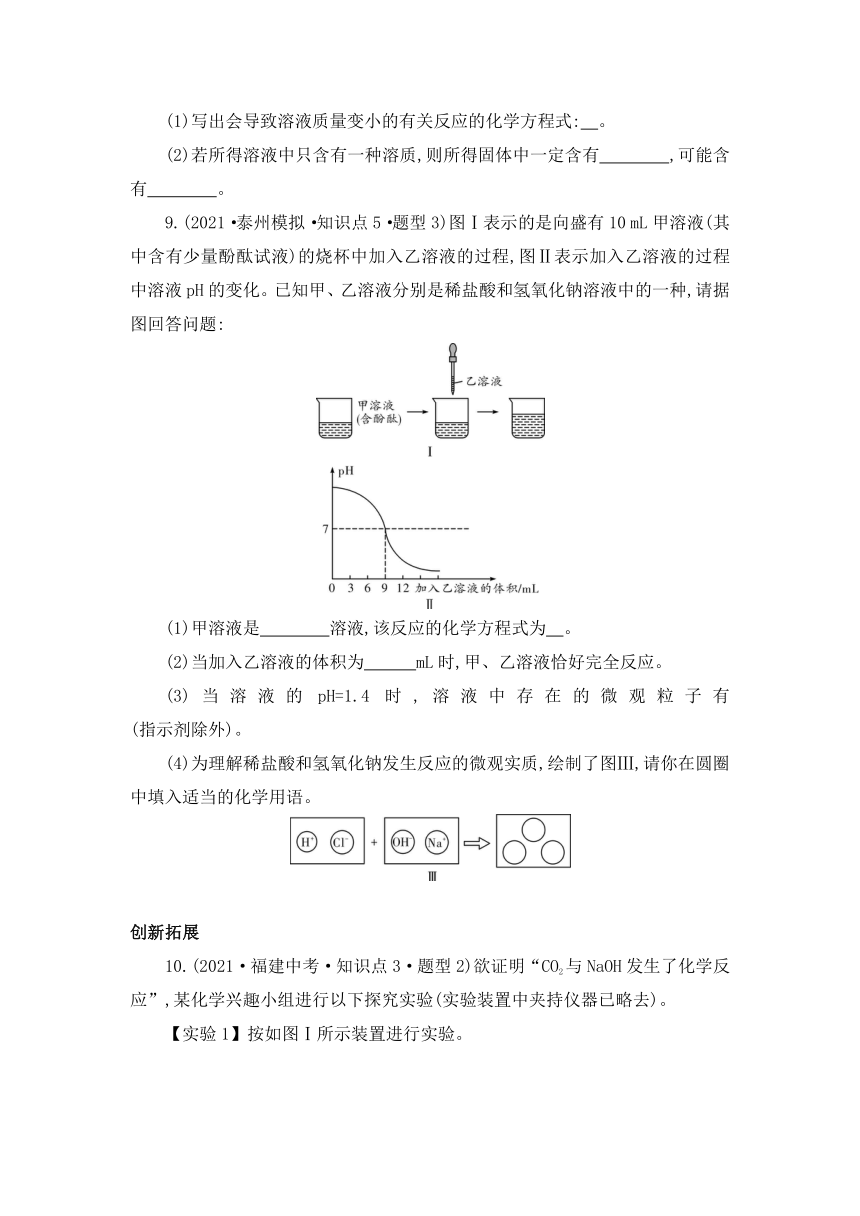
9.(2021·泰州模拟·知识点5·题型3)图Ⅰ表示的是向盛有10 mL甲溶液(其中含有少量酚酞试液)的烧杯中加入乙溶液的过程,图Ⅱ表示加入乙溶液的过程中溶液pH的变化。已知甲、乙溶液分别是稀盐酸和氢氧化钠溶液中的一种,请据图回答问题:
(1)甲溶液是 溶液,该反应的化学方程式为 。
(2)当加入乙溶液的体积为 mL时,甲、乙溶液恰好完全反应。
(3)当溶液的pH=1.4时,溶液中存在的微观粒子有 (指示剂除外)。
(4)为理解稀盐酸和氢氧化钠发生反应的微观实质,绘制了图Ⅲ,请你在圆圈中填入适当的化学用语。
创新拓展
10.(2021·福建中考·知识点3·题型2)欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。
【实验1】按如图Ⅰ所示装置进行实验。
Ⅰ
实验前U形管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U形管中的液面左高右低。据此,甲同学得出“CO2与NaOH发生了化学反应”的结论。
(1)U形管中液面高度发生变化的原因是
。
(2)上述结论的证据不充足,理由是
。
【实验2】按如图Ⅱ所示装置进行实验。
Ⅱ
查阅资料:a.CaCl2溶液呈中性;b.CaCl2+2NaOHCa(OH)2↓+2NaCl。
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(3)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是
。
(4)步骤④中,若观察到 (填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为
第7章应用广泛的酸、碱、盐
第2节常见的酸和碱
1.C 【解析】烧碱可吸收空气中的水分而潮解,也可与空气中的二氧化碳反应生成碳酸钠和水,因此烧碱放置在空气中质量增加且变质,A不合题意;浓硫酸可吸收空气中的水分,质量增大但不变质,B不合题意;浓盐酸可挥发出氯化氢气体,其质量减小但不变质,C合题意;生石灰可与空气中的水反应,生成氢氧化钙,氢氧化钙可与二氧化碳反应生成碳酸钙和水,其质量增大且变质,D不合题意。
2.D 【解析】铁与稀盐酸反应的化学方程式应为Fe+2HClFeCl2+H2↑,生成物不是FeCl3;熟石灰的化学式为Ca(OH)2,与盐酸反应的化学方程式应为Ca(OH)2+2HClCaCl2+2H2O;Cu的化学性质稳定,不与稀硫酸反应;D项的化学方程式正确。
3.B 【解析】氧化铁与稀盐酸、稀硫酸均能反应,生成盐和水;金属锌与稀盐酸、稀硫酸均能发生置换反应,生成盐和氢气;氢氧化铜与稀盐酸、稀硫酸均能发生中和反应,生成盐和水;氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和盐酸,与稀盐酸不反应。故表现了“酸的通性”的组合是①②③。
4.(1)盐 (2)Ca(OH)2+CO2CaCO3↓+H2O
(3)(NH4)2CO3+2NaOHNa2CO3+2H2O+2NH3↑
【解析】(1)碱能和酸碱指示剂、酸、某些非金属氧化物、盐反应,因此X的物质类别是盐。(2)根据性质①可知,可以用氢氧化钙溶液检验二氧化碳,是因为二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学反应方程式为Ca(OH)2+CO2CaCO3↓+H2O。(3)根据性质②可知,能体现碱的相似化学性质的是碱能和铵盐反应生成氨气等物质,氢氧化钠和碳酸铵反应生成碳酸钠、水和氨气,反应的化学方程式为(NH4)2CO3+2NaOHNa2CO3+2H2O+2NH3↑。
5.(1)CuSO4 (2)氯化钠溶液 (3)二氧化碳(或碳酸钠等)
【解析】(1)观察溶液颜色,C与另外四种溶液颜色不同,根据题干所给五种溶液的颜色可判断,C是硫酸铜溶液,溶质是CuSO4。(2)向其余四种溶液中分别滴加紫色石蕊试液,变红色的是稀盐酸,变蓝色的是氢氧化钠溶液、氢氧化钙溶液,显紫色的是氯化钠溶液。A能使紫色石蕊试液变红,A为稀盐酸,则D为氯化钠溶液。(3)二氧化碳能使氢氧化钙溶液变浑浊,与氢氧化钠溶液反应生成碳酸钠和水,但无明显现象;碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,与氢氧化钠溶液不反应。若要鉴别氢氧化钠溶液和氢氧化钙溶液,且加入物质X后可鉴别出E为Ca(OH)2溶液,则物质X可以为二氧化碳或碳酸钠等。
能力提升
6.D 【解析】C点时溶液的pH小于7,溶液显酸性,A错误;A点时溶液的pH大于7,溶液显碱性,说明氢氧化钾过量,所得溶液中的溶质为KOH和K2SO4,B错误;由图像可知,pH开始时大于7,逐渐减小到7,最后小于7,可知原溶液显碱性,然后不断加入酸性溶液,使pH减小,说明是把硫酸滴加到氢氧化钾溶液中,C错误;C点到D点的变化过程中,是完全反应后继续滴加硫酸,没有发生化学反应,D正确。
7.D 【解析】CO2能溶于水且能与水反应,导致CO2浓度降低,A正确;对比曲线①和②,说明CO2能与NaOH反应,同时说明氢氧化钠溶液吸收CO2的效果比水好,B、C正确;若选用等量饱和石灰水进行实验,其曲线在①下方,在②上方,这是因为氢氧化钙溶液吸收CO2的效果比水好,比氢氧化钠溶液差,D不正确。
8.(1)Zn+2AgNO3Zn(NO3)2+2Ag (2)Cu和Ag Zn
【解析】(1)根据“远距离先置换”原则,锌先与AgNO3反应,参加反应的AgNO3的质量大于反应生成的Zn(NO3)2的质量,溶液质量变小;AgNO3完全反应后,锌与Cu(NO3)2反应,参加反应的Cu(NO3)2的质量小于反应生成的Zn(NO3)2的质量,溶液质量变大。因此,导致溶液质量变小的是锌和AgNO3的反应。(2)若所得溶液中只含有一种溶质,则该溶质为Zn(NO3)2,说明AgNO3和Cu(NO3)2都反应完了,Zn可能恰好完全反应,也可能过量,所以反应后所得固体中一定含有Cu和Ag,可能含有Zn。
9.(1)NaOH HCl+NaOHNaCl+H2O (2)9 (3)H+、Cl-、Na+、H2O (4)
【解析】(1)起始溶液的pH大于7,故甲溶液是氢氧化钠溶液,氢氧化钠与稀盐酸反应生成氯化钠和水。(2)据题图可知,当加入的稀盐酸的体积为9 mL时,溶液的pH等于7,此时二者恰好完全反应。(3)氢氧化钠和稀盐酸反应生成氯化钠和水,pH=1.4时,稀盐酸过量,故溶液中的溶质是氯化氢和氯化钠,溶液中存在的微观粒子有H+、Cl-、Na+、H2O。(4)酸与碱反应的实质是酸中的氢离子和碱中的氢氧根离子结合生成水分子。
创新拓展
10.(1)试管内气体压强减小 (2)没有证明有新物质生成(或CO2溶于水,或与水反应也会造成试管内气压减小等,其他合理答案均可) (3)CaCl2与NaOH溶液反应也会产生沉淀[或CaCl2+2NaOHCa(OH)2↓+2NaCl等,其他合理答案均可] (4)A中有气泡冒出 CO2+2NaOHNa2CO3+H2O
【解析】(1)U形管中的液面左高右低,说明试管内的气压变小。(2)试管中气压减小的原因可能是CO2溶于水或与水发生了反应,也可能是氢氧化钠和二氧化碳发生了反应。(3)氯化钙和碳酸钠反应会生成碳酸钙沉淀,氯化钙和氢氧化钠反应会生成氢氧化钙沉淀,所以③中产生沉淀不能证明二氧化碳和氢氧化钠发生了反应。(4)步骤④中,二氧化碳与氢氧化钠发生反应生成碳酸钠,碳酸钠与盐酸反应会生成二氧化碳气体,所以若步骤④中观察到有气泡产生,则证明CO2与NaOH发生了反应。
第2节常见的酸和碱
基础过关
1.(2020·临沂中考·知识点1、3)下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )。
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
2.(2021·雅安月考·知识点2、3)下列反应的化学方程式书写正确的是( )。
A.铁和稀盐酸反应:2Fe+6HCl2FeCl3+3H2↑
B.熟石灰和盐酸反应:CaO+2HClCaCl2+H2O
C.洗去试管壁上附着的铜:Cu+H2SO4CuSO4+H2↑
D.氢氧化钠溶液与硫酸铜溶液混合:2NaOH+CuSO4Cu(OH)2↓+Na2SO4
3.(2020·杭州中考·知识点2)在①氧化铁、②金属锌、③氢氧化铜、④氯化钡溶液四种物质中,跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是( )。
A.①②③④ B.①②③
C.①③④ D.②③④
4.(知识点3·题型2)如图表示碱与不同类别物质之间的性质关系(“—”表示相连物质能发生反应,“→”表示两种物质间的转化关系,部分物质和反应条件已略去),请问答问题。
(1)X的物质类别: 。
(2)根据性质①写出检验CO2的化学反应方程式: 。
(3)根据性质②写出能体现碱的相似化学性质的化学方程式: 。
5.(2021·聊城中考·知识点2、3)已知A、B、C、D、E分别为稀盐酸、氢氧化钠溶液、氢氧化钙溶液、氯化钠溶液、硫酸铜溶液中的一种,为鉴别这五种溶液,化学兴趣小组的同学设计绘制的思维导图如图所示:
(1)C中的溶质为 (填化学式)。
(2)若A能使紫色石蕊试液变红,则D为 (填物质名称)。
(3)为鉴别B和E,加入的物质X为 (写出一种即可)。
能力提升
6.(2021·滨州中考·知识点5·题型3)某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )。
A.图中C点所示溶液呈碱性
B.图中A点所示溶液中含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入盛有硫酸的烧杯中
D.由C点到D点的变化过程中没有发生化学反应
7.(2021·莆田模拟·知识点3·题型2)实验小组用传感器研究等量水或NaOH溶液分别吸收CO2的效果,实验装置及测定结果如图所示。下列说法不正确的是( )。
A.曲线①是CO2溶解和CO2与水反应的综合结果
B.对比曲线①和②,可说明CO2能与NaOH反应
C.NaOH溶液吸收CO2的效果比水好
D.若选用等量饱和石灰水进行实验,其曲线在①上方
8.(2021·濮阳模拟·知识点2·题型1)将锌粉加入一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)写出会导致溶液质量变小的有关反应的化学方程式: 。
(2)若所得溶液中只含有一种溶质,则所得固体中一定含有 ,可能含有 。
9.(2021·泰州模拟·知识点5·题型3)图Ⅰ表示的是向盛有10 mL甲溶液(其中含有少量酚酞试液)的烧杯中加入乙溶液的过程,图Ⅱ表示加入乙溶液的过程中溶液pH的变化。已知甲、乙溶液分别是稀盐酸和氢氧化钠溶液中的一种,请据图回答问题:
(1)甲溶液是 溶液,该反应的化学方程式为 。
(2)当加入乙溶液的体积为 mL时,甲、乙溶液恰好完全反应。
(3)当溶液的pH=1.4时,溶液中存在的微观粒子有 (指示剂除外)。
(4)为理解稀盐酸和氢氧化钠发生反应的微观实质,绘制了图Ⅲ,请你在圆圈中填入适当的化学用语。
创新拓展
10.(2021·福建中考·知识点3·题型2)欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。
【实验1】按如图Ⅰ所示装置进行实验。
Ⅰ
实验前U形管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U形管中的液面左高右低。据此,甲同学得出“CO2与NaOH发生了化学反应”的结论。
(1)U形管中液面高度发生变化的原因是
。
(2)上述结论的证据不充足,理由是
。
【实验2】按如图Ⅱ所示装置进行实验。
Ⅱ
查阅资料:a.CaCl2溶液呈中性;b.CaCl2+2NaOHCa(OH)2↓+2NaCl。
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(3)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是
。
(4)步骤④中,若观察到 (填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为
第7章应用广泛的酸、碱、盐
第2节常见的酸和碱
1.C 【解析】烧碱可吸收空气中的水分而潮解,也可与空气中的二氧化碳反应生成碳酸钠和水,因此烧碱放置在空气中质量增加且变质,A不合题意;浓硫酸可吸收空气中的水分,质量增大但不变质,B不合题意;浓盐酸可挥发出氯化氢气体,其质量减小但不变质,C合题意;生石灰可与空气中的水反应,生成氢氧化钙,氢氧化钙可与二氧化碳反应生成碳酸钙和水,其质量增大且变质,D不合题意。
2.D 【解析】铁与稀盐酸反应的化学方程式应为Fe+2HClFeCl2+H2↑,生成物不是FeCl3;熟石灰的化学式为Ca(OH)2,与盐酸反应的化学方程式应为Ca(OH)2+2HClCaCl2+2H2O;Cu的化学性质稳定,不与稀硫酸反应;D项的化学方程式正确。
3.B 【解析】氧化铁与稀盐酸、稀硫酸均能反应,生成盐和水;金属锌与稀盐酸、稀硫酸均能发生置换反应,生成盐和氢气;氢氧化铜与稀盐酸、稀硫酸均能发生中和反应,生成盐和水;氯化钡溶液与稀硫酸反应生成硫酸钡沉淀和盐酸,与稀盐酸不反应。故表现了“酸的通性”的组合是①②③。
4.(1)盐 (2)Ca(OH)2+CO2CaCO3↓+H2O
(3)(NH4)2CO3+2NaOHNa2CO3+2H2O+2NH3↑
【解析】(1)碱能和酸碱指示剂、酸、某些非金属氧化物、盐反应,因此X的物质类别是盐。(2)根据性质①可知,可以用氢氧化钙溶液检验二氧化碳,是因为二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学反应方程式为Ca(OH)2+CO2CaCO3↓+H2O。(3)根据性质②可知,能体现碱的相似化学性质的是碱能和铵盐反应生成氨气等物质,氢氧化钠和碳酸铵反应生成碳酸钠、水和氨气,反应的化学方程式为(NH4)2CO3+2NaOHNa2CO3+2H2O+2NH3↑。
5.(1)CuSO4 (2)氯化钠溶液 (3)二氧化碳(或碳酸钠等)
【解析】(1)观察溶液颜色,C与另外四种溶液颜色不同,根据题干所给五种溶液的颜色可判断,C是硫酸铜溶液,溶质是CuSO4。(2)向其余四种溶液中分别滴加紫色石蕊试液,变红色的是稀盐酸,变蓝色的是氢氧化钠溶液、氢氧化钙溶液,显紫色的是氯化钠溶液。A能使紫色石蕊试液变红,A为稀盐酸,则D为氯化钠溶液。(3)二氧化碳能使氢氧化钙溶液变浑浊,与氢氧化钠溶液反应生成碳酸钠和水,但无明显现象;碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,与氢氧化钠溶液不反应。若要鉴别氢氧化钠溶液和氢氧化钙溶液,且加入物质X后可鉴别出E为Ca(OH)2溶液,则物质X可以为二氧化碳或碳酸钠等。
能力提升
6.D 【解析】C点时溶液的pH小于7,溶液显酸性,A错误;A点时溶液的pH大于7,溶液显碱性,说明氢氧化钾过量,所得溶液中的溶质为KOH和K2SO4,B错误;由图像可知,pH开始时大于7,逐渐减小到7,最后小于7,可知原溶液显碱性,然后不断加入酸性溶液,使pH减小,说明是把硫酸滴加到氢氧化钾溶液中,C错误;C点到D点的变化过程中,是完全反应后继续滴加硫酸,没有发生化学反应,D正确。
7.D 【解析】CO2能溶于水且能与水反应,导致CO2浓度降低,A正确;对比曲线①和②,说明CO2能与NaOH反应,同时说明氢氧化钠溶液吸收CO2的效果比水好,B、C正确;若选用等量饱和石灰水进行实验,其曲线在①下方,在②上方,这是因为氢氧化钙溶液吸收CO2的效果比水好,比氢氧化钠溶液差,D不正确。
8.(1)Zn+2AgNO3Zn(NO3)2+2Ag (2)Cu和Ag Zn
【解析】(1)根据“远距离先置换”原则,锌先与AgNO3反应,参加反应的AgNO3的质量大于反应生成的Zn(NO3)2的质量,溶液质量变小;AgNO3完全反应后,锌与Cu(NO3)2反应,参加反应的Cu(NO3)2的质量小于反应生成的Zn(NO3)2的质量,溶液质量变大。因此,导致溶液质量变小的是锌和AgNO3的反应。(2)若所得溶液中只含有一种溶质,则该溶质为Zn(NO3)2,说明AgNO3和Cu(NO3)2都反应完了,Zn可能恰好完全反应,也可能过量,所以反应后所得固体中一定含有Cu和Ag,可能含有Zn。
9.(1)NaOH HCl+NaOHNaCl+H2O (2)9 (3)H+、Cl-、Na+、H2O (4)
【解析】(1)起始溶液的pH大于7,故甲溶液是氢氧化钠溶液,氢氧化钠与稀盐酸反应生成氯化钠和水。(2)据题图可知,当加入的稀盐酸的体积为9 mL时,溶液的pH等于7,此时二者恰好完全反应。(3)氢氧化钠和稀盐酸反应生成氯化钠和水,pH=1.4时,稀盐酸过量,故溶液中的溶质是氯化氢和氯化钠,溶液中存在的微观粒子有H+、Cl-、Na+、H2O。(4)酸与碱反应的实质是酸中的氢离子和碱中的氢氧根离子结合生成水分子。
创新拓展
10.(1)试管内气体压强减小 (2)没有证明有新物质生成(或CO2溶于水,或与水反应也会造成试管内气压减小等,其他合理答案均可) (3)CaCl2与NaOH溶液反应也会产生沉淀[或CaCl2+2NaOHCa(OH)2↓+2NaCl等,其他合理答案均可] (4)A中有气泡冒出 CO2+2NaOHNa2CO3+H2O
【解析】(1)U形管中的液面左高右低,说明试管内的气压变小。(2)试管中气压减小的原因可能是CO2溶于水或与水发生了反应,也可能是氢氧化钠和二氧化碳发生了反应。(3)氯化钙和碳酸钠反应会生成碳酸钙沉淀,氯化钙和氢氧化钠反应会生成氢氧化钙沉淀,所以③中产生沉淀不能证明二氧化碳和氢氧化钠发生了反应。(4)步骤④中,二氧化碳与氢氧化钠发生反应生成碳酸钠,碳酸钠与盐酸反应会生成二氧化碳气体,所以若步骤④中观察到有气泡产生,则证明CO2与NaOH发生了反应。
