3.3化学方程式 计算练习(含答案)
文档属性
| 名称 | 3.3化学方程式 计算练习(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 127.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-03-11 00:00:00 | ||
图片预览



文档简介
3.3化学方程式
一、选择题
1.“84 消毒液”可用于新冠状病毒肺炎的防疫,制备其主要成分次氯酸钠(NaClO)的化学方程式为:2NaOH+Cl2=NaClO+NaCl+X。则 X 的化学式是( )
A.ClO2 B.H2 C.H2O D.Na2O
2.在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断不正确的是( )
物质 甲 乙 丙 丁
反应前质量(g) 10 16 0 0
反应中质量(g) 1.6
反应后质量(g) 0 15.2 6.4
A.的值是4.4
B.的值是4
C.甲和乙是反应物
D.甲、丁间反应的质量比为7:8
3.由质量守恒定律可知,下列各项:①分子种类;②原子种类;③分子数目;④原子数目;⑤元素种类;⑥原子质量。在化学反应前后一定不变的是( )
A.①③⑤ B.②④⑥ C.②④⑤⑥ D.③④⑤⑥
4.如图所示是磷与氧气反应前后的微观模型图(表示磷原子,表示氧原子),根据质量守恒定律,则虚线框中的微观模型应该是( )
A. B. C. D.
5.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法正确的是( )
A.x的值是19 B.丙一定是该反应的催化剂
C.该反应是分解反应 D.参加反应的甲和乙质量比为12:19
6.小金做单质金属与氧气反应的实验,根据实验结果得到了如图所示镁、铜与其氧化物的质量关系。图线不重合的原因是
A.镁和铜的密度不同
B.实验的误差造成
C.加热不充分,没有完全氧化
D.与等质量的镁和铜化合的氧质量不同
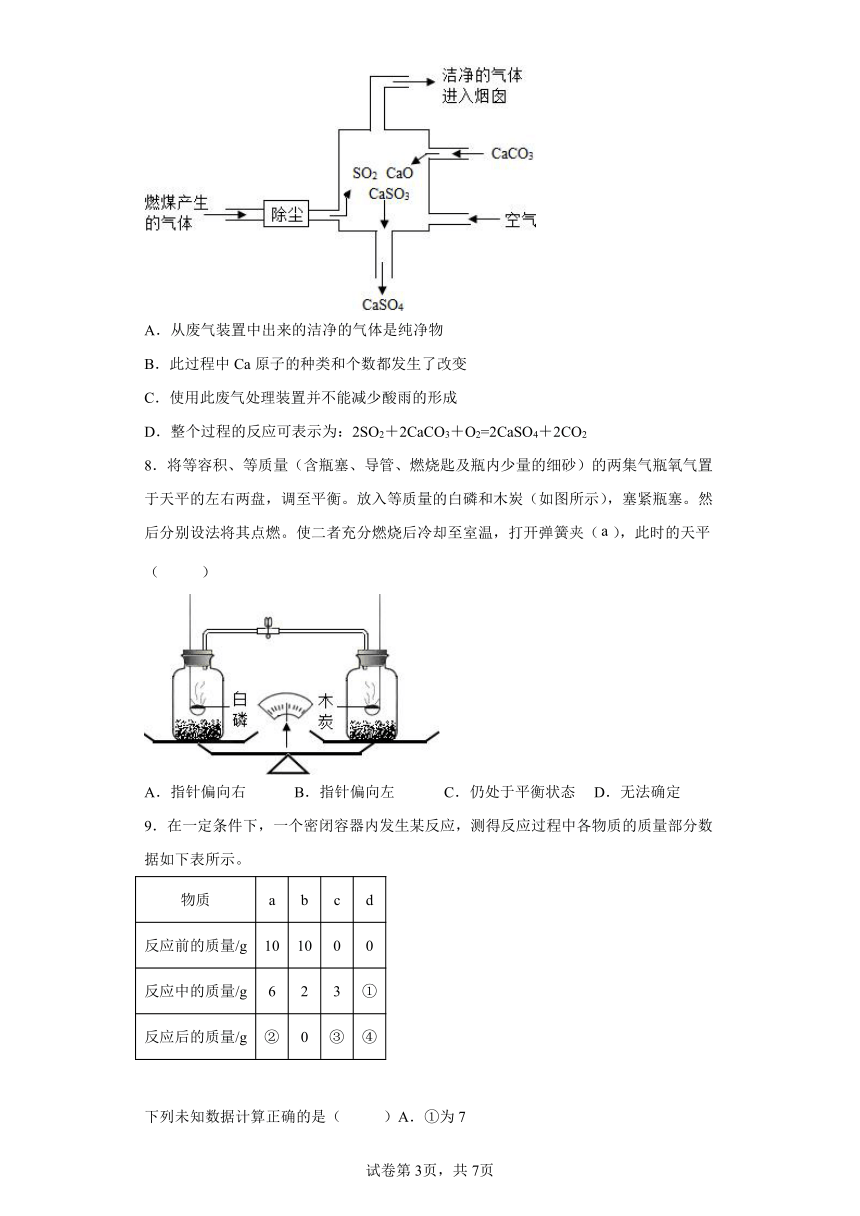
7.如图是某燃煤发电厂处理废气的装置示意图。下列说法正确的是( )
A.从废气装置中出来的洁净的气体是纯净物
B.此过程中Ca原子的种类和个数都发生了改变
C.使用此废气处理装置并不能减少酸雨的形成
D.整个过程的反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2
8.将等容积、等质量(含瓶塞、导管、燃烧匙及瓶内少量的细砂)的两集气瓶氧气置于天平的左右两盘,调至平衡。放入等质量的白磷和木炭(如图所示),塞紧瓶塞。然后分别设法将其点燃。使二者充分燃烧后冷却至室温,打开弹簧夹(),此时的天平( )
A.指针偏向右 B.指针偏向左 C.仍处于平衡状态 D.无法确定
9.在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示。
物质 a b c d
反应前的质量/g 10 10 0 0
反应中的质量/g 6 2 3 ①
反应后的质量/g ② 0 ③ ④
下列未知数据计算正确的是( )A.①为7
B.②为6
C.③为3.75
D.④为16.25
10.将一个干冷的烧杯罩在打火机火焰的上方,烧杯内壁上出现细小的水珠;将烧杯迅速倒转过来,倒入少量澄清石灰水,振荡,石灰水变浑浊。由此可推断打火机液体中( )
A.一定含有碳、氢两种元素,可能含有氧元素 B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢两种元素,肯定没有氧元素 D.无法判断
11.将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 乙醇 氧气 水 二氧化碳 X
反应前质量/g 4.6 8.0 0 0 0
反应后质量/g 0 0 5.4 4.4 A
下列判断正确的是( )A.表中A的值为2.6
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是9.6g,则无X生成
12.下列化学方程式的书写正确的是( )
A.氧化汞加热分解:
B.碳在氧气中燃烧:
C.铝片投入稀硫酸中生成硫酸铝和氢气:
D.铁在氧气中燃烧:
13.一颗陨石在俄罗斯中部乌拉尔山区的车里雅宾斯克市坠落,陨石进入大气层时速度达到了40倍音速,而落地前的飞行速度减小到了30公里/时,由此引发的“陨石雨”导致超过1200名当地居民受伤。如图为陨石样品中,各种元素含量的比例图,此样品中不可能含有的化合物是( )
A.碳酸钙 B.硫酸钾 C.二氧化硅 D.氧化铝
14.在一密闭容器中有A、B、C三种物质,A是一种氧化物。加热充分反应后,各物质质量变化如表所示。关于此反应的认识正确的是( )
物质 A B C D
反应前的质量/g 1.4 7 31.6 0
反应后的质量/g 待测 26.7 0 3.2
A.反应后待测A的质量为8.7g
B.D可能是单质,C一定是化合物
C.组成物质C的元素种类一定比物质B多
D.反应过程中C剩余15.8g时,容器中B的质量为13.35g
15.中美贸易战加剧,我国通信设备制造商中兴公司遭美国封杀.华为公司最新芯片麒麟980处理器的应用,摆脱了对美国产品的依赖.芯片主要以高纯度的单质硅()为原料制成,在半导体硅元件生产中,常用氢氟酸()来清除硅表面的氧化膜,反应原理可表示为已知硅元素显价.下列说法错误的是( )
A.生成物的化学式是
B.中氟元素显价
C.二氧化硅由一个硅原子和两个氧原子构成
D.地壳中硅元素含量仅次于氧元素
16.日本福岛核电站发生事故以来,目前在我国各地监测出的人工放射性物质碘—131(碘元素符号:I)的数值水平极其微小,不会对人体造成任何影响。碘—131能与水发生化学反应,生成两种化合物,其反应的微观模拟如图。下列说法不正确的是( )
A.图中能表示碘分子的是 B.该反应中共涉及一种单质和三种化合物
C.反应前后,原子的种类、数目不变 D.该反应中反应物分子个数比为2:1
17.如图是一种工业制备氢气的微观示意图,下列说法正确的是( )
A.反应前后,分子和原子的种类都没有发生改变
B.参加反应的两种反应物的分子个数比为1:1
C.反应后碳元素的化合价降低了
D.反应后的产物中没有单质
18.物质M在4.8g氧气中恰好完全燃烧,反应方程式为M+3O2=RO2+2SO2,测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )
A.参加反应的M的质量为4.3g
B.M的相对分子质量为76
C.M中含有R元素、S元素和O元素
D.产物为气态时都是空气污染物
二、简答题
19.某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如图所示。
(1)剩余混合物中二氧化锰的质量为______g,反应生成氧气的质量为______g.
(2)计算该过氧化氢溶液中溶质的质量分数_______。
三、探究题
20.由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题,某化学研究小组的同学对某种塑料袋的组成进行分析研究,现已知该塑料的化学式为,他们设计了如图所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
(1)实验装置中有一处明显错误,请写出改正方法:_____。
(2)装置F的作用是_____。
(3)若装置C的玻璃管中放入的塑料试样质量为5.2g,塑料试样充分燃烧后,装置D增重3.6g,则该塑料试样中含氢元素的质量为_____g。请计算出塑料的化学式_____,写出装置C的玻璃管中反应的化学方程式_____。
(4)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果_____(选填“偏小”“偏大”或“无影响”) 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.C
4.D
5.D
6.D
7.D
8.B
9.C
10.A
11.D
12.D
13.A
14.B
15.C
16.D
17.B
18.B
19. 1.0 1.6 解:设参加反应的过氧化氢的质量为x
=
x=3.4g
该过氧化氢溶液中溶质的质量分数=×100%=5%
答:该过氧化氢溶液中溶质的质量分数为5%。
20. 装置B中前面导气管应插入液面下,后面导气管应刚好透过瓶塞 防止空气中二氧化碳进入对实验有干扰 0.4 偏大
答案第1页,共2页
答案第1页,共2页
一、选择题
1.“84 消毒液”可用于新冠状病毒肺炎的防疫,制备其主要成分次氯酸钠(NaClO)的化学方程式为:2NaOH+Cl2=NaClO+NaCl+X。则 X 的化学式是( )
A.ClO2 B.H2 C.H2O D.Na2O
2.在一密闭容器中发生某反应,其中甲、乙、丙、丁四种物质的质量变化如表所示,下列判断不正确的是( )
物质 甲 乙 丙 丁
反应前质量(g) 10 16 0 0
反应中质量(g) 1.6
反应后质量(g) 0 15.2 6.4
A.的值是4.4
B.的值是4
C.甲和乙是反应物
D.甲、丁间反应的质量比为7:8
3.由质量守恒定律可知,下列各项:①分子种类;②原子种类;③分子数目;④原子数目;⑤元素种类;⑥原子质量。在化学反应前后一定不变的是( )
A.①③⑤ B.②④⑥ C.②④⑤⑥ D.③④⑤⑥
4.如图所示是磷与氧气反应前后的微观模型图(表示磷原子,表示氧原子),根据质量守恒定律,则虚线框中的微观模型应该是( )
A. B. C. D.
5.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法正确的是( )
A.x的值是19 B.丙一定是该反应的催化剂
C.该反应是分解反应 D.参加反应的甲和乙质量比为12:19
6.小金做单质金属与氧气反应的实验,根据实验结果得到了如图所示镁、铜与其氧化物的质量关系。图线不重合的原因是
A.镁和铜的密度不同
B.实验的误差造成
C.加热不充分,没有完全氧化
D.与等质量的镁和铜化合的氧质量不同
7.如图是某燃煤发电厂处理废气的装置示意图。下列说法正确的是( )
A.从废气装置中出来的洁净的气体是纯净物
B.此过程中Ca原子的种类和个数都发生了改变
C.使用此废气处理装置并不能减少酸雨的形成
D.整个过程的反应可表示为:2SO2+2CaCO3+O2=2CaSO4+2CO2
8.将等容积、等质量(含瓶塞、导管、燃烧匙及瓶内少量的细砂)的两集气瓶氧气置于天平的左右两盘,调至平衡。放入等质量的白磷和木炭(如图所示),塞紧瓶塞。然后分别设法将其点燃。使二者充分燃烧后冷却至室温,打开弹簧夹(),此时的天平( )
A.指针偏向右 B.指针偏向左 C.仍处于平衡状态 D.无法确定
9.在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示。
物质 a b c d
反应前的质量/g 10 10 0 0
反应中的质量/g 6 2 3 ①
反应后的质量/g ② 0 ③ ④
下列未知数据计算正确的是( )A.①为7
B.②为6
C.③为3.75
D.④为16.25
10.将一个干冷的烧杯罩在打火机火焰的上方,烧杯内壁上出现细小的水珠;将烧杯迅速倒转过来,倒入少量澄清石灰水,振荡,石灰水变浑浊。由此可推断打火机液体中( )
A.一定含有碳、氢两种元素,可能含有氧元素 B.一定含有碳、氢、氧三种元素
C.一定含有碳、氢两种元素,肯定没有氧元素 D.无法判断
11.将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
物质 乙醇 氧气 水 二氧化碳 X
反应前质量/g 4.6 8.0 0 0 0
反应后质量/g 0 0 5.4 4.4 A
下列判断正确的是( )A.表中A的值为2.6
B.X一定是该反应的催化剂
C.X可能含有氢元素
D.若起始时氧气的质量是9.6g,则无X生成
12.下列化学方程式的书写正确的是( )
A.氧化汞加热分解:
B.碳在氧气中燃烧:
C.铝片投入稀硫酸中生成硫酸铝和氢气:
D.铁在氧气中燃烧:
13.一颗陨石在俄罗斯中部乌拉尔山区的车里雅宾斯克市坠落,陨石进入大气层时速度达到了40倍音速,而落地前的飞行速度减小到了30公里/时,由此引发的“陨石雨”导致超过1200名当地居民受伤。如图为陨石样品中,各种元素含量的比例图,此样品中不可能含有的化合物是( )
A.碳酸钙 B.硫酸钾 C.二氧化硅 D.氧化铝
14.在一密闭容器中有A、B、C三种物质,A是一种氧化物。加热充分反应后,各物质质量变化如表所示。关于此反应的认识正确的是( )
物质 A B C D
反应前的质量/g 1.4 7 31.6 0
反应后的质量/g 待测 26.7 0 3.2
A.反应后待测A的质量为8.7g
B.D可能是单质,C一定是化合物
C.组成物质C的元素种类一定比物质B多
D.反应过程中C剩余15.8g时,容器中B的质量为13.35g
15.中美贸易战加剧,我国通信设备制造商中兴公司遭美国封杀.华为公司最新芯片麒麟980处理器的应用,摆脱了对美国产品的依赖.芯片主要以高纯度的单质硅()为原料制成,在半导体硅元件生产中,常用氢氟酸()来清除硅表面的氧化膜,反应原理可表示为已知硅元素显价.下列说法错误的是( )
A.生成物的化学式是
B.中氟元素显价
C.二氧化硅由一个硅原子和两个氧原子构成
D.地壳中硅元素含量仅次于氧元素
16.日本福岛核电站发生事故以来,目前在我国各地监测出的人工放射性物质碘—131(碘元素符号:I)的数值水平极其微小,不会对人体造成任何影响。碘—131能与水发生化学反应,生成两种化合物,其反应的微观模拟如图。下列说法不正确的是( )
A.图中能表示碘分子的是 B.该反应中共涉及一种单质和三种化合物
C.反应前后,原子的种类、数目不变 D.该反应中反应物分子个数比为2:1
17.如图是一种工业制备氢气的微观示意图,下列说法正确的是( )
A.反应前后,分子和原子的种类都没有发生改变
B.参加反应的两种反应物的分子个数比为1:1
C.反应后碳元素的化合价降低了
D.反应后的产物中没有单质
18.物质M在4.8g氧气中恰好完全燃烧,反应方程式为M+3O2=RO2+2SO2,测得RO2和SO2的质量分别为2.2g和6.4g,下列判断中正确的是( )
A.参加反应的M的质量为4.3g
B.M的相对分子质量为76
C.M中含有R元素、S元素和O元素
D.产物为气态时都是空气污染物
二、简答题
19.某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如图所示。
(1)剩余混合物中二氧化锰的质量为______g,反应生成氧气的质量为______g.
(2)计算该过氧化氢溶液中溶质的质量分数_______。
三、探究题
20.由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题,某化学研究小组的同学对某种塑料袋的组成进行分析研究,现已知该塑料的化学式为,他们设计了如图所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
(1)实验装置中有一处明显错误,请写出改正方法:_____。
(2)装置F的作用是_____。
(3)若装置C的玻璃管中放入的塑料试样质量为5.2g,塑料试样充分燃烧后,装置D增重3.6g,则该塑料试样中含氢元素的质量为_____g。请计算出塑料的化学式_____,写出装置C的玻璃管中反应的化学方程式_____。
(4)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果_____(选填“偏小”“偏大”或“无影响”) 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.C
4.D
5.D
6.D
7.D
8.B
9.C
10.A
11.D
12.D
13.A
14.B
15.C
16.D
17.B
18.B
19. 1.0 1.6 解:设参加反应的过氧化氢的质量为x
=
x=3.4g
该过氧化氢溶液中溶质的质量分数=×100%=5%
答:该过氧化氢溶液中溶质的质量分数为5%。
20. 装置B中前面导气管应插入液面下,后面导气管应刚好透过瓶塞 防止空气中二氧化碳进入对实验有干扰 0.4 偏大
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
