7.1溶液的酸碱性 同步测试——2021-2022学年沪教版九年级下册(word版 含答案)
文档属性
| 名称 | 7.1溶液的酸碱性 同步测试——2021-2022学年沪教版九年级下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 188.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-20 00:00:00 | ||
图片预览



文档简介
7.1 溶液的酸碱性
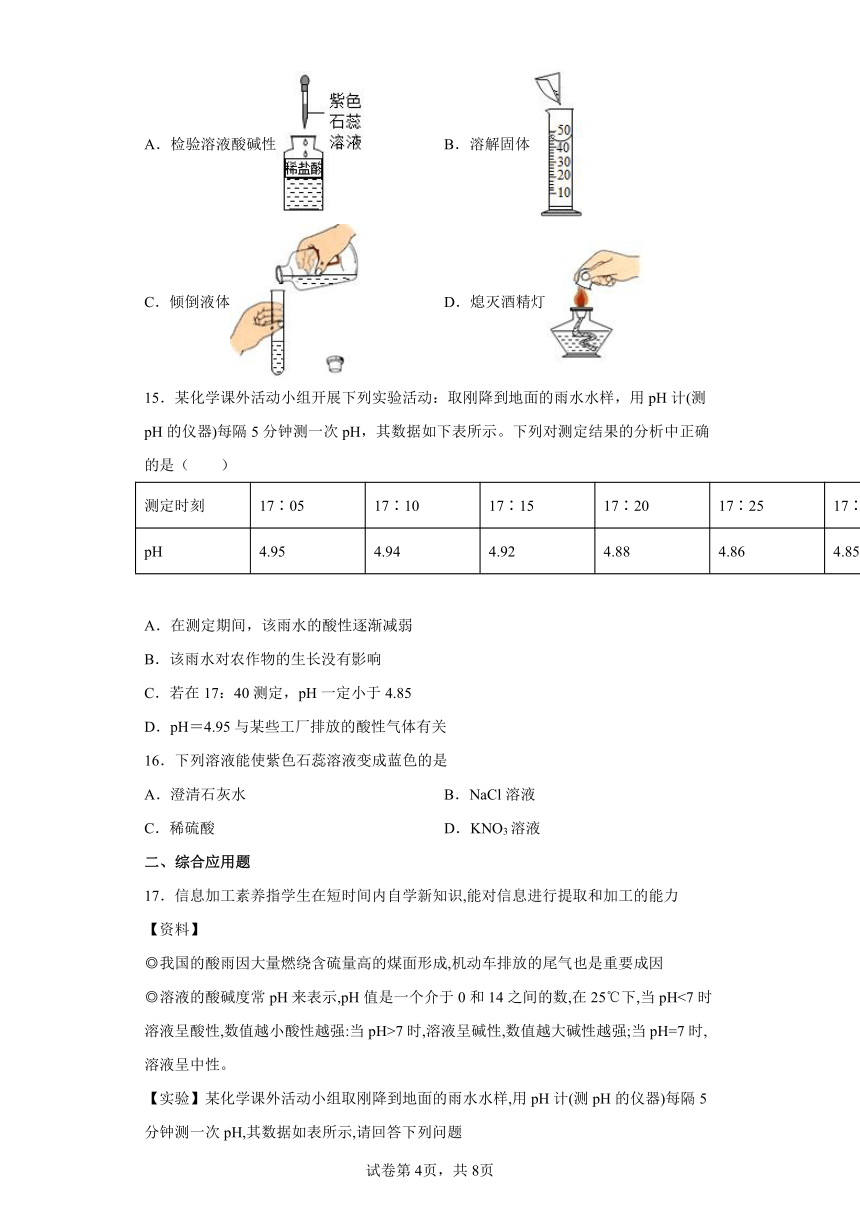
一、单选题
1.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.碱性溶液能使酚酞溶液变红色,能使酚酞溶液变红色的溶液一定显碱性
B.离子是带电的微粒,带电的微粒一定是离子
C.氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物
D.置换反应的生成物是一种单质和一种化合物,生成一种单质和一种化合物的反应一定是置换反应
2.如图,向点滴板①~④滴孔中分别滴入指示剂后,①②③④滴孔内溶液显示的颜色依次是( )
A.无色、红色、蓝色、红色 B.红色、蓝色、黄色、紫色
C.蓝色、红色、紫色、无色 D.无色、蓝色、红色、蓝色
3.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
4.下列实验方案中,两个方案均可行的是
实验目的 实验方案一 实验方案二
A 鉴别硬水和软水 取样,分别加入等质量的活性炭,静置,观察| 取样,分别加入等质量的肥皂水,搅拌,观察产生泡沫的情况
B 分离木炭粉和铁粉的混合物 用磁铁吸引| 在空气中充分加热
C 除去CO气体中的|少量CO2 将混合气体依次通过足量的氢氧化钠溶液和浓硫酸 将混合气体通过足量的的热CuO粉末
D 鉴别NaCl和NaOH两种固体| 取样,分别加水溶解,触摸试管外壁 取样,分别加水溶解,配成溶液,用pH试纸测定
A.A B.B C.C D.D
5.“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
6.pH是水质监测的重要指标之一,下列水样酸性最强的是
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
7.往KOH溶液中加水,溶液的pH变化正确的是( )
A. B.
C. D.
8.下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是
A.稀盐酸 B.二氧化碳 C.碳酸钙 D.石蕊溶液
9.小明为验证“分子是运动的”,设计了四个实验。其中不能达到目的的是( )
A. B. C. D.
10.下列叙述中,正确的是( )
A.盐酸遇石蕊溶液就可以变红
B.酚酞溶液可以使稀硫酸变红
C.用石蕊溶液可以鉴别稀盐酸和稀硫酸
D.用酚酞溶液可以鉴别稀硫酸和氢氧化钠溶液
11.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.溶液中滴入石蕊仍为紫色
B.溶液中滴入酚酞显红色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞不显色
12.一些物质的pH范围如下,其中呈碱性的是
A.柠檬汁(2~3)
B.橘子汁(3~4)
C.西瓜汁(5~6)
D.牙膏(8~9)
13.下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
14.进行化学实验操作考核时,下列四位同学的操作中正确的是
A.检验溶液酸碱性 B.溶解固体
C.倾倒液体 D.熄灭酒精灯
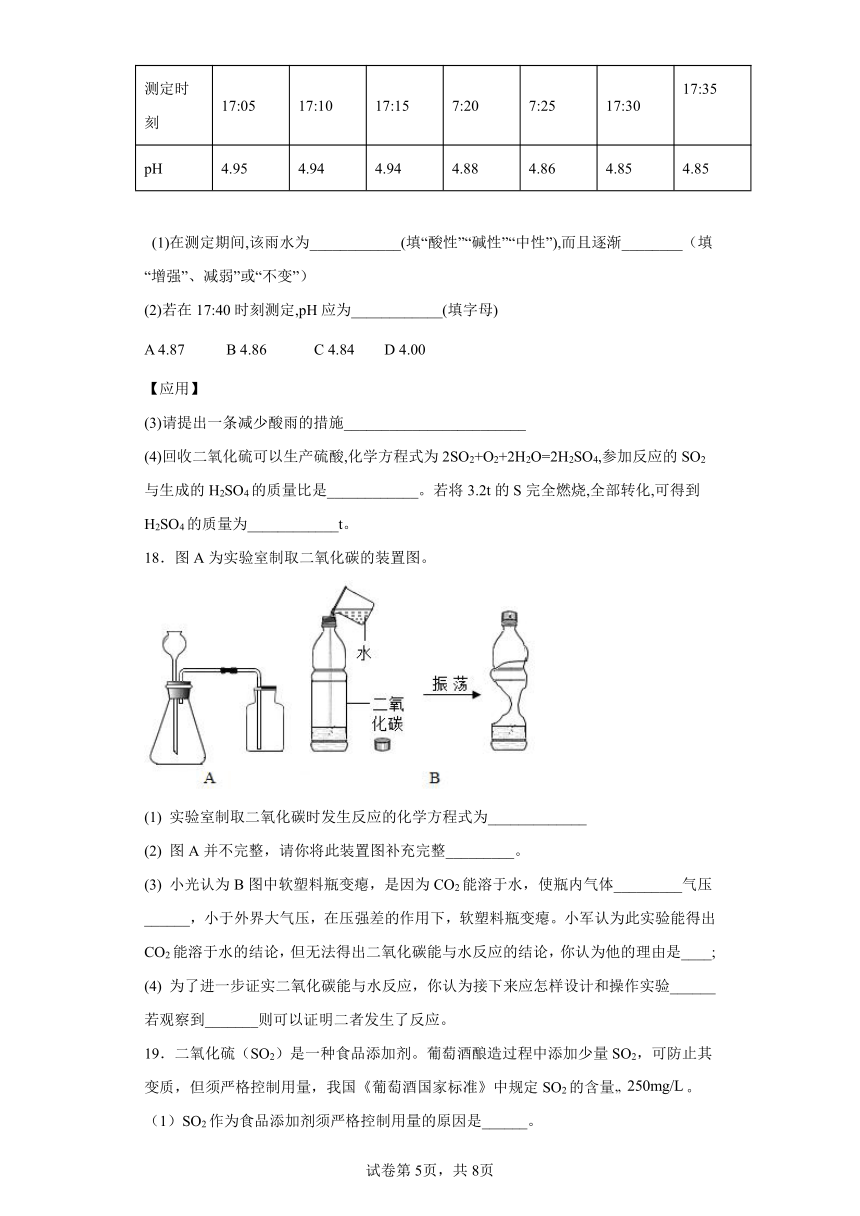
15.某化学课外活动小组开展下列实验活动:取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如下表所示。下列对测定结果的分析中正确的是( )
测定时刻 17∶05 17∶10 17∶15 17∶20 17∶25 17∶30 17∶35
pH 4.95 4.94 4.92 4.88 4.86 4.85 4.85
A.在测定期间,该雨水的酸性逐渐减弱
B.该雨水对农作物的生长没有影响
C.若在17:40测定,pH一定小于4.85
D.pH=4.95与某些工厂排放的酸性气体有关
16.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
二、综合应用题
17.信息加工素养指学生在短时间内自学新知识,能对信息进行提取和加工的能力
【资料】
◎我国的酸雨因大量燃绕含硫量高的煤面形成,机动车排放的尾气也是重要成因
◎溶液的酸碱度常pH来表示,pH值是一个介于0和14之间的数,在25℃下,当pH<7时溶液呈酸性,数值越小酸性越强:当pH>7时,溶液呈碱性,数值越大碱性越强;当pH=7时,溶液呈中性。
【实验】某化学课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如表所示,请回答下列问题
测定时刻 17:05 17:10 17:15 7:20 7:25 17:30 17:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
(1)在测定期间,该雨水为____________(填“酸性”“碱性”“中性”),而且逐渐________(填“增强”、减弱”或“不变”)
(2)若在17:40时刻测定,pH应为____________(填字母)
A 4.87 B 4.86 C 4.84 D 4.00
【应用】
(3)请提出一条减少酸雨的措施________________________
(4)回收二氧化硫可以生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4,参加反应的SO2与生成的H2SO4的质量比是____________。若将3.2t的S完全燃烧,全部转化,可得到H2SO4的质量为____________t。
18.图A为实验室制取二氧化碳的装置图。
(1) 实验室制取二氧化碳时发生反应的化学方程式为_____________
(2) 图A并不完整,请你将此装置图补充完整_________。
(3) 小光认为B图中软塑料瓶变瘪,是因为CO2能溶于水,使瓶内气体_________气压______,小于外界大气压,在压强差的作用下,软塑料瓶变瘪。小军认为此实验能得出CO2能溶于水的结论,但无法得出二氧化碳能与水反应的结论,你认为他的理由是____;
(4) 为了进一步证实二氧化碳能与水反应,你认为接下来应怎样设计和操作实验______若观察到_______则可以证明二者发生了反应。
19.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
20.水是生命之源,万物之基,是人类最宝贵的自然资源。唤起人们保护水资源、节约用水的意识是十分有必要的。
(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面达标后方可成为生活饮用水。各种指标的主要要求为a. 不得呈现异色,b. 不得有异味,c. 水应澄清透明,d. 不得含有细菌的病毒。
①前两个指标可以利用_____(填物质名称)的吸附作用而达到。
②某山区自来水厂生产自来水的过程如图(1)所示。由图(1)可知净化水时,c,d两个指标可通过图中的B,C,_____过程而达到。
③化学指标中含有液体的pH和硬度两项,则a. 测定液体的pH用_____。
b. 日常生活中如何区分硬水与软水?请简述实验步骤与现象:_____。
(2)许多化学实验中都用到水,请指出图(2)所示实验中水的作用。
甲:_____;乙:_____;丙:_____;丁:_____;戊:_____。
(3)水既普通又宝贵,请你用化学方程式归纳水具有的重要的化学性质(举任意三例)。
①_____;②_____;③_____。
(4)图(3)是理想的氢元素循环示意图,下列说法不正确的是( )
A 水的分解反应需要吸收能量
B 燃料电池将氢能转化为电能
C 制取氢能比较理想的方法是在阳光照射条件下用催化剂来分解水
D 理想的氢元素循环可以通过物理变化来实现
(5)某次奥运会上火炬使用的燃料是丙烷(C3H6)而不是氢气,其原因可能是( )。
A 人类目前还无法制取氢气
B 氢气燃烧后的产物会污染环境
C 氢气燃烧时火焰呈淡蓝色,不易观察到明显的现象
D 氢气燃烧时一定会发生爆炸
21.在实验室里,可用如图装置进行CO还原Fe2O3的实验,并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有CO2和H2O。
(1)写出装置C处尾气处理的方法______(写一种即可);A装置中有关反应的化学方程式______。(写出一个即可)
(2)检验CO还原Fe2O3反应的气体生成物的现象是什么?______。
(3)实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因______。
(4)某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
22.某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____;剩余固体A的成分是_____。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.C
4.D
5.D
6.A
7.C
8.D
9.B
10.D
11.B
12.D
13.C
14.D
15.D
16.A
17. 酸性 增强 C 硫酸厂产生的尾气处理后再排放,煤燃烧前先脱硫 32:49 4.9
18. CaCO3+2HC====CaCl2+CO2↑+H20 补固体、液体、液面、气泡、玻璃片 减少 变小 由实验现象不能证明有新物质(H2CO3)生成(或CO2溶于水也会观察到相同的实验现象,因此不能证明一定有新物质生成等)(合理即可) 向变瘪的塑料瓶里滴加紫色石蕊溶液 溶液由紫色变红色(合理即可)
19. SO2有一定的毒性 紫 20 是
20. 活性炭 D pH试纸(或pH计) 在水中加入肥皂水,搅拌,如泡沫较少(或没有)、浮渍较多则为硬水,否则为软水 水是溶剂 水将集气瓶内的空气排净,便于观察氢气何时收集满 吸收生成二氧化硫 防止溅落的熔化物炸裂瓶底 提供热量,隔绝氧气 D C
21.(1) 加一个燃着的酒精灯或绑一个气球 或 或
(2)C处澄清石灰水变浑浊
(3)氢氧化钠、氢氧化钙、碳酸钠溶液均显碱性,均能使无色酚酞试液变色
(4)解:设理论上可日产含铁96%的生铁的质量是x
x=3500t
答:理论上可日产含铁96%的生铁的质量是3500t
22. 0.1mol 将导管从石灰水中取出 Ca(OH)2 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaO、CaCO3 称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g答案第1页,共2页
答案第1页,共2页
一、单选题
1.推理是化学学习中常用的思维方法,下列推理正确的是( )
A.碱性溶液能使酚酞溶液变红色,能使酚酞溶液变红色的溶液一定显碱性
B.离子是带电的微粒,带电的微粒一定是离子
C.氧化物中一定含有氧元素,含氧元素的化合物一定是氧化物
D.置换反应的生成物是一种单质和一种化合物,生成一种单质和一种化合物的反应一定是置换反应
2.如图,向点滴板①~④滴孔中分别滴入指示剂后,①②③④滴孔内溶液显示的颜色依次是( )
A.无色、红色、蓝色、红色 B.红色、蓝色、黄色、紫色
C.蓝色、红色、紫色、无色 D.无色、蓝色、红色、蓝色
3.紫甘蓝是大众爱吃的蔬菜,含有丰富的花青素,花青素遇酸性溶液变红色,遇碱性溶液变蓝色,在凉拌紫甘蓝丝时,观察到菜丝变成红色,可能是加入了下列哪种调味品
A.食盐 B.味精 C.食醋 D.香油
4.下列实验方案中,两个方案均可行的是
实验目的 实验方案一 实验方案二
A 鉴别硬水和软水 取样,分别加入等质量的活性炭,静置,观察| 取样,分别加入等质量的肥皂水,搅拌,观察产生泡沫的情况
B 分离木炭粉和铁粉的混合物 用磁铁吸引| 在空气中充分加热
C 除去CO气体中的|少量CO2 将混合气体依次通过足量的氢氧化钠溶液和浓硫酸 将混合气体通过足量的的热CuO粉末
D 鉴别NaCl和NaOH两种固体| 取样,分别加水溶解,触摸试管外壁 取样,分别加水溶解,配成溶液,用pH试纸测定
A.A B.B C.C D.D
5.“雪碧”是一种无色的碳酸饮料,将少量“雪碧”滴入紫色石蕊试液中,然后再加热,溶液颜色的变化是
A.先变蓝后变紫 B.变红后颜色不再改变
C.先变无色后变红 D.先变红后变紫
6.pH是水质监测的重要指标之一,下列水样酸性最强的是
A.pH=1.3的工业废水 B.pH=4.5的雨水
C.pH=7.0的蒸馏水 D.pH=7.3的矿泉水
7.往KOH溶液中加水,溶液的pH变化正确的是( )
A. B.
C. D.
8.下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是
A.稀盐酸 B.二氧化碳 C.碳酸钙 D.石蕊溶液
9.小明为验证“分子是运动的”,设计了四个实验。其中不能达到目的的是( )
A. B. C. D.
10.下列叙述中,正确的是( )
A.盐酸遇石蕊溶液就可以变红
B.酚酞溶液可以使稀硫酸变红
C.用石蕊溶液可以鉴别稀盐酸和稀硫酸
D.用酚酞溶液可以鉴别稀硫酸和氢氧化钠溶液
11.根据下列实验现象可以判断某溶液一定呈碱性的是( )
A.溶液中滴入石蕊仍为紫色
B.溶液中滴入酚酞显红色
C.溶液中滴入石蕊显红色
D.溶液中滴入酚酞不显色
12.一些物质的pH范围如下,其中呈碱性的是
A.柠檬汁(2~3)
B.橘子汁(3~4)
C.西瓜汁(5~6)
D.牙膏(8~9)
13.下列有关溶液酸碱性的说法错误的是( )
A.pH=7的溶液呈中性
B.pH>7的溶液一定呈碱性
C.pH<7的雨水一定是酸雨
D.酸溶液的pH越小酸性越强
14.进行化学实验操作考核时,下列四位同学的操作中正确的是
A.检验溶液酸碱性 B.溶解固体
C.倾倒液体 D.熄灭酒精灯
15.某化学课外活动小组开展下列实验活动:取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如下表所示。下列对测定结果的分析中正确的是( )
测定时刻 17∶05 17∶10 17∶15 17∶20 17∶25 17∶30 17∶35
pH 4.95 4.94 4.92 4.88 4.86 4.85 4.85
A.在测定期间,该雨水的酸性逐渐减弱
B.该雨水对农作物的生长没有影响
C.若在17:40测定,pH一定小于4.85
D.pH=4.95与某些工厂排放的酸性气体有关
16.下列溶液能使紫色石蕊溶液变成蓝色的是
A.澄清石灰水 B.NaCl溶液
C.稀硫酸 D.KNO3溶液
二、综合应用题
17.信息加工素养指学生在短时间内自学新知识,能对信息进行提取和加工的能力
【资料】
◎我国的酸雨因大量燃绕含硫量高的煤面形成,机动车排放的尾气也是重要成因
◎溶液的酸碱度常pH来表示,pH值是一个介于0和14之间的数,在25℃下,当pH<7时溶液呈酸性,数值越小酸性越强:当pH>7时,溶液呈碱性,数值越大碱性越强;当pH=7时,溶液呈中性。
【实验】某化学课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5分钟测一次pH,其数据如表所示,请回答下列问题
测定时刻 17:05 17:10 17:15 7:20 7:25 17:30 17:35
pH 4.95 4.94 4.94 4.88 4.86 4.85 4.85
(1)在测定期间,该雨水为____________(填“酸性”“碱性”“中性”),而且逐渐________(填“增强”、减弱”或“不变”)
(2)若在17:40时刻测定,pH应为____________(填字母)
A 4.87 B 4.86 C 4.84 D 4.00
【应用】
(3)请提出一条减少酸雨的措施________________________
(4)回收二氧化硫可以生产硫酸,化学方程式为2SO2+O2+2H2O=2H2SO4,参加反应的SO2与生成的H2SO4的质量比是____________。若将3.2t的S完全燃烧,全部转化,可得到H2SO4的质量为____________t。
18.图A为实验室制取二氧化碳的装置图。
(1) 实验室制取二氧化碳时发生反应的化学方程式为_____________
(2) 图A并不完整,请你将此装置图补充完整_________。
(3) 小光认为B图中软塑料瓶变瘪,是因为CO2能溶于水,使瓶内气体_________气压______,小于外界大气压,在压强差的作用下,软塑料瓶变瘪。小军认为此实验能得出CO2能溶于水的结论,但无法得出二氧化碳能与水反应的结论,你认为他的理由是____;
(4) 为了进一步证实二氧化碳能与水反应,你认为接下来应怎样设计和操作实验______若观察到_______则可以证明二者发生了反应。
19.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
20.水是生命之源,万物之基,是人类最宝贵的自然资源。唤起人们保护水资源、节约用水的意识是十分有必要的。
(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面达标后方可成为生活饮用水。各种指标的主要要求为a. 不得呈现异色,b. 不得有异味,c. 水应澄清透明,d. 不得含有细菌的病毒。
①前两个指标可以利用_____(填物质名称)的吸附作用而达到。
②某山区自来水厂生产自来水的过程如图(1)所示。由图(1)可知净化水时,c,d两个指标可通过图中的B,C,_____过程而达到。
③化学指标中含有液体的pH和硬度两项,则a. 测定液体的pH用_____。
b. 日常生活中如何区分硬水与软水?请简述实验步骤与现象:_____。
(2)许多化学实验中都用到水,请指出图(2)所示实验中水的作用。
甲:_____;乙:_____;丙:_____;丁:_____;戊:_____。
(3)水既普通又宝贵,请你用化学方程式归纳水具有的重要的化学性质(举任意三例)。
①_____;②_____;③_____。
(4)图(3)是理想的氢元素循环示意图,下列说法不正确的是( )
A 水的分解反应需要吸收能量
B 燃料电池将氢能转化为电能
C 制取氢能比较理想的方法是在阳光照射条件下用催化剂来分解水
D 理想的氢元素循环可以通过物理变化来实现
(5)某次奥运会上火炬使用的燃料是丙烷(C3H6)而不是氢气,其原因可能是( )。
A 人类目前还无法制取氢气
B 氢气燃烧后的产物会污染环境
C 氢气燃烧时火焰呈淡蓝色,不易观察到明显的现象
D 氢气燃烧时一定会发生爆炸
21.在实验室里,可用如图装置进行CO还原Fe2O3的实验,并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有CO2和H2O。
(1)写出装置C处尾气处理的方法______(写一种即可);A装置中有关反应的化学方程式______。(写出一个即可)
(2)检验CO还原Fe2O3反应的气体生成物的现象是什么?______。
(3)实验后取A中固体溶于水,滴加酚酞溶液,溶液变红色,请分析可能的原因______。
(4)某钢铁厂用赤铁矿石炼铁。若该厂每天需消耗6000t含氧化铁80%的赤铁矿石,则理论上可日产含铁96%的生铁的质量是多少?(写出计算过程)
22.某同学称取10g碳酸钙粉末,如图所示进行实验。
(1)计算10g碳酸钙完全分解生成二氧化碳的物质的量。(根据化学方程式列式计算)_____
(2)加热一段时间后欲停止实验,应先_____。
(3)对加热后的剩余固体A进行实验,过程如右图所示。滤液B的溶质是_____;步骤Ⅲ中生成气体的化学方程式是_____;剩余固体A的成分是_____。
(4)不使用酚酞试液和稀盐酸也可以确定剩余固体A的成分,写出方法、结论及依据_____。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.A
3.C
4.D
5.D
6.A
7.C
8.D
9.B
10.D
11.B
12.D
13.C
14.D
15.D
16.A
17. 酸性 增强 C 硫酸厂产生的尾气处理后再排放,煤燃烧前先脱硫 32:49 4.9
18. CaCO3+2HC====CaCl2+CO2↑+H20 补固体、液体、液面、气泡、玻璃片 减少 变小 由实验现象不能证明有新物质(H2CO3)生成(或CO2溶于水也会观察到相同的实验现象,因此不能证明一定有新物质生成等)(合理即可) 向变瘪的塑料瓶里滴加紫色石蕊溶液 溶液由紫色变红色(合理即可)
19. SO2有一定的毒性 紫 20 是
20. 活性炭 D pH试纸(或pH计) 在水中加入肥皂水,搅拌,如泡沫较少(或没有)、浮渍较多则为硬水,否则为软水 水是溶剂 水将集气瓶内的空气排净,便于观察氢气何时收集满 吸收生成二氧化硫 防止溅落的熔化物炸裂瓶底 提供热量,隔绝氧气 D C
21.(1) 加一个燃着的酒精灯或绑一个气球 或 或
(2)C处澄清石灰水变浑浊
(3)氢氧化钠、氢氧化钙、碳酸钠溶液均显碱性,均能使无色酚酞试液变色
(4)解:设理论上可日产含铁96%的生铁的质量是x
x=3500t
答:理论上可日产含铁96%的生铁的质量是3500t
22. 0.1mol 将导管从石灰水中取出 Ca(OH)2 CaCO3+2HCl=CaCl2+H2O+CO2↑ CaO、CaCO3 称量剩余固体A的质量m,根据质量守恒定律:若m为10g,剩余固体A成分为CaCO3;若5.6g
答案第1页,共2页
