第2章 微粒的模型与符号 综合培优复习卷(含答案)
文档属性
| 名称 | 第2章 微粒的模型与符号 综合培优复习卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 230.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-03-22 19:18:00 | ||
图片预览



文档简介
第2章微粒的模型与符号综合培优复习卷
一、选择题
1.模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。仔细观察下列四个选项,其中不属于模型的是 ( )
A.眼球结构 B.世界杯会徽 C.地球仪 D.动物细胞
2.下列关于构成物质粒子的说法,正确的是 ( )
A.分子一定比原子大
B.分子和原子都是保持物质性质的粒子
C.分子和原子都可以直接构成物质
D.物质状态发生变化,是因为粒子大小发生变化
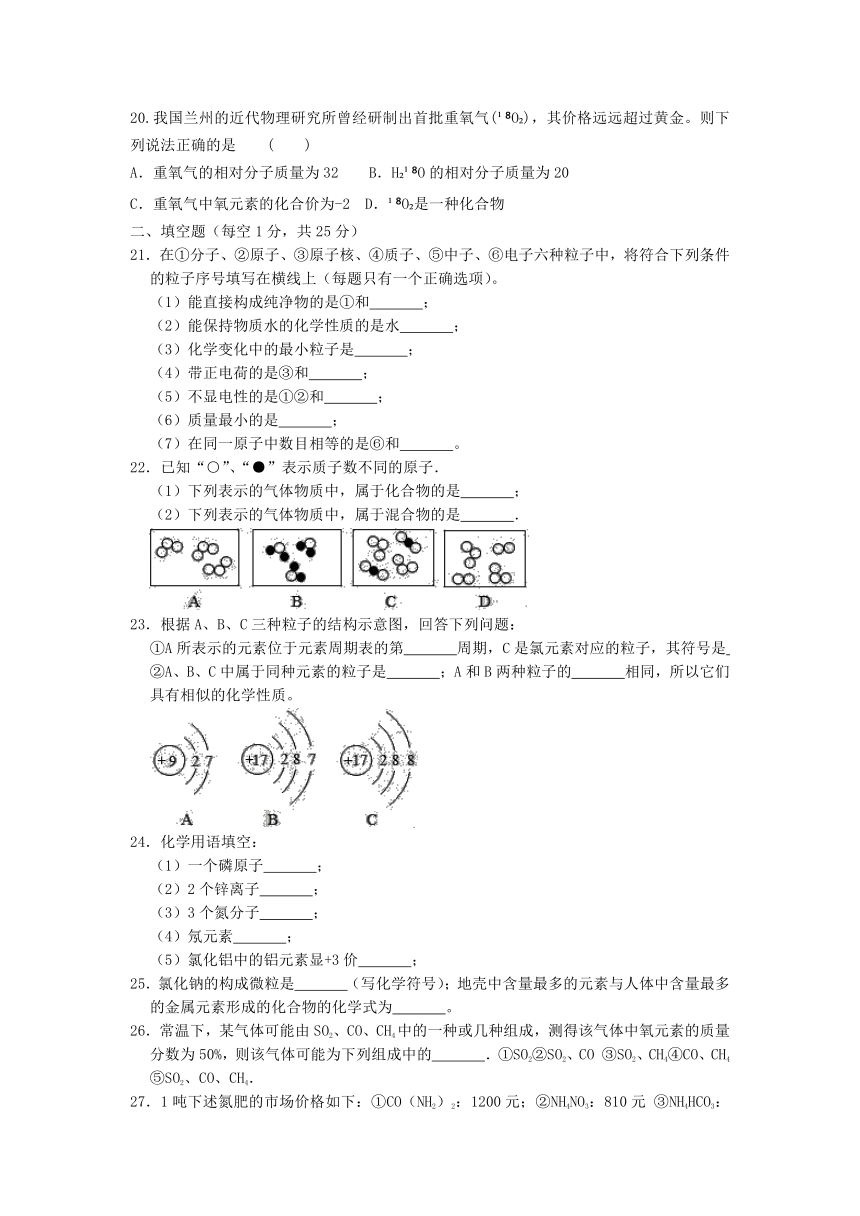
3.如图所示表示宇宙飞船发动机内氢气和氧气燃烧生成水的微观过程,下列说法错误的是 ( )
A.氢气、氧气和水都是由分子构成的
B.氢气和氧气燃烧生成水的过程中,分子种类发生了改变
C.氢气和氧气燃烧生成水的过程中,原子种类没有发生改变
D.水是由氢气和氧气组成的
4.下列化学用语中,既能表示一种元素,又能表示一种物质的是( )
A.H2 B.Cu C.CO2 D.HCl
5..3H2SO4中有“1”、“2”、“3”、“4”四个数字,它们表示的含义中,正确的
是( )
A.“1”表示硫元素的个数 B.“2”表示一个氢分子中有两个氢原子
C.“3”表示3个硫酸分子 D.“4”表示4个氧原子
6.下列物质中,元素以单质状态存在的是( )
①氧化钙;②氧气;③氯酸钾;④铜粉;⑤二氧化碳;⑥二氧化锰
A.②④ B.①③④ C.①③⑤⑥ D.全部都是
7.下列关于钠原子和钠离子的说法中,正确的是( )
A.它们的核外电子数相同 B.它们的性质完全相同
C.钠原子的质量比钠离子大的多 D.它们的质子数和中子数都相同
8.铀235(其原子核内有92个质子,相对原子质量为235)是核电站的主要燃料,下列有关说法正确的是 ( )
A.铀属于非金属元素 B.该原子的核电荷数为92
C.该原子核内有51个中子 D.该原子核外有143个电子
9.下列结构示意图所表达的微粒,与所表达的微粒属于同一种元素的是( )
A. B. C. D.
10.下列各组元素中,元素符号的第一个字母不相同的一组是 ( )
A.锰、钛 B.氩、金 C.铅、铂 D.氦、汞
11.某化学学习兴趣小组对粒子进行探究,下列结论中错误的是( )
A.当n=11且该粒子为阳离子时,x应为8
B.当x=8时,粒子中n越大,原子核对电子吸引力越大,粒子体积越小
C.当x=8且该粒子为阴离子时,核电荷数n应为12
D.当x=6且该粒子为原子时,核电荷数n应为8
12.如图为原子变化的示意图,其中①②③表示三种原子,“●”、“〇”、“。”表示原子中的不同微粒,①②③中属于同种元素的原子是( )
A.①②③ B.①② C.②③ D.①③
13.亚氯酸钠(NaClO2)是一种重要的消毒剂。下列说法不正确的是( )
A.闻到消毒剂气味是因为微粒在不断运动 B.NaClO2是由NaCl和O2构成的
C.NaClO2中钠元素质量分数为25.4% D.NaClO2中氯元素的化合价为+3
14.有三种不同的原子,A原子核内有6个质子6个中子,B原子核内有6个质子8个中子,C原子核内有7个质子7个中子,则下列说法正确的是( )
A.A和B是不同种元素 B.A和B的核电荷数不同 C.B和C核外电子数相等 D.A和B互为同位素原子
15.①在硫酸根离子SO42-中S的化合价是( )
A.+4 B.+6 C.+2 D.-2
16.已知甲原子与乙原子的质量比为a:b,而乙原子与碳-12原子的质量比为c:d,则甲原子的相对原子质量为 ( )
A. B. C. D.
17.等质量的下列物质中,所含分子数最少的是 ( )
A.Cl B.SO C.CO D.O
18.很多饮料中都含有柠檬酸(C H O )。下列关于柠檬酸的说法中正确的是 ( )
A.属于氧化物 B.由6个碳原子、8个氢原子和7个氧原子组成
C.氧元素的质量分数最大 D.碳、氢、氧三种元素的质量比为6:8:7
19.室温下某气体可能由SO 、CO、N 中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的 ( )
①SO ②SO 、CO ③SO 、N ④CO、N ⑤SO 、CO、N
A.①②③ B.②③⑤ C.①②⑤ D.①④⑤
20.我国兰州的近代物理研究所曾经研制出首批重氧气( O ),其价格远远超过黄金。则下列说法正确的是 ( )
A.重氧气的相对分子质量为32 B.H O的相对分子质量为20
C.重氧气中氧元素的化合价为-2 D. O 是一种化合物
二、填空题(每空1分,共25分)
21.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子六种粒子中,将符合下列条件的粒子序号填写在横线上(每题只有一个正确选项)。
(1)能直接构成纯净物的是①和 ;
(2)能保持物质水的化学性质的是水 ;
(3)化学变化中的最小粒子是 ;
(4)带正电荷的是③和 ;
(5)不显电性的是①②和 ;
(6)质量最小的是 ;
(7)在同一原子中数目相等的是⑥和 。
22.已知“○”、“●”表示质子数不同的原子.
(1)下列表示的气体物质中,属于化合物的是 ;
(2)下列表示的气体物质中,属于混合物的是 .
23.根据A、B、C三种粒子的结构示意图,回答下列问题:
①A所表示的元素位于元素周期表的第 周期,C是氯元素对应的粒子,其符号是
②A、B、C中属于同种元素的粒子是 ;A和B两种粒子的 相同,所以它们具有相似的化学性质。
24.化学用语填空:
(1)一个磷原子 ;
(2)2个锌离子 ;
(3)3个氮分子 ;
(4)氖元素 ;
(5)氯化铝中的铝元素显+3价 ;
25.氯化钠的构成微粒是 (写化学符号);地壳中含量最多的元素与人体中含量最多的金属元素形成的化合物的化学式为 。
26.常温下,某气体可能由SO2、CO、CH4中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的 .①SO2②SO2、CO ③SO2、CH4④CO、CH4⑤SO2、CO、CH4.
27.1吨下述氮肥的市场价格如下:①CO(NH2)2:1200元;②NH4NO3:810元 ③NH4HCO3:330元,分别用1万元采购上述氮肥,则得到的氮元素质量由多到少顺序为 (填序号)。
28.当氧化钠(Na2O)和过氧化钠(Na2O2)质量相等时,其中氧元素的质量比为 。
29.杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6,叶酸由 种元素组成,其中氢、氧元素的质量比为 。
三、实验探究题
30.通过对已学知识的对比和归纳,我们往往可以得出一些十分有趣的规律,这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读下表中的内容,并回答相应的问题.
常见的几种离子 H+ Na+ Mg2+ OH- Cl- SO42-
对应元素及原子团 在化合物中的化合价 +1 +1 +2 -1 -1 -2 H Na Mg OH C1 SO4
所能形成化合物的化学式 酸 碱 盐
HCl,H2SO4 NaOH,Mg(OH)2 MgCl2,Na2SO4
由前两行内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的 数相等.
由后两行内容对照可得出的规律是:通过元素或原子团的 可以确定相应化合物的化学式.
利用表格中所给内容,请你再写出一种盐的化学式 .
(4)根据硫酸亚铁的化学式FeSO4,可推出该物质所含阳离子的符号为 .
31.探究原子结构的奥秘。
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
实验做法如图:
(1)放射源 放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
(2)金箔 作为靶子,厚度1um,重叠了3000层左右的原子;
(3)荧光屏 α粒子打在上面发出闪光;
(4)显微镜 通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90 ,有的甚至几乎达到180 ,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 .
(2)1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明 ;
A. 原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的 .
A. 道耳顿模型特点:不可再分的实心球体
B. 汤姆生模型特点:正负电荷均匀分布
C. 卢瑟福模型特点:核位于原子中心,质量集中在核上
32.化学课上老师表演了一个小魔术 “无中生有”:相同条件下,向A. B两个体积相同的集气瓶中分别充满无色干燥的硫化氢(H2S)气体和二氧化硫气体。如图所示,抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿,观察到两瓶内壁附着淡黄色固体颗粒,同时瓶壁上有小水珠出现。请根据现象回答下列问题:
(1)上述反应的化学方程式为 ;硫化氢、二氧化硫中硫元素的化合价分别为 .
(2)如果这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因是 .
(3)已知:相同条件下,相等体积的气体所含的分子数目相等。反应完毕,瓶中剩余的气体为 (填化学式).
33.建立适当的模型来反映和代替客观对象,可以帮助人们认识和理解一些不能直接观察到的事物.
图甲是水分子的电解模型图,根据质量守恒定律可判断该模型图中缺少了 .
A. B. C. D.
(2)图乙是水中各元素质量分数模型,请在图丙中建立甲烷(CH4)中各元素质量分数模型.
34.“果冻”产品包装袋上的品名和配料如下
【品名】AD钙营养布丁
【配料】①水;②蔗糖;③奶粉;④乳酸钙;⑤柠檬酸;⑥维生素A;⑦维生素D;⑧食用色素。请回答:
(1)该产品属于营养素且为氧化物的是 (填编号);
(2)幼儿及少年缺钙会患 ,该产品中 物质可以补充钙元素;
(3)人体缺少配料中的 ,会引起夜盲症。所以,人体摄入营养要均衡;
(4)人体缺铁会引起贫血,可以在该奶粉中加入 物质可以补充铁元素。
35.在宏观、微观和符号之间建立联系是化学学科的特点.甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表:
物质 甲 乙 丙 丁 图例:
化学式 H2O C ?
微观示意图 ?
请写出丙物质的化学式,画出丁物质的微观示意图 .
(2)能保持甲物质化学性质的微粒是 (填“分子”或“原子”),四种物质中属于氧化物的有 (填甲、乙、丙、丁).
四、计算题
36.橡皮是必不可缺少的文具。现在普遍使用的塑料橡皮,主要以氯乙烯基树脂为原料。氯乙烯基树脂是由氯乙烯单体(C2H3Cl)聚合而成,这种小粒子有着很好的附着性和黏着性,因而清洁效果好。
(1)C2H3Cl中碳、氢、氯元素的原子个数比是________;
(2)通过计算求C2H3Cl中碳元素的质量分数。(结果精确到0.1%)
37.锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。如图2-7-8所示是某厂生产的葡萄糖酸锌口服液的标签(有部分内容不完整),请结合标签回答下列问题:
××牌口服液 主要成分:葡萄糖酸锌 化学式:C H O Zn 净含量:20 mL 含锌量:____mg 说明:每日两次,每次一支,不可超过推荐量 ××制药厂
(1)葡萄糖酸锌是由_______种元素组成的。
(2)葡萄糖酸锌(C H O Zn)的相对分子质量为____________________(要求列式计算)。
(3)葡萄糖酸锌中所含锌元素的质量分数是多少?(列式计算,结果精确至0.1%)
38..铁是生产、生活中应用最广泛的一种金属。
(1)在酱油中加入铁强化剂,是我国为解决___________(填“甲状腺肿大”“贫血”或“骨质疏松”)而实施的项目。
(2)铁元素与地壳中含量最多的元素组成化合物的化学式为______(写出一种即可)。高铁酸(Na FeO )是一种新型高效的净水剂,高铁酸钠中铁元素的化合价为_________。
(3)83克高铁酸钠(Na FeO )与________克氯化钠(NaCl)含有相同质量的钠元素。
(4)若要使Fe O 与Fe O 中含有相同质量的铁元素,则所需两物质的质量比为____________。
参考答案
一.选择题
1.B 2.C 3.D 4.B 5.C
6.A 7.D 8.D 9.B 10.B
11.C;12.B;13.B 14.D 15.B
16.A17.A 18.C 19.D 20.B
二.填空题
21、 ②;①;②;④;⑤;⑥;④
22、. B;C、D
23、 二;Cl﹣;BC;最外层电子数;
24、 P;2Zn2+;3N2;nE; Cl3;
25、 Na+、Cl﹣;CaO
26、 ①④⑤;
27、 ③②①;
28、 39:31;
29、 4;19:96;
三、实验探究题
30.(1)电荷;(2)化合价;(3)MgSO4(或NaCl);(4)Fe2+.
31.(1)不会,原子核(2)B (3)C
32. :(1)2H2S+SO2=3S+2H2O; 2、+4;(2)H2S与SO2反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压,所以塑料瓶变瘪了;(3)SO2.
33.(1)B;(2)如图:
34.(1)①(2)佝偻病,奶粉和乳酸钙(3)维生素A(4)硫酸亚铁或乳酸亚铁
35. CO 分子 甲、丙
四、计算题
36.(1)2:3:1
(2)38.4%
37. (1)四(2)12×12+1×22+16×14+65=455 (3)葡萄糖酸锌中所含锌元素的质量分数是×100%≈14.3%。
解析 (1)葡萄糖酸锌是由碳、氢、氧、锌四种元素组成的;(2)葡萄糖酸锌(C H O Zn)的相对分子质量为12×12+1×22+16×14+65=455;(3)根据化合物中元素的质量分数=×100%,可计算出葡萄糖酸锌中锌元素的质量分数。
38. (1)贫血 (2) Fe O 或Fe0或Fe O +6 (3)58.5 (4)30∶29
解析 (1)铁是合成血红蛋白的主要元素,缺铁会患贫血。
(2)地壳中含量最多的元素是氧元素,铁元素与氧元素形成化合物的化学式为Fe0、Fe O 或Fe O ;高铁酸钠中,钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中各元素正、负化合价代数和为零,可得(+1)×2+x+(-2)×4=0,解得x=+6。(3)83克高铁酸钠(Na FeO )中含钠元素的质量为83 g×=23 g,含23 g钠元素的氯化钠(NaCl)的质量为23 g÷=58.5 g;(4)解答本题可从微观角度分析。当所取Fe O 与Fe O 两物质中铁原子个数相同时(铁原子个数相同,铁元素的质量相同),Fe O 与Fe O 的个数比为3:2,3个Fe O 与2个Fe O 的质量比为[3×(56×2+16×3)]:[2×(56×3+16×4)]=30∶29。
一、选择题
1.模型常常可以帮助人们认识和理解一些不能直接观察到的或复杂的事物。仔细观察下列四个选项,其中不属于模型的是 ( )
A.眼球结构 B.世界杯会徽 C.地球仪 D.动物细胞
2.下列关于构成物质粒子的说法,正确的是 ( )
A.分子一定比原子大
B.分子和原子都是保持物质性质的粒子
C.分子和原子都可以直接构成物质
D.物质状态发生变化,是因为粒子大小发生变化
3.如图所示表示宇宙飞船发动机内氢气和氧气燃烧生成水的微观过程,下列说法错误的是 ( )
A.氢气、氧气和水都是由分子构成的
B.氢气和氧气燃烧生成水的过程中,分子种类发生了改变
C.氢气和氧气燃烧生成水的过程中,原子种类没有发生改变
D.水是由氢气和氧气组成的
4.下列化学用语中,既能表示一种元素,又能表示一种物质的是( )
A.H2 B.Cu C.CO2 D.HCl
5..3H2SO4中有“1”、“2”、“3”、“4”四个数字,它们表示的含义中,正确的
是( )
A.“1”表示硫元素的个数 B.“2”表示一个氢分子中有两个氢原子
C.“3”表示3个硫酸分子 D.“4”表示4个氧原子
6.下列物质中,元素以单质状态存在的是( )
①氧化钙;②氧气;③氯酸钾;④铜粉;⑤二氧化碳;⑥二氧化锰
A.②④ B.①③④ C.①③⑤⑥ D.全部都是
7.下列关于钠原子和钠离子的说法中,正确的是( )
A.它们的核外电子数相同 B.它们的性质完全相同
C.钠原子的质量比钠离子大的多 D.它们的质子数和中子数都相同
8.铀235(其原子核内有92个质子,相对原子质量为235)是核电站的主要燃料,下列有关说法正确的是 ( )
A.铀属于非金属元素 B.该原子的核电荷数为92
C.该原子核内有51个中子 D.该原子核外有143个电子
9.下列结构示意图所表达的微粒,与所表达的微粒属于同一种元素的是( )
A. B. C. D.
10.下列各组元素中,元素符号的第一个字母不相同的一组是 ( )
A.锰、钛 B.氩、金 C.铅、铂 D.氦、汞
11.某化学学习兴趣小组对粒子进行探究,下列结论中错误的是( )
A.当n=11且该粒子为阳离子时,x应为8
B.当x=8时,粒子中n越大,原子核对电子吸引力越大,粒子体积越小
C.当x=8且该粒子为阴离子时,核电荷数n应为12
D.当x=6且该粒子为原子时,核电荷数n应为8
12.如图为原子变化的示意图,其中①②③表示三种原子,“●”、“〇”、“。”表示原子中的不同微粒,①②③中属于同种元素的原子是( )
A.①②③ B.①② C.②③ D.①③
13.亚氯酸钠(NaClO2)是一种重要的消毒剂。下列说法不正确的是( )
A.闻到消毒剂气味是因为微粒在不断运动 B.NaClO2是由NaCl和O2构成的
C.NaClO2中钠元素质量分数为25.4% D.NaClO2中氯元素的化合价为+3
14.有三种不同的原子,A原子核内有6个质子6个中子,B原子核内有6个质子8个中子,C原子核内有7个质子7个中子,则下列说法正确的是( )
A.A和B是不同种元素 B.A和B的核电荷数不同 C.B和C核外电子数相等 D.A和B互为同位素原子
15.①在硫酸根离子SO42-中S的化合价是( )
A.+4 B.+6 C.+2 D.-2
16.已知甲原子与乙原子的质量比为a:b,而乙原子与碳-12原子的质量比为c:d,则甲原子的相对原子质量为 ( )
A. B. C. D.
17.等质量的下列物质中,所含分子数最少的是 ( )
A.Cl B.SO C.CO D.O
18.很多饮料中都含有柠檬酸(C H O )。下列关于柠檬酸的说法中正确的是 ( )
A.属于氧化物 B.由6个碳原子、8个氢原子和7个氧原子组成
C.氧元素的质量分数最大 D.碳、氢、氧三种元素的质量比为6:8:7
19.室温下某气体可能由SO 、CO、N 中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的 ( )
①SO ②SO 、CO ③SO 、N ④CO、N ⑤SO 、CO、N
A.①②③ B.②③⑤ C.①②⑤ D.①④⑤
20.我国兰州的近代物理研究所曾经研制出首批重氧气( O ),其价格远远超过黄金。则下列说法正确的是 ( )
A.重氧气的相对分子质量为32 B.H O的相对分子质量为20
C.重氧气中氧元素的化合价为-2 D. O 是一种化合物
二、填空题(每空1分,共25分)
21.在①分子、②原子、③原子核、④质子、⑤中子、⑥电子六种粒子中,将符合下列条件的粒子序号填写在横线上(每题只有一个正确选项)。
(1)能直接构成纯净物的是①和 ;
(2)能保持物质水的化学性质的是水 ;
(3)化学变化中的最小粒子是 ;
(4)带正电荷的是③和 ;
(5)不显电性的是①②和 ;
(6)质量最小的是 ;
(7)在同一原子中数目相等的是⑥和 。
22.已知“○”、“●”表示质子数不同的原子.
(1)下列表示的气体物质中,属于化合物的是 ;
(2)下列表示的气体物质中,属于混合物的是 .
23.根据A、B、C三种粒子的结构示意图,回答下列问题:
①A所表示的元素位于元素周期表的第 周期,C是氯元素对应的粒子,其符号是
②A、B、C中属于同种元素的粒子是 ;A和B两种粒子的 相同,所以它们具有相似的化学性质。
24.化学用语填空:
(1)一个磷原子 ;
(2)2个锌离子 ;
(3)3个氮分子 ;
(4)氖元素 ;
(5)氯化铝中的铝元素显+3价 ;
25.氯化钠的构成微粒是 (写化学符号);地壳中含量最多的元素与人体中含量最多的金属元素形成的化合物的化学式为 。
26.常温下,某气体可能由SO2、CO、CH4中的一种或几种组成,测得该气体中氧元素的质量分数为50%,则该气体可能为下列组成中的 .①SO2②SO2、CO ③SO2、CH4④CO、CH4⑤SO2、CO、CH4.
27.1吨下述氮肥的市场价格如下:①CO(NH2)2:1200元;②NH4NO3:810元 ③NH4HCO3:330元,分别用1万元采购上述氮肥,则得到的氮元素质量由多到少顺序为 (填序号)。
28.当氧化钠(Na2O)和过氧化钠(Na2O2)质量相等时,其中氧元素的质量比为 。
29.杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6,叶酸由 种元素组成,其中氢、氧元素的质量比为 。
三、实验探究题
30.通过对已学知识的对比和归纳,我们往往可以得出一些十分有趣的规律,这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读下表中的内容,并回答相应的问题.
常见的几种离子 H+ Na+ Mg2+ OH- Cl- SO42-
对应元素及原子团 在化合物中的化合价 +1 +1 +2 -1 -1 -2 H Na Mg OH C1 SO4
所能形成化合物的化学式 酸 碱 盐
HCl,H2SO4 NaOH,Mg(OH)2 MgCl2,Na2SO4
由前两行内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的 数相等.
由后两行内容对照可得出的规律是:通过元素或原子团的 可以确定相应化合物的化学式.
利用表格中所给内容,请你再写出一种盐的化学式 .
(4)根据硫酸亚铁的化学式FeSO4,可推出该物质所含阳离子的符号为 .
31.探究原子结构的奥秘。
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢
【进行实验】1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
实验做法如图:
(1)放射源 放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
(2)金箔 作为靶子,厚度1um,重叠了3000层左右的原子;
(3)荧光屏 α粒子打在上面发出闪光;
(4)显微镜 通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90 ,有的甚至几乎达到180 ,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 .
(2)1um金箔包含了3000层金原子,绝大多数α粒子穿过后方向不变,说明 ;
A. 原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的 .
A. 道耳顿模型特点:不可再分的实心球体
B. 汤姆生模型特点:正负电荷均匀分布
C. 卢瑟福模型特点:核位于原子中心,质量集中在核上
32.化学课上老师表演了一个小魔术 “无中生有”:相同条件下,向A. B两个体积相同的集气瓶中分别充满无色干燥的硫化氢(H2S)气体和二氧化硫气体。如图所示,抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿,观察到两瓶内壁附着淡黄色固体颗粒,同时瓶壁上有小水珠出现。请根据现象回答下列问题:
(1)上述反应的化学方程式为 ;硫化氢、二氧化硫中硫元素的化合价分别为 .
(2)如果这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因是 .
(3)已知:相同条件下,相等体积的气体所含的分子数目相等。反应完毕,瓶中剩余的气体为 (填化学式).
33.建立适当的模型来反映和代替客观对象,可以帮助人们认识和理解一些不能直接观察到的事物.
图甲是水分子的电解模型图,根据质量守恒定律可判断该模型图中缺少了 .
A. B. C. D.
(2)图乙是水中各元素质量分数模型,请在图丙中建立甲烷(CH4)中各元素质量分数模型.
34.“果冻”产品包装袋上的品名和配料如下
【品名】AD钙营养布丁
【配料】①水;②蔗糖;③奶粉;④乳酸钙;⑤柠檬酸;⑥维生素A;⑦维生素D;⑧食用色素。请回答:
(1)该产品属于营养素且为氧化物的是 (填编号);
(2)幼儿及少年缺钙会患 ,该产品中 物质可以补充钙元素;
(3)人体缺少配料中的 ,会引起夜盲症。所以,人体摄入营养要均衡;
(4)人体缺铁会引起贫血,可以在该奶粉中加入 物质可以补充铁元素。
35.在宏观、微观和符号之间建立联系是化学学科的特点.甲、乙、丙、丁表示四种物质,它们的部分化学式和微观示意图分别列于下表:
物质 甲 乙 丙 丁 图例:
化学式 H2O C ?
微观示意图 ?
请写出丙物质的化学式,画出丁物质的微观示意图 .
(2)能保持甲物质化学性质的微粒是 (填“分子”或“原子”),四种物质中属于氧化物的有 (填甲、乙、丙、丁).
四、计算题
36.橡皮是必不可缺少的文具。现在普遍使用的塑料橡皮,主要以氯乙烯基树脂为原料。氯乙烯基树脂是由氯乙烯单体(C2H3Cl)聚合而成,这种小粒子有着很好的附着性和黏着性,因而清洁效果好。
(1)C2H3Cl中碳、氢、氯元素的原子个数比是________;
(2)通过计算求C2H3Cl中碳元素的质量分数。(结果精确到0.1%)
37.锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。如图2-7-8所示是某厂生产的葡萄糖酸锌口服液的标签(有部分内容不完整),请结合标签回答下列问题:
××牌口服液 主要成分:葡萄糖酸锌 化学式:C H O Zn 净含量:20 mL 含锌量:____mg 说明:每日两次,每次一支,不可超过推荐量 ××制药厂
(1)葡萄糖酸锌是由_______种元素组成的。
(2)葡萄糖酸锌(C H O Zn)的相对分子质量为____________________(要求列式计算)。
(3)葡萄糖酸锌中所含锌元素的质量分数是多少?(列式计算,结果精确至0.1%)
38..铁是生产、生活中应用最广泛的一种金属。
(1)在酱油中加入铁强化剂,是我国为解决___________(填“甲状腺肿大”“贫血”或“骨质疏松”)而实施的项目。
(2)铁元素与地壳中含量最多的元素组成化合物的化学式为______(写出一种即可)。高铁酸(Na FeO )是一种新型高效的净水剂,高铁酸钠中铁元素的化合价为_________。
(3)83克高铁酸钠(Na FeO )与________克氯化钠(NaCl)含有相同质量的钠元素。
(4)若要使Fe O 与Fe O 中含有相同质量的铁元素,则所需两物质的质量比为____________。
参考答案
一.选择题
1.B 2.C 3.D 4.B 5.C
6.A 7.D 8.D 9.B 10.B
11.C;12.B;13.B 14.D 15.B
16.A17.A 18.C 19.D 20.B
二.填空题
21、 ②;①;②;④;⑤;⑥;④
22、. B;C、D
23、 二;Cl﹣;BC;最外层电子数;
24、 P;2Zn2+;3N2;nE; Cl3;
25、 Na+、Cl﹣;CaO
26、 ①④⑤;
27、 ③②①;
28、 39:31;
29、 4;19:96;
三、实验探究题
30.(1)电荷;(2)化合价;(3)MgSO4(或NaCl);(4)Fe2+.
31.(1)不会,原子核(2)B (3)C
32. :(1)2H2S+SO2=3S+2H2O; 2、+4;(2)H2S与SO2反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压,所以塑料瓶变瘪了;(3)SO2.
33.(1)B;(2)如图:
34.(1)①(2)佝偻病,奶粉和乳酸钙(3)维生素A(4)硫酸亚铁或乳酸亚铁
35. CO 分子 甲、丙
四、计算题
36.(1)2:3:1
(2)38.4%
37. (1)四(2)12×12+1×22+16×14+65=455 (3)葡萄糖酸锌中所含锌元素的质量分数是×100%≈14.3%。
解析 (1)葡萄糖酸锌是由碳、氢、氧、锌四种元素组成的;(2)葡萄糖酸锌(C H O Zn)的相对分子质量为12×12+1×22+16×14+65=455;(3)根据化合物中元素的质量分数=×100%,可计算出葡萄糖酸锌中锌元素的质量分数。
38. (1)贫血 (2) Fe O 或Fe0或Fe O +6 (3)58.5 (4)30∶29
解析 (1)铁是合成血红蛋白的主要元素,缺铁会患贫血。
(2)地壳中含量最多的元素是氧元素,铁元素与氧元素形成化合物的化学式为Fe0、Fe O 或Fe O ;高铁酸钠中,钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中各元素正、负化合价代数和为零,可得(+1)×2+x+(-2)×4=0,解得x=+6。(3)83克高铁酸钠(Na FeO )中含钠元素的质量为83 g×=23 g,含23 g钠元素的氯化钠(NaCl)的质量为23 g÷=58.5 g;(4)解答本题可从微观角度分析。当所取Fe O 与Fe O 两物质中铁原子个数相同时(铁原子个数相同,铁元素的质量相同),Fe O 与Fe O 的个数比为3:2,3个Fe O 与2个Fe O 的质量比为[3×(56×2+16×3)]:[2×(56×3+16×4)]=30∶29。
同课章节目录
- 第1章 电与磁
- 第1节 指南针为什么能指方向
- 第2节 电生磁
- 第3节 电磁铁的应用
- 第4节 电动机
- 第5节 磁生电
- 第6节 家庭用电
- 第7节 电的安全使用
- 第2章 微粒的模型与符号
- 第1节 模型、符号的建立与作用
- 第2节 物质的微观粒子模型
- 第3节 原子结构的模型
- 第4节 组成物质的元素
- 第5节 表示元素的符号
- 第6节 表示物质的符号
- 第7节 元素符号表示的量
- 第3章 空气与生命
- 第1节 空气与氧气
- 第2节 氧化和燃烧
- 第3节 化学方程式
- 第4节 二氧化碳
- 第5节 生物的呼吸和呼吸作用
- 第6节 光合作用
- 第7节 自然界中的氧循环和碳循环
- 第8节 空气污染与保护
- 第4章 植物与土壤
- 第1节 土壤的成分
- 第2节 各种各样的土壤
- 第3节 植物的根与物质吸收
- 第4节 植物的茎与物质运输
- 第5节 植物的叶与蒸腾作用
- 第6节 保护土壤
- 研究性学习课题
- 一 设计简单的电磁控制电路
- 二 化学反应中质量守恒的研究
- 三 研究植物的呼吸
- 四 当地水土状况调查
