7.3几种重要的盐同步练习-2021-2022学年九年级化学沪教版(全国)下册(word版 含答案)
文档属性
| 名称 | 7.3几种重要的盐同步练习-2021-2022学年九年级化学沪教版(全国)下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 179.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-25 00:00:00 | ||
图片预览



文档简介
沪教版(全国) 7.3 几种重要的盐 同步练习
一、单选题
1.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
2.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
3.下列物质的名称或俗名,属同一种物质的是
A.生石灰 熟石灰 消石灰 B.冰 干冰 可燃冰
C.烧碱 苛性钠 火碱 D.石灰石 熟石灰 大理石
4.硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起…云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A.是一种化合物 B.可用作复合肥料
C.可能发生分解反应 D.其溶解度一定大于NaCl的溶解度
5.实验是进行科学研究的重要手段,实验方案的设计是实验成功的基本保证,下列实验方案设计不合理的是
选项 实验目的 试验方法
A 比较Fe、Cu和Ag的金属活动性 将Fe和Ag分别加入CuSO4溶液中
B 除去CO中混有的CO2 将混合气体通过灼热的氧化铜粉末
C 鉴别水和过氧化氢溶液 取样,加入二氧化锰
D 鉴别阻NH4Cl和KC1 加熟石灰研磨,闻气味
A.A B.B C.C D.D
6.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
7.学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )
A.① B.② C.③ D.④
8.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
9.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
10.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
二、填空题
11.侯德榜先生发明了侯氏制碱法,主要原理及部分操作为:一定条件下,将NH3、CO2通入饱和氯化钠溶液,发生反应:,过滤,滤液中主要含有NH4Cl、NaCl两种物质,如图为NH4Cl、NaCl、NaHCO3三种物质的溶解度曲线。回答下列问题:
(1)60℃时,氯化铵的溶解度是______g。
(2)碳酸氢钠晶体首先从溶液中析出的原因是______。
(3)从滤液中得到氯化铵晶体的操作:蒸发浓缩、______、过滤、洗涤、干燥。
(4)将60℃时氯化铵和氯化钠的饱和溶液各100g分别蒸发掉10g水,然后降温至t℃,过滤,得到溶液甲和溶液乙,下列说法正确的是______(填标号)。
A.甲和乙都是饱和溶液 B.溶剂的质量:甲<乙
C.溶液的质量:甲>乙 D.溶质的质量分数:甲=乙
12.小华在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,老师告知是氢氧化钠、硫酸铜、氯化钠、碳酸钙中的一种。小华思考片刻后,认为取少量白色固体放入水中就能确定其成分,她的理由是:
(1)若不溶于水,则是_________。
(2)若溶于水形成蓝色溶液,则是__________。
(3)若溶于水溶液温度升高,则是_________。
(4)若溶于水溶液温度基本不变,则是__________。
13.从下列常见物质中选择适当的物质并填写其化学式:氯化铵、熟石灰、氢氧化钠、碳酸氢钠。农业上常用来改良酸性土壤的物质是______;发酵粉的主要成分之一是______。
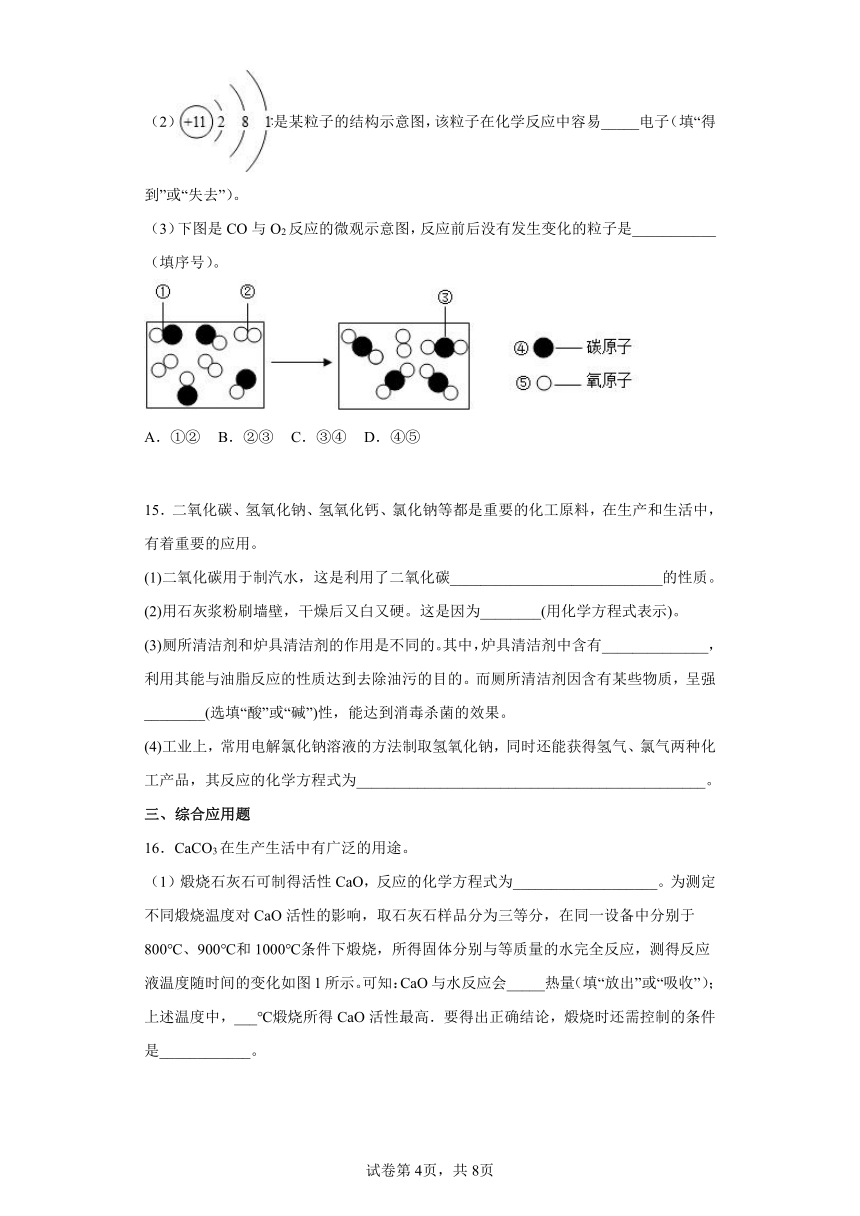
14.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由离子构成的物质是______
(2)是某粒子的结构示意图,该粒子在化学反应中容易_____电子(填“得到”或“失去”)。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是___________(填序号)。
A.①② B.②③ C.③④ D.④⑤
15.二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳____________________________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为________(用化学方程式表示)。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有______________,利用其能与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强________(选填“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为______________________________________________。
三、综合应用题
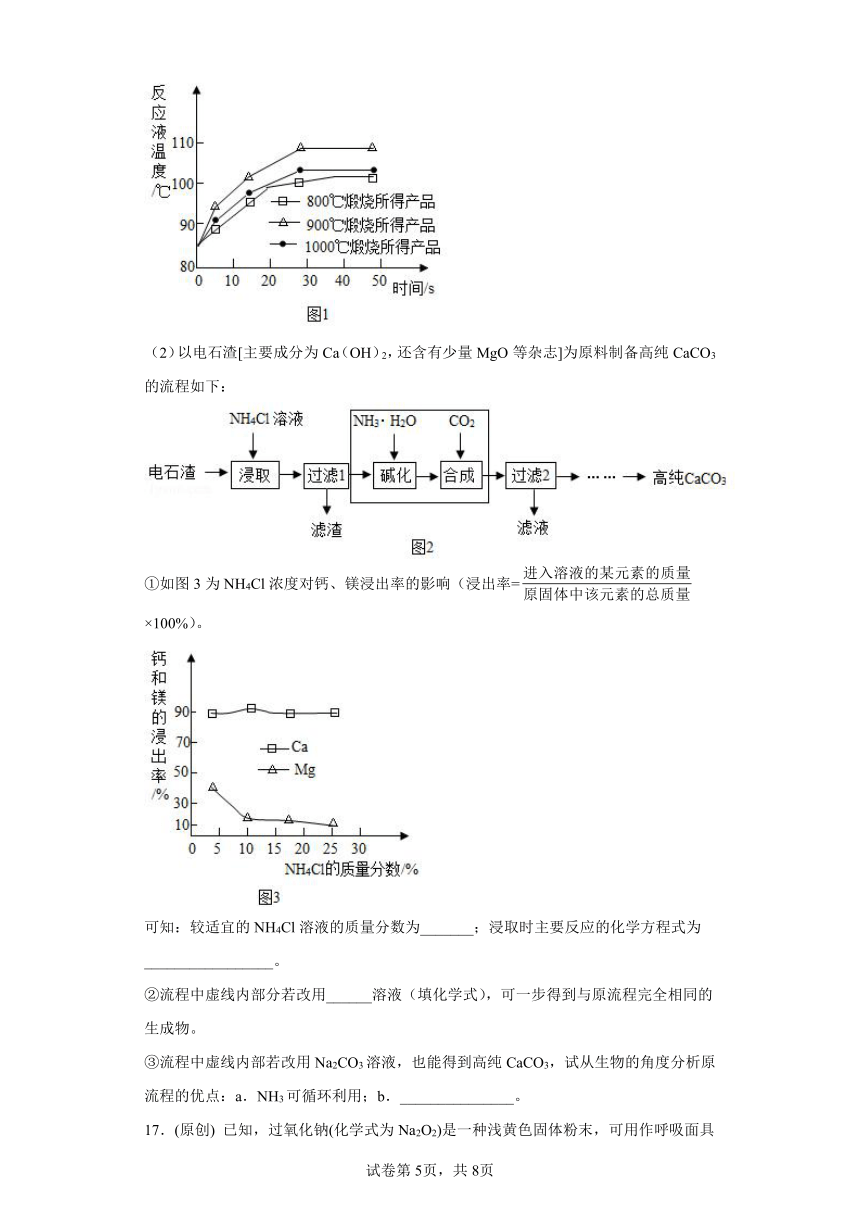
16.CaCO3在生产生活中有广泛的用途。
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________________。为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。可知:CaO与水反应会_____热量(填“放出”或“吸收”);上述温度中,___℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是____________。
(2)以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂志]为原料制备高纯CaCO3的流程如下:
①如图3为NH4Cl浓度对钙、镁浸出率的影响(浸出率= ×100%)。
可知:较适宜的NH4Cl溶液的质量分数为_______;浸取时主要反应的化学方程式为_________________。
②流程中虚线内部分若改用______溶液(填化学式),可一步得到与原流程完全相同的生成物。
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,试从生物的角度分析原流程的优点:a.NH3可循环利用;b._______________。
17.(原创) 已知,过氧化钠(化学式为Na2O2)是一种浅黄色固体粉末,可用作呼吸面具里的供氧剂,利用人呼出的二氧化碳与过氧化钠反应放出氧气,供给人的正常生命活动,该反应的化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。某同学利用该反应原理制取氧气,设计实验装置如下图所示:
(1)装置①中CO2的制取方法有多种:
若用稀盐酸和碳酸钠制取CO2,该反应的化学方程式为:_______________________;若用稀盐酸和大理石制取CO2,该反应的化学方程式为:____________________;若用加热NaHCO3固体制取CO2,应该选用的发生装置为________(选填下图字母),该反应的化学方程式为_______________;
(2)装置③中盛装的试剂为____________,作用是________________________。
(3)④为O2的收集装置,若想得到较为纯净的O2,应选用装置______(选填上图字母)。
18.碳酸钠用途非常广泛,是工业生产中重要的化工原料。在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法——“侯氏制碱法”。“侯氏制碱法”生产过程如下:
(1)第一步主要反应为,该反应属于_________反应基本反应类型。在生产中为了得到饱和溶液,气体通入的顺序是________。
(2)第二步用食盐与反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠、氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图所示。
①通过降温使硫酸钠从粗盐水中析出,其原理是____________________________。
②“精制Ⅰ”操作中,加入过量含钙元素的碱的化学式是___________,其化学反应方程式为_________。
③“精制Ⅱ”操作中,加入B盐的有关化学方程式为_____________。
④检验“精制Ⅱ”操作中B盐过量的实验方法是_______________。
⑤查阅资料得知有关物质在30℃时的溶解度如下表所示:
温度
30℃ 41.1g 27.0g 11.1g 36.3g 39.7g
根据溶解度表所提供的信息,推断“侯氏制碱法”中的第二步属于复分解反应的化学方程式为____________。反应后,经过过滤、_____________可获得碳酸氢钠。为了滤液中分离出副产品,可向滤液中通入某种气体,同时加入磨细的食盐,可析出不夹带的,和的溶解度曲线如图所示,通入的气体和控制的温度应该是_____________。
A.、0~10℃B.、30~40℃
C.、0~10℃D.、30~40℃
(3)第三步煅烧碳酸氢钠制得碳酸钠,反应的化学方程式为____________。
(4)“侯氏制碱法”的优点是原料中各原子的利用率高,除水以外可在本法中再用的物质有______________________(填写化学式)。
19.一瓶久置的氢氧化钠固体已经发生了变质。某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和Na2CO3的混合物;可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据此现象,可确定该固体是___;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
样品质量 反应前总质量 反应后总质量
10.6克 148.5克 146.3克
计算该样品中Na2CO3的质量分数____(写出计算过程)。
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量。测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示。请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应, 变质前消耗盐酸的量____变质后消耗盐酸的量(填“大于”、“小于”或“等于”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.D
5.B
6.C
7.C
8.D
9.C
10.B
11. 55.2 碳酸氢钠溶解度比较小首先达到饱和结晶析出 降温结晶 ABD
12. 碳酸钙 硫酸铜 氢氧化钠 氯化钠
13. Ca(OH)2 NaHCO3
14. 氯化钠 失去 D
15. 可与水反应生成碳酸 Ca(OH)2+CO2=CaCO3↓+H2O 氢氧化钠 酸 2NaCl+2H2O2NaOH+H2↑+Cl2↑
16. CaCO3 CaO+CO2↑ 放出 900 氧化钙的质量 10% 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O NH4HCO3 可以得到化工产品氯化钠
17. Na2CO3+2HCl===2NaCl+CO2↑+H2O CaCO3+2HCl===CaCl2+CO2↑+H2O A 2NaHCO3Na2CO3+CO2↑+H2O NaOH溶液 除去未反应的二氧化碳 E
18. 化合 先通入氨气,后通入 氯化钠的溶解度随温度的变化较小,硫酸钠的溶解度随温度的变化较大 、 取“精制Ⅱ”过滤后的滤液少许于试管中,滴入氯化钙溶液,观察到有白色沉淀产生,说明碳酸钠已过量(或取“精制Ⅱ”过滤后的滤液少许于试管中,滴入稀盐酸,观察到有气泡产生,说明碳酸钠已过量 洗涤 C 、
19. NaOH和Na2CO3的混合物 50% 等于
答案第1页,共2页
答案第1页,共2页
一、单选题
1.“一带一路”赋予古丝绸之路崭新的时代内涵。古代染坊常用下列物质中的一种盐来处理丝绸,这种盐是
A.熟石灰 B.碳酸钾 C.乙醇 D.烧碱
2.如图所示,U型管内a、b液面相平,当挤压滴管的胶头,使试剂X进入锥形瓶内,一段时间后会观察到a液面高于b液面。则试剂X、Y的组合可能是
A.水、硝酸铵
B.水、烧碱
C.稀硫酸、铁粉
D.稀盐酸、小苏打
3.下列物质的名称或俗名,属同一种物质的是
A.生石灰 熟石灰 消石灰 B.冰 干冰 可燃冰
C.烧碱 苛性钠 火碱 D.石灰石 熟石灰 大理石
4.硝石是主要含KNO3的天然矿物,历史上《本草经集注》中对硝石有记载:“强烧之,紫青烟起…云是真硝石也”。下列有关KNO3的叙述不正确的是( )
A.是一种化合物 B.可用作复合肥料
C.可能发生分解反应 D.其溶解度一定大于NaCl的溶解度
5.实验是进行科学研究的重要手段,实验方案的设计是实验成功的基本保证,下列实验方案设计不合理的是
选项 实验目的 试验方法
A 比较Fe、Cu和Ag的金属活动性 将Fe和Ag分别加入CuSO4溶液中
B 除去CO中混有的CO2 将混合气体通过灼热的氧化铜粉末
C 鉴别水和过氧化氢溶液 取样,加入二氧化锰
D 鉴别阻NH4Cl和KC1 加熟石灰研磨,闻气味
A.A B.B C.C D.D
6.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
7.学习了物质分类与转化规律后,某同学绘制了部分物质间相互反应的关系图。图中阴影部分表示相邻两类物质的反应,其中不能用于制取ZnCl2的是( )
A.① B.② C.③ D.④
8.下列物质不能与盐酸反应的是( )
A.Mg B.AgNO3 C.Cu(OH)2 D.FeSO4
9.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
10.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
二、填空题
11.侯德榜先生发明了侯氏制碱法,主要原理及部分操作为:一定条件下,将NH3、CO2通入饱和氯化钠溶液,发生反应:,过滤,滤液中主要含有NH4Cl、NaCl两种物质,如图为NH4Cl、NaCl、NaHCO3三种物质的溶解度曲线。回答下列问题:
(1)60℃时,氯化铵的溶解度是______g。
(2)碳酸氢钠晶体首先从溶液中析出的原因是______。
(3)从滤液中得到氯化铵晶体的操作:蒸发浓缩、______、过滤、洗涤、干燥。
(4)将60℃时氯化铵和氯化钠的饱和溶液各100g分别蒸发掉10g水,然后降温至t℃,过滤,得到溶液甲和溶液乙,下列说法正确的是______(填标号)。
A.甲和乙都是饱和溶液 B.溶剂的质量:甲<乙
C.溶液的质量:甲>乙 D.溶质的质量分数:甲=乙
12.小华在实验室帮老师整理药品时,发现一瓶失去标签的白色固体,老师告知是氢氧化钠、硫酸铜、氯化钠、碳酸钙中的一种。小华思考片刻后,认为取少量白色固体放入水中就能确定其成分,她的理由是:
(1)若不溶于水,则是_________。
(2)若溶于水形成蓝色溶液,则是__________。
(3)若溶于水溶液温度升高,则是_________。
(4)若溶于水溶液温度基本不变,则是__________。
13.从下列常见物质中选择适当的物质并填写其化学式:氯化铵、熟石灰、氢氧化钠、碳酸氢钠。农业上常用来改良酸性土壤的物质是______;发酵粉的主要成分之一是______。
14.初中化学学习中,我们初步认识了物质的微观结构。
(1)氯化钠、金刚石、干冰三种物质中,由离子构成的物质是______
(2)是某粒子的结构示意图,该粒子在化学反应中容易_____电子(填“得到”或“失去”)。
(3)下图是CO与O2反应的微观示意图,反应前后没有发生变化的粒子是___________(填序号)。
A.①② B.②③ C.③④ D.④⑤
15.二氧化碳、氢氧化钠、氢氧化钙、氯化钠等都是重要的化工原料,在生产和生活中,有着重要的应用。
(1)二氧化碳用于制汽水,这是利用了二氧化碳____________________________的性质。
(2)用石灰浆粉刷墙壁,干燥后又白又硬。这是因为________(用化学方程式表示)。
(3)厕所清洁剂和炉具清洁剂的作用是不同的。其中,炉具清洁剂中含有______________,利用其能与油脂反应的性质达到去除油污的目的。而厕所清洁剂因含有某些物质,呈强________(选填“酸”或“碱”)性,能达到消毒杀菌的效果。
(4)工业上,常用电解氯化钠溶液的方法制取氢氧化钠,同时还能获得氢气、氯气两种化工产品,其反应的化学方程式为______________________________________________。
三、综合应用题
16.CaCO3在生产生活中有广泛的用途。
(1)煅烧石灰石可制得活性CaO,反应的化学方程式为___________________。为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等分,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。可知:CaO与水反应会_____热量(填“放出”或“吸收”);上述温度中,___℃煅烧所得CaO活性最高.要得出正确结论,煅烧时还需控制的条件是____________。
(2)以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂志]为原料制备高纯CaCO3的流程如下:
①如图3为NH4Cl浓度对钙、镁浸出率的影响(浸出率= ×100%)。
可知:较适宜的NH4Cl溶液的质量分数为_______;浸取时主要反应的化学方程式为_________________。
②流程中虚线内部分若改用______溶液(填化学式),可一步得到与原流程完全相同的生成物。
③流程中虚线内部若改用Na2CO3溶液,也能得到高纯CaCO3,试从生物的角度分析原流程的优点:a.NH3可循环利用;b._______________。
17.(原创) 已知,过氧化钠(化学式为Na2O2)是一种浅黄色固体粉末,可用作呼吸面具里的供氧剂,利用人呼出的二氧化碳与过氧化钠反应放出氧气,供给人的正常生命活动,该反应的化学方程式为:2Na2O2+2CO2===2Na2CO3+O2。某同学利用该反应原理制取氧气,设计实验装置如下图所示:
(1)装置①中CO2的制取方法有多种:
若用稀盐酸和碳酸钠制取CO2,该反应的化学方程式为:_______________________;若用稀盐酸和大理石制取CO2,该反应的化学方程式为:____________________;若用加热NaHCO3固体制取CO2,应该选用的发生装置为________(选填下图字母),该反应的化学方程式为_______________;
(2)装置③中盛装的试剂为____________,作用是________________________。
(3)④为O2的收集装置,若想得到较为纯净的O2,应选用装置______(选填上图字母)。
18.碳酸钠用途非常广泛,是工业生产中重要的化工原料。在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法——“侯氏制碱法”。“侯氏制碱法”生产过程如下:
(1)第一步主要反应为,该反应属于_________反应基本反应类型。在生产中为了得到饱和溶液,气体通入的顺序是________。
(2)第二步用食盐与反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠、氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图所示。
①通过降温使硫酸钠从粗盐水中析出,其原理是____________________________。
②“精制Ⅰ”操作中,加入过量含钙元素的碱的化学式是___________,其化学反应方程式为_________。
③“精制Ⅱ”操作中,加入B盐的有关化学方程式为_____________。
④检验“精制Ⅱ”操作中B盐过量的实验方法是_______________。
⑤查阅资料得知有关物质在30℃时的溶解度如下表所示:
温度
30℃ 41.1g 27.0g 11.1g 36.3g 39.7g
根据溶解度表所提供的信息,推断“侯氏制碱法”中的第二步属于复分解反应的化学方程式为____________。反应后,经过过滤、_____________可获得碳酸氢钠。为了滤液中分离出副产品,可向滤液中通入某种气体,同时加入磨细的食盐,可析出不夹带的,和的溶解度曲线如图所示,通入的气体和控制的温度应该是_____________。
A.、0~10℃B.、30~40℃
C.、0~10℃D.、30~40℃
(3)第三步煅烧碳酸氢钠制得碳酸钠,反应的化学方程式为____________。
(4)“侯氏制碱法”的优点是原料中各原子的利用率高,除水以外可在本法中再用的物质有______________________(填写化学式)。
19.一瓶久置的氢氧化钠固体已经发生了变质。某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和Na2CO3的混合物;可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据此现象,可确定该固体是___;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
样品质量 反应前总质量 反应后总质量
10.6克 148.5克 146.3克
计算该样品中Na2CO3的质量分数____(写出计算过程)。
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量。测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示。请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应, 变质前消耗盐酸的量____变质后消耗盐酸的量(填“大于”、“小于”或“等于”)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.C
4.D
5.B
6.C
7.C
8.D
9.C
10.B
11. 55.2 碳酸氢钠溶解度比较小首先达到饱和结晶析出 降温结晶 ABD
12. 碳酸钙 硫酸铜 氢氧化钠 氯化钠
13. Ca(OH)2 NaHCO3
14. 氯化钠 失去 D
15. 可与水反应生成碳酸 Ca(OH)2+CO2=CaCO3↓+H2O 氢氧化钠 酸 2NaCl+2H2O2NaOH+H2↑+Cl2↑
16. CaCO3 CaO+CO2↑ 放出 900 氧化钙的质量 10% 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O NH4HCO3 可以得到化工产品氯化钠
17. Na2CO3+2HCl===2NaCl+CO2↑+H2O CaCO3+2HCl===CaCl2+CO2↑+H2O A 2NaHCO3Na2CO3+CO2↑+H2O NaOH溶液 除去未反应的二氧化碳 E
18. 化合 先通入氨气,后通入 氯化钠的溶解度随温度的变化较小,硫酸钠的溶解度随温度的变化较大 、 取“精制Ⅱ”过滤后的滤液少许于试管中,滴入氯化钙溶液,观察到有白色沉淀产生,说明碳酸钠已过量(或取“精制Ⅱ”过滤后的滤液少许于试管中,滴入稀盐酸,观察到有气泡产生,说明碳酸钠已过量 洗涤 C 、
19. NaOH和Na2CO3的混合物 50% 等于
答案第1页,共2页
答案第1页,共2页
