沪教版(全国)6.2溶液组成的表示同步练习(word版 含答案)
文档属性
| 名称 | 沪教版(全国)6.2溶液组成的表示同步练习(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 165.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-27 21:55:43 | ||
图片预览



文档简介
沪教版(全国) 6.2 溶液组成的表示 同步练习
一、单选题
1.下列物质依次为悬浊液、乳浊液、溶液的一组是
A.江水、肥皂水、碘酒 B.矿泉水、自来水、汽油和水的混合物
C.牛奶、汽水、石灰水 D.酒精、泥浆、汽水
2.某温度时,向水中加入蔗糖,搅拌后,还剩余蔗糖未溶解,则这时溶液的质量为( )
A. B. C. D.
3.下列关于“10%的硝酸钾溶液”含义的说法中,错误的是
A.100 g水中溶解了10 g硝酸钾
B.100 g硝酸钾溶液中有10 g硝酸钾
C.将10 g硝酸钾溶于90 g水中所得的溶液
D.将硝酸钾与水按1∶9的质量比配制的溶液
4.已知:20℃时,NaCl和NaNO3的溶解度分别为36 g和88 g。
序号 ① ② ③ ④ ⑤
固体种类 NaCl NaCl NaNO3 NaNO3 NaNO3
固体的质量/g 30 60 30 60 90
水的质量/g 100 100 100 100 100
上表是20℃时实验得出的数据,根据该数据,则下列关于①~⑤所得溶液的说法不正确的是A.溶质质量:②=④ B.溶液质量: ①<②
C.溶质质量分数:①=③ D.⑤中溶质与溶剂的质量比为22:25
5.实验室用氯化钠和水配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.实验步骤:计算、量取、溶解、装瓶、贴签
B.量取水时,用规格为50mL的量筒
C.实验过程中玻璃棒搅拌的作用是散热
D.若在量取水时俯视读数量取,则配制溶液的溶质质量分数小于6%
6.以下说法正确的是
A.溶液一定是均一、无色、稳定的 B.均一、稳定的液体一定是溶液
C.溶液的溶质一定是固体 D.溶液一定是混合物
7.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
8.硝酸钾可作为无土栽培的一种营养液。现将 25%的硝酸钾溶液稀释成 200g 10%来用于培植营养液,则需加水( )
A.80g B.300g C.120g D.100g
9.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
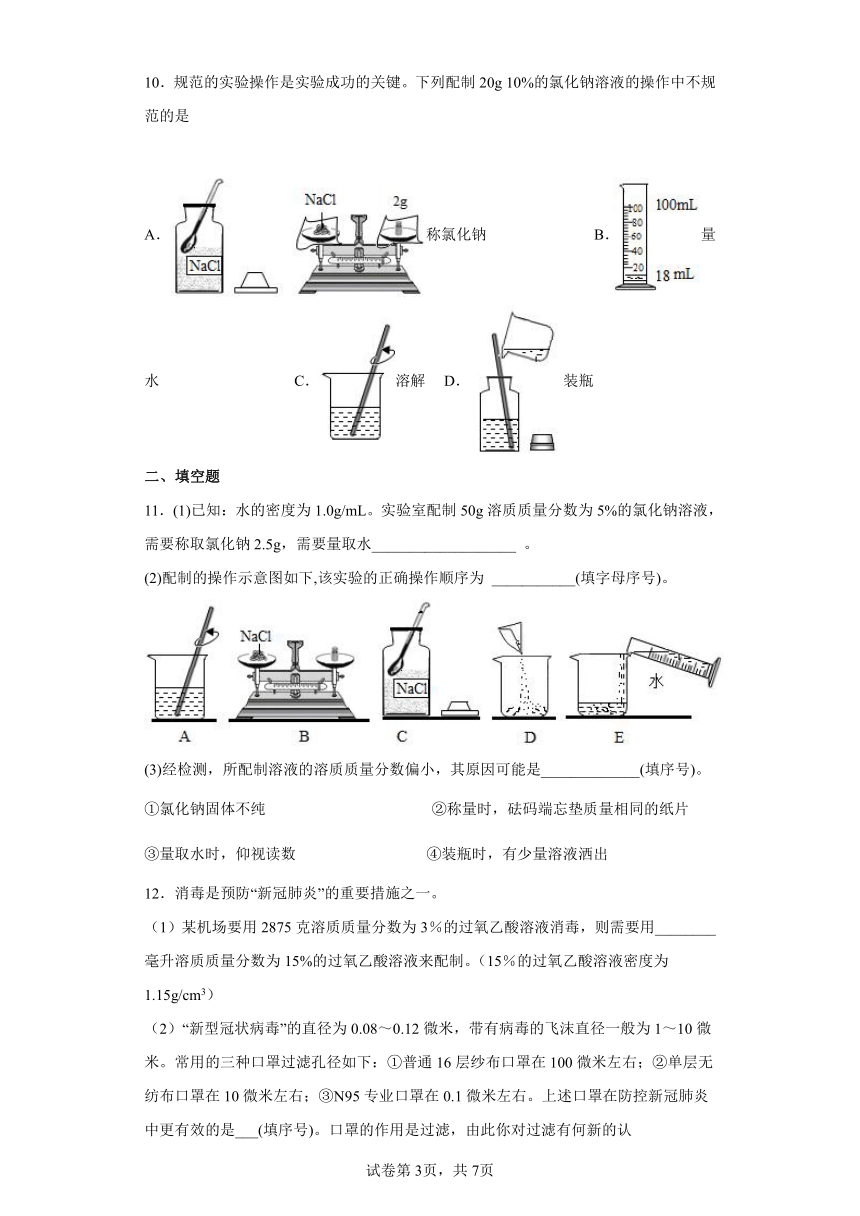
10.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠 B.量水 C.溶解 D.装瓶
二、填空题
11.(1)已知:水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要称取氯化钠2.5g,需要量取水___________________ 。
(2)配制的操作示意图如下,该实验的正确操作顺序为 ___________(填字母序号)。
(3)经检测,所配制溶液的溶质质量分数偏小,其原因可能是_____________(填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
12.消毒是预防“新冠肺炎”的重要措施之一。
(1)某机场要用2875克溶质质量分数为3%的过氧乙酸溶液消毒,则需要用________毫升溶质质量分数为15%的过氧乙酸溶液来配制。(15%的过氧乙酸溶液密度为1.15g/cm3)
(2)“新型冠状病毒”的直径为0.08~0.12微米,带有病毒的飞沫直径一般为1~10微米。常用的三种口罩过滤孔径如下:①普通16层纱布口罩在100微米左右;②单层无纺布口罩在10微米左右;③N95专业口罩在0.1微米左右。上述口罩在防控新冠肺炎中更有效的是___(填序号)。口罩的作用是过滤,由此你对过滤有何新的认识 ____________________。
13.使10%的蔗糖溶液:
(1)溶质的质量分数增至20%,需加多少蔗糖______?
(2)若使溶质的质量分数降到5%,则需加多少水______?
14.溶液在日常生活中具有广泛的用途,请回答下列问题。
(1)碘酒是家庭常备药,碘酒中的溶质是___________;取出碘酒中的任意一部分进行比较,发现它们的组成成分相同,说明溶液具有___________性。
(2)生理盐水是医疗上常用的一种溶液,合格的生理盐水是无色透明的。一瓶合格的生理盐水密封放置一段时间后___________(选填“会”或“不会”)出现浑浊现象,理由是溶液具有___________性。
15.某温度下,将 50 g KNO3 加入到 100 g 水中,充分搅拌后溶解掉 40 g KNO3,得到140 gKNO3 溶液。据此回答下列问题:
(1)该溶液中溶质是___________(填化学式,下同),溶剂是______________;
(2)得到的溶液中溶质质量为________g,溶剂质量为________g;
(3)将上述溶液平分成两等份,则每份溶液的质量为_______ g,每份溶液中溶质的质量为________g,溶剂质量为________g。
三、综合应用题
16.实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。
①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
17.往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
(1)c→d段溶液的pH大于7的原因是_____
(2)c点时溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
18.利用红磷测定空气中氧气含量的实验装置如图1,用气体压力传感器测出该集气瓶中的气压变化如图2。请回答下列问题:
(1)写出红磷燃烧的化学方程式。
(2)图2中BC段气压变化的原因是什么?
(3)导致DE段气压变化的实验操作是什么?
(4)某化学兴趣小组对某铜锌合金样品进行探究实验。称取样品10.0g,再用100.0g稀硫酸溶液逐滴滴入,实验情况如图所示。求:
①铜锌合金中,锌的质量分数是______;
②所用稀硫酸溶液中溶质的质量分数是多少______?
19.下图所示为实验室常用的实验装置:
回答下列问题:
(1)写出带标号②仪器的名称:_____。若实验室制取氧气的发生装置可以选用A,则选择的依据是什么_____?写出用氯酸钾为原料制取氧气的化学方程式_____。
(2)实验室制取并收集一瓶二氧化碳气体应选择的装置是_____。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为:_____。
(4)下图为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,请另写一个优点:_____。
若用如下图装置按箭头所示的流向收集一瓶二氧化碳气体,请将集气瓶内的导管补画完整_____。
(5)取溶质质量分数为8.5%的过氧化氢溶液20g倒入烧杯中,在催化剂的作用下使其完全分解,计算理论上共能产生氧气多少克_____?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.A
4.A
5.B
6.D
7.A
8.C
9.C
10.B
11. 47.5mL C B D E A ①②③
12. 500 ③ 过滤不一定是固液分离,过滤实质上是大小颗粒的分离过程等
13.
14.(1) 碘 均一
(2) 不会 稳定
15. KNO3 H2O 40 100 70 20 50
16. 10.0 氢氧化钠 10% 先产生白色浑浊,继续通二氧化碳,溶液又变澄清 一段时间后出现白色沉淀 4632 80
17.(1)碳酸钠溶液显碱性;(2)15.6%
18.(1)4P+5O22P2O5
(2)红磷燃烧是放热反应,气体体积膨胀,压强变大,所以造成BC段气压升高
(3)打开弹簧夹
(4) 65% 解:由图可知,锌与硫酸恰好完全反应时,消耗稀硫酸的质量为50g,设参加反应的硫酸质量为x,则有
所以所用稀硫酸溶液中溶质的质量分数为×100%=19.6%;
答:所用稀硫酸溶液中溶质的质量分数为19.6%。
19. 长颈漏斗 反应物是固体,反应条件是加热 BD 节约药品、可随时控制反应发生或停止 0.8g
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质依次为悬浊液、乳浊液、溶液的一组是
A.江水、肥皂水、碘酒 B.矿泉水、自来水、汽油和水的混合物
C.牛奶、汽水、石灰水 D.酒精、泥浆、汽水
2.某温度时,向水中加入蔗糖,搅拌后,还剩余蔗糖未溶解,则这时溶液的质量为( )
A. B. C. D.
3.下列关于“10%的硝酸钾溶液”含义的说法中,错误的是
A.100 g水中溶解了10 g硝酸钾
B.100 g硝酸钾溶液中有10 g硝酸钾
C.将10 g硝酸钾溶于90 g水中所得的溶液
D.将硝酸钾与水按1∶9的质量比配制的溶液
4.已知:20℃时,NaCl和NaNO3的溶解度分别为36 g和88 g。
序号 ① ② ③ ④ ⑤
固体种类 NaCl NaCl NaNO3 NaNO3 NaNO3
固体的质量/g 30 60 30 60 90
水的质量/g 100 100 100 100 100
上表是20℃时实验得出的数据,根据该数据,则下列关于①~⑤所得溶液的说法不正确的是A.溶质质量:②=④ B.溶液质量: ①<②
C.溶质质量分数:①=③ D.⑤中溶质与溶剂的质量比为22:25
5.实验室用氯化钠和水配制50g质量分数为6%的氯化钠溶液。下列说法正确的是( )
A.实验步骤:计算、量取、溶解、装瓶、贴签
B.量取水时,用规格为50mL的量筒
C.实验过程中玻璃棒搅拌的作用是散热
D.若在量取水时俯视读数量取,则配制溶液的溶质质量分数小于6%
6.以下说法正确的是
A.溶液一定是均一、无色、稳定的 B.均一、稳定的液体一定是溶液
C.溶液的溶质一定是固体 D.溶液一定是混合物
7.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
8.硝酸钾可作为无土栽培的一种营养液。现将 25%的硝酸钾溶液稀释成 200g 10%来用于培植营养液,则需加水( )
A.80g B.300g C.120g D.100g
9.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
10.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠 B.量水 C.溶解 D.装瓶
二、填空题
11.(1)已知:水的密度为1.0g/mL。实验室配制50g溶质质量分数为5%的氯化钠溶液,需要称取氯化钠2.5g,需要量取水___________________ 。
(2)配制的操作示意图如下,该实验的正确操作顺序为 ___________(填字母序号)。
(3)经检测,所配制溶液的溶质质量分数偏小,其原因可能是_____________(填序号)。
①氯化钠固体不纯 ②称量时,砝码端忘垫质量相同的纸片
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
12.消毒是预防“新冠肺炎”的重要措施之一。
(1)某机场要用2875克溶质质量分数为3%的过氧乙酸溶液消毒,则需要用________毫升溶质质量分数为15%的过氧乙酸溶液来配制。(15%的过氧乙酸溶液密度为1.15g/cm3)
(2)“新型冠状病毒”的直径为0.08~0.12微米,带有病毒的飞沫直径一般为1~10微米。常用的三种口罩过滤孔径如下:①普通16层纱布口罩在100微米左右;②单层无纺布口罩在10微米左右;③N95专业口罩在0.1微米左右。上述口罩在防控新冠肺炎中更有效的是___(填序号)。口罩的作用是过滤,由此你对过滤有何新的认识 ____________________。
13.使10%的蔗糖溶液:
(1)溶质的质量分数增至20%,需加多少蔗糖______?
(2)若使溶质的质量分数降到5%,则需加多少水______?
14.溶液在日常生活中具有广泛的用途,请回答下列问题。
(1)碘酒是家庭常备药,碘酒中的溶质是___________;取出碘酒中的任意一部分进行比较,发现它们的组成成分相同,说明溶液具有___________性。
(2)生理盐水是医疗上常用的一种溶液,合格的生理盐水是无色透明的。一瓶合格的生理盐水密封放置一段时间后___________(选填“会”或“不会”)出现浑浊现象,理由是溶液具有___________性。
15.某温度下,将 50 g KNO3 加入到 100 g 水中,充分搅拌后溶解掉 40 g KNO3,得到140 gKNO3 溶液。据此回答下列问题:
(1)该溶液中溶质是___________(填化学式,下同),溶剂是______________;
(2)得到的溶液中溶质质量为________g,溶剂质量为________g;
(3)将上述溶液平分成两等份,则每份溶液的质量为_______ g,每份溶液中溶质的质量为________g,溶剂质量为________g。
三、综合应用题
16.实验室配制饱和澄清石灰水和质量分数为10%的氢氧化钠溶液,并进行有关实验。
下表是20℃时部分物质的溶解度数据。
物质 Ca(OH)2 NaOH CaCO3 Ca(HCO3)2 Na2CO3 NaHCO3
溶解度/g 0.16 109 0.0065 16.6 21.8 9.6
(1)配制溶液。其中配制100g10%氢氧化钠溶液的基本步骤是:
称取氢氧化钠固体—量取水—溶解—装瓶贴标签。
①称取氢氧化钠固体的质量_____________g。
②已知水的密度为1g/cm3,用100mL量筒量取所需的水,_______画出水的液面。
③装瓶后贴标签,在标签上填写:_______________________________。
(2)进行性质探究实验,20℃时,根据数据回答下列问题:
①向饱和澄清石灰水中通入CO2直至过量,先生成CaCO3,再转化为Ca(HCO3)2,可观察到的现象是________________________________。
②向10%氢氧化钠溶液中通入CO2直至过量,先生成Na2CO3,再转化为NaHCO3,可观察到的现象是_______________________________________________________。
③理论上吸收4.4gCO2,需饱和澄清石灰水的质量至少为___________g,或需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到个位)
17.往100克含有盐酸和氯化钙的混合溶液中,加入21.2%的碳酸钠溶液,所得溶液的pH变化与加入碳酸钠溶液的质量关系如图,试分析计算:
(1)c→d段溶液的pH大于7的原因是_____
(2)c点时溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
18.利用红磷测定空气中氧气含量的实验装置如图1,用气体压力传感器测出该集气瓶中的气压变化如图2。请回答下列问题:
(1)写出红磷燃烧的化学方程式。
(2)图2中BC段气压变化的原因是什么?
(3)导致DE段气压变化的实验操作是什么?
(4)某化学兴趣小组对某铜锌合金样品进行探究实验。称取样品10.0g,再用100.0g稀硫酸溶液逐滴滴入,实验情况如图所示。求:
①铜锌合金中,锌的质量分数是______;
②所用稀硫酸溶液中溶质的质量分数是多少______?
19.下图所示为实验室常用的实验装置:
回答下列问题:
(1)写出带标号②仪器的名称:_____。若实验室制取氧气的发生装置可以选用A,则选择的依据是什么_____?写出用氯酸钾为原料制取氧气的化学方程式_____。
(2)实验室制取并收集一瓶二氧化碳气体应选择的装置是_____。
(3)CO2还可以用碳酸氢钠(NaHCO3)加热分解(产物为碳酸钠、二氧化碳和水)来制取,该反应的化学方程式为:_____。
(4)下图为同学利用报废试管设计的制二氧化碳的发生装置,该设计出了废物利用的优点外,请另写一个优点:_____。
若用如下图装置按箭头所示的流向收集一瓶二氧化碳气体,请将集气瓶内的导管补画完整_____。
(5)取溶质质量分数为8.5%的过氧化氢溶液20g倒入烧杯中,在催化剂的作用下使其完全分解,计算理论上共能产生氧气多少克_____?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.A
4.A
5.B
6.D
7.A
8.C
9.C
10.B
11. 47.5mL C B D E A ①②③
12. 500 ③ 过滤不一定是固液分离,过滤实质上是大小颗粒的分离过程等
13.
14.(1) 碘 均一
(2) 不会 稳定
15. KNO3 H2O 40 100 70 20 50
16. 10.0 氢氧化钠 10% 先产生白色浑浊,继续通二氧化碳,溶液又变澄清 一段时间后出现白色沉淀 4632 80
17.(1)碳酸钠溶液显碱性;(2)15.6%
18.(1)4P+5O22P2O5
(2)红磷燃烧是放热反应,气体体积膨胀,压强变大,所以造成BC段气压升高
(3)打开弹簧夹
(4) 65% 解:由图可知,锌与硫酸恰好完全反应时,消耗稀硫酸的质量为50g,设参加反应的硫酸质量为x,则有
所以所用稀硫酸溶液中溶质的质量分数为×100%=19.6%;
答:所用稀硫酸溶液中溶质的质量分数为19.6%。
19. 长颈漏斗 反应物是固体,反应条件是加热 BD 节约药品、可随时控制反应发生或停止 0.8g
答案第1页,共2页
答案第1页,共2页
