沪教版(全国)7.3几种重要的盐同步练习(word版 含答案)
文档属性
| 名称 | 沪教版(全国)7.3几种重要的盐同步练习(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 119.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 00:00:00 | ||
图片预览



文档简介
沪教版(全国) 7.3 几种重要的盐 同步练习
一、单选题
1.下列各物物质在同一溶液中可以大量共存的是
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
2.下列有关化肥或农药的叙述错误的是( )
A.硫酸铵属于复合肥料,所含的营养元素是氮和硫
B.氯化铵和磷矿粉从外观即可区分
C.农药施用后,会通过农作物、农产品等发生转移
D.化肥和农药施用不当,会对环境造成污染
3.硝酸铵是一种氮肥,易溶于水,受热易分解,遇碱时放出氨气,在高温或受猛烈撞击时易爆炸,下列使用硝酸铵的做法不正确的是
A.储存和运输时密封防潮
B.结块时用铁锤砸碎再用
C.施用时不宜与碱混和使用
D.给农作物施肥后及时盖土
4.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
5.下列对化肥的认识不正确的是
A.KNO3是一种复合肥 B.施用氮肥,能促进植物茎叶生长
C.铵态氮肥不能与碱性肥料混合使用 D.化肥能提高粮食产量,施用越多越好
6.化肥对提高农作物的产量有重要作用。下列有关化肥的说法不正确的是
A.提倡农家肥与化肥综合使用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
7.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
8.下列关于碳酸钠与碳酸氢钠的说法错误的是( )
A.溶液呈碱性 B.固体难溶于水
C.“纯碱”是碳酸钠的俗名 D.可用于烘焙糕点
9.小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )
A.CO(NH2)2 B.KCl C.Ca3(PO4)2 D.KNO3
10.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
二、填空题
11.燃烧与人类生产、生活有着密切的关系。
(1)下列成语的原意与燃烧不相关的是____(填标号)。
A 卧薪尝胆 B釜底抽薪
C 火上浇油 D 煽风点火
(2)古籍《天工开物》就有“煤饼烧石成灰”的记载。“烧石成灰”指高温条件下碳酸钙转化为生石灰。
①“煤饼烧石成灰”的过程中,能量转化的主要方式是_______。
②“石”转化为“灰”的反应属于___(填基本反应类型)。
③“灰”遇水成浆,该反应的化学方程式为_____。
(3)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是_____。
12.化学用语是学习化学的重要工具。
(1) 写出下列微粒的化学符号:
①钠原子_______________ ②三氧化二氮分子___________
③5个氢氧根离子____________ ④锌离子_________________
(2) 用下列字母序号填空:
A.明矾 B.碘水 C.氮气 D.碳酸氢钠
①_______用于净水 ②_________用于检验淀粉
③_________用于治疗胃酸过多④__________用作粮食保护气
(3)写出下列反应的化学方程式:
①磷与氧气反应_______________②硫酸铜溶液与氢氧化钙溶液反应______________________
③碳酸钙分解________________________④铜与硝酸银溶液反应___________________________
13.金属及金属材料在生产、生活中有广泛的应用。
(1)我国自主研制的C919大型客机试飞成功,标志着我国飞机制造技术又有了新的突破。飞机外壳的主要材料是铝合金,“铝合金”属于______________(填“金属材料”或“合成材料”)。
(2)金、银在自然界有单质形式存在,说明他们的化学性质都______________,武德合金常用作保险丝,是因为合金的熔点比组成它的纯金属的熔点要______________(填“高”或“低”)。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17A112是特殊的储氢材料,完全吸收氢气后得到MgH2和A1,该反应的化学方程式为______________。
(4)向硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈无色,则滤出的固体一定有______________,滤液中含有的金属离子是______________(写离子符号)。
(5)若锌和镁混合物的质量为4.8g,与100g溶质质量分数为9.8%的稀硫酸恰好完全反应,则生成H2的质量为______________g。
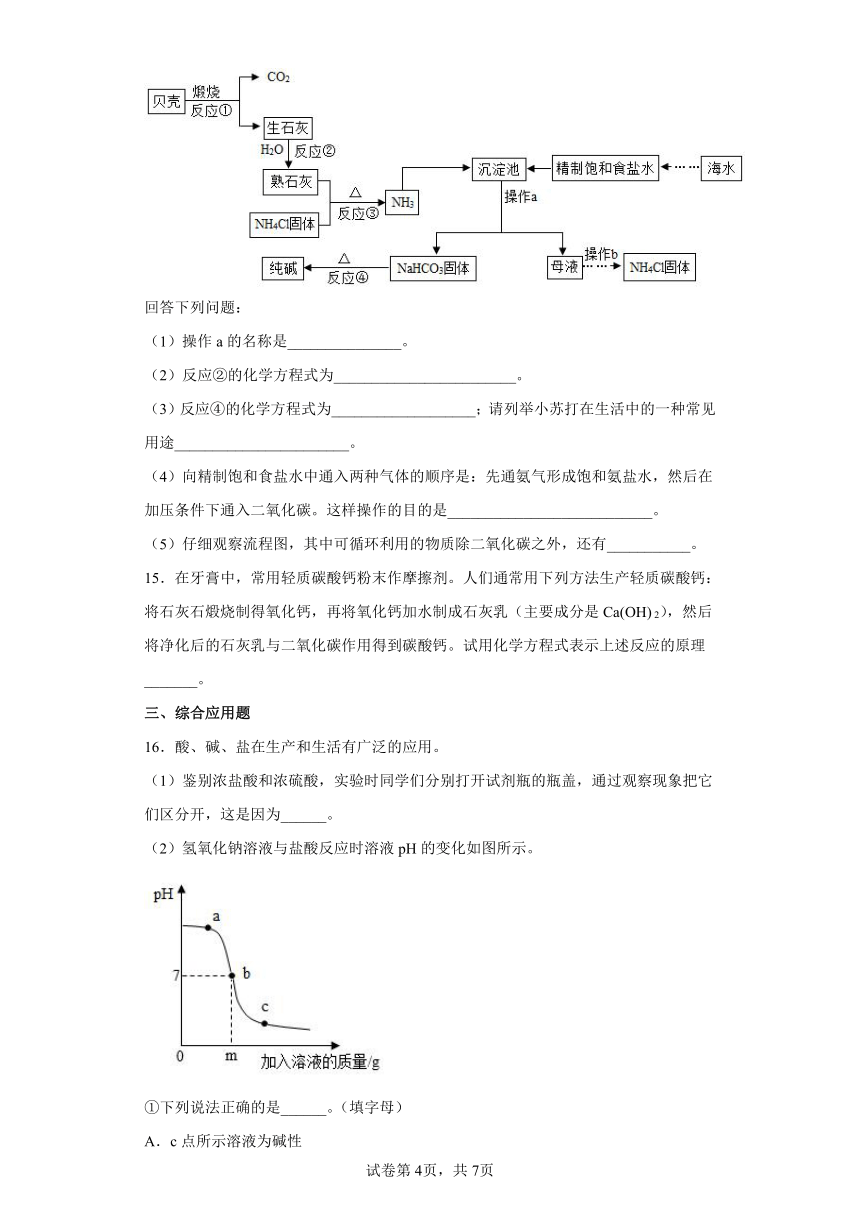
14.南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):
回答下列问题:
(1)操作a的名称是_______________。
(2)反应②的化学方程式为________________________。
(3)反应④的化学方程式为___________________;请列举小苏打在生活中的一种常见用途_______________________。
(4)向精制饱和食盐水中通入两种气体的顺序是:先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。这样操作的目的是___________________________。
(5)仔细观察流程图,其中可循环利用的物质除二氧化碳之外,还有___________。
15.在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生产轻质碳酸钙:将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳(主要成分是Ca(OH) 2),然后将净化后的石灰乳与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理_______。
三、综合应用题
16.酸、碱、盐在生产和生活有广泛的应用。
(1)鉴别浓盐酸和浓硫酸,实验时同学们分别打开试剂瓶的瓶盖,通过观察现象把它们区分开,这是因为______。
(2)氢氧化钠溶液与盐酸反应时溶液pH的变化如图所示。
①下列说法正确的是______。(填字母)
A.c点所示溶液为碱性
B.用氯化镁溶液可以区分a、b、c三点处的溶液
C.a点所示溶液中溶质为NaCl和NaOH
D.该图所对应操作是将氢氧化钠溶液滴入盐酸中
②若将上述实验所用盐酸改为与其溶质质量分数相同的硫酸溶液mg,充分反应后,所得溶液的pH______7(填“>”、“<”或“=”)。
(3)小明同学探究酸碱盐之间反应的实验如图所示。
实验①中观察不到明显现象,不能判断反应是否发生,反思后改进实验,先向氢氧化钠溶液中滴入几滴______;实验后,小明同学将实验②、改进后的实验①中的废液与实验③中静置后的上层清液全部倒入同一只烧杯中,观察到先有气泡产生,后有白色沉淀,过滤得到无色溶液。则无色溶液中可能含有的溶质是______;也可推知实验③反应后的溶液中一定含有______。
17.为了应对新型冠状病毒疫情的蔓延,2020年1月25日,武汉市开始建设火神山和雷神山医院。在医院建设过程中使用了大量金属材料。
(1)铝的金属活动性比铁强,为什么铝制品比铁制品耐腐蚀?_______。
(2)向盛有硝酸亚铁和硝酸银混合溶液的烧杯中,加入一定量的金属Zn,充分反应后过滤,得到滤渣和滤液。
①若滤液为无色,则滤渣的成分是什么?_______。
②若反应后溶液的质量与原溶液的质量一样,请分析原因_______。
(4)如图是实验室模拟冶铁装置图,制取纯净的一氧化碳还原氧化铁并验证气体产物。
①该装置不够完善,从环保的角度写出一种改进的方法_______。
②若没有装置A,对实验有什么影响?_______。
③设计实验证明装置A中溶液的溶质成分_______。(写出实验步骤、现象和结论)。
18.学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH 溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。写出任一个反应的化学方程式______。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是______。
(3)要验证试管②中是否发生复分解反应,小明同学认为即探究试管②溶液中是否还有MgCl2(即Mg2+和CI-)。老师提示会对Cl-的检验有干扰,需要先除去,于是小明根据老师的提示设计了如图实验方案。
①沉淀A的化学式是______。
②老师评价该方案时指出:设计思路正确,但试剂选择有误。你认为应该将步骤Ⅰ的试剂改成______。小明按照修改后的方案进行了实验,最后得出试管②中没有发生复分解反应的结论,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是______。
③小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是______。
19.阅读下列短文,回答问题。
红色经典影片《闪闪的红星》中有一段儿童团员潘东子给红军送盐的故事。冬子开始把食盐装在竹筒中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹筒里的食盐全部溶成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。
(1)从微观角度分析,氯化钠是由______(填“分子”“原子”或“离子”)构成;从元素角度分析,氯化钠溶液中+1价的元素有______(填元素符号)。
(2)从盐水中重新得到食盐固体,需进行操作的名称是______。
(3)氯化钠的溶解度曲线如图。假设冬子的竹筒中有358g氯化钠,10℃时最少需用______g水溶解。
(4)氯化钠在生活中的用途有______(写出1点即可)。
(5)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为______g;
②配制过程有以下步骤;a.称量及量取 b.计算 c.溶解 d.装瓶贴标签,正确顺序是______(填序号);
A.bcad B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为______g。
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.D
2.A
3.B
4.C
5.D
6.C
7.C
8.B
9.D
10.C
11. A 化学能→热能→化学能(或“化学能→热能、热能→化学能”) 分解反应 打开门窗,为可燃物提供更多氧气,使火势更猛(或其他合理答案)
12. Na N2O3 5OH- Zn2+ a b d c 4P+5O22P2O5 CuSO4+Ca(OH)2=Cu(OH)2↓+CaSO4 CaCO3CaO+CO2↑ Cu+2AgNO3=Cu(NO3)2+2Ag
13. 金属材料 稳定 低 Ag、Cu Al3+、Zn2+ 0.2
14. 过滤 CaO + H2O = Ca(OH)2 2NaHCO3Na2CO3+H2O+CO2↑ 作发酵粉的主要成分 使溶液显碱性,与尽量多二氧化碳反应生成更多的碳酸氢钠 氯化铵
15.CaCO3CaO+CO2↑;CaO+H2O=Ca(OH)2; CO2+Ca(OH)2=CaCO3↓+H2O
16. 浓盐酸具有挥发性(答案合理即可) C > 酚酞 CaCl2 NaOH、Ca(OH)2
17. 铝与氧气反应,在表面生成了致密的氧化铅薄膜,阻止了铝进一步被氧化 一定含银、铁,可能含锌 锌与硝酸银反应使溶液的质量减少了,锌与硝酸亚铁反应使溶液的质量增加了,当溶液减少的质量与增加的质量一样时,则溶液的质量不变 在装置的末端放一个燃着的酒精灯或连一个气球 无法验证反应的气体产物 取少量A中溶液于试管中,加入足量的CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,说明溶液中含有碳酸钠;静置,向上层凊液中滴加酚酞溶液,溶液变红,说明溶液含有氢氧化钠
18.(1)或
(2)酚酞试液
(3) 硝酸钡 产生白色沉淀 经过步骤Ⅰ后溶液中有硝酸,会先和氢氧化钠发生反应
19.(1) 离子 Na、H
(2)蒸发
(3)1000
(4)作调味品
(5) 5 B 50
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各物物质在同一溶液中可以大量共存的是
A.NaOH、FeCl3、K2SO4 B.NaCl、HNO3、AgNO3
C.NaCl、K2CO3、Ca(OH)2 D.KNO3、NaCl、Ba(OH)2
2.下列有关化肥或农药的叙述错误的是( )
A.硫酸铵属于复合肥料,所含的营养元素是氮和硫
B.氯化铵和磷矿粉从外观即可区分
C.农药施用后,会通过农作物、农产品等发生转移
D.化肥和农药施用不当,会对环境造成污染
3.硝酸铵是一种氮肥,易溶于水,受热易分解,遇碱时放出氨气,在高温或受猛烈撞击时易爆炸,下列使用硝酸铵的做法不正确的是
A.储存和运输时密封防潮
B.结块时用铁锤砸碎再用
C.施用时不宜与碱混和使用
D.给农作物施肥后及时盖土
4.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
5.下列对化肥的认识不正确的是
A.KNO3是一种复合肥 B.施用氮肥,能促进植物茎叶生长
C.铵态氮肥不能与碱性肥料混合使用 D.化肥能提高粮食产量,施用越多越好
6.化肥对提高农作物的产量有重要作用。下列有关化肥的说法不正确的是
A.提倡农家肥与化肥综合使用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
7.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
8.下列关于碳酸钠与碳酸氢钠的说法错误的是( )
A.溶液呈碱性 B.固体难溶于水
C.“纯碱”是碳酸钠的俗名 D.可用于烘焙糕点
9.小美发现荔枝园旁边的水稻叶子发黄,并倒下了一片,你认为应该向稻田施用的复合肥是( )
A.CO(NH2)2 B.KCl C.Ca3(PO4)2 D.KNO3
10.一澄清透明溶液,可能含有H+、Na+、Ba2+、Fe3+、Cl-、OH-、离子的一种或者几种,为确定溶液中可能存在的离子,进行下面实验:
①经测定,溶液的pH=1;
②取部分样品溶液滴加NaOH溶液,有沉淀生成,继续滴加NaOH溶液至不再产生沉淀为止,过滤;
③向实验②得到的溶液中滴加Na2CO3溶液,又观察到沉淀生成。
分析实验得到的以下结论中,正确的是
A.溶液中一定含有H+、Ba2+、Cl-,一定不含有Na+、Fe3+、OH-、
B.咨液中一定含有H+、Ba2+、Fe3+,一定不含有OH-,可能含有Na+、Cl-、
C.溶液中一定含有H+、Ba2+、Fe3+、Cl-,一定不含有、OH-,可能含有Na+
D.溶液中一定含有H+、Ba2+、Fe3+,一定不含有OH-、,可能含有CI-、Na+
二、填空题
11.燃烧与人类生产、生活有着密切的关系。
(1)下列成语的原意与燃烧不相关的是____(填标号)。
A 卧薪尝胆 B釜底抽薪
C 火上浇油 D 煽风点火
(2)古籍《天工开物》就有“煤饼烧石成灰”的记载。“烧石成灰”指高温条件下碳酸钙转化为生石灰。
①“煤饼烧石成灰”的过程中,能量转化的主要方式是_______。
②“石”转化为“灰”的反应属于___(填基本反应类型)。
③“灰”遇水成浆,该反应的化学方程式为_____。
(3)室内起火时,如果急于打开门窗,火反而会烧得更旺。原因是_____。
12.化学用语是学习化学的重要工具。
(1) 写出下列微粒的化学符号:
①钠原子_______________ ②三氧化二氮分子___________
③5个氢氧根离子____________ ④锌离子_________________
(2) 用下列字母序号填空:
A.明矾 B.碘水 C.氮气 D.碳酸氢钠
①_______用于净水 ②_________用于检验淀粉
③_________用于治疗胃酸过多④__________用作粮食保护气
(3)写出下列反应的化学方程式:
①磷与氧气反应_______________②硫酸铜溶液与氢氧化钙溶液反应______________________
③碳酸钙分解________________________④铜与硝酸银溶液反应___________________________
13.金属及金属材料在生产、生活中有广泛的应用。
(1)我国自主研制的C919大型客机试飞成功,标志着我国飞机制造技术又有了新的突破。飞机外壳的主要材料是铝合金,“铝合金”属于______________(填“金属材料”或“合成材料”)。
(2)金、银在自然界有单质形式存在,说明他们的化学性质都______________,武德合金常用作保险丝,是因为合金的熔点比组成它的纯金属的熔点要______________(填“高”或“低”)。
(3)镁铝合金被誉为“21世纪绿色金属结构材料”。一种镁铝合金Mg17A112是特殊的储氢材料,完全吸收氢气后得到MgH2和A1,该反应的化学方程式为______________。
(4)向硝酸铜、硝酸铝和硝酸银的混合溶液中加入一定量的锌粉,充分反应后过滤,滤液呈无色,则滤出的固体一定有______________,滤液中含有的金属离子是______________(写离子符号)。
(5)若锌和镁混合物的质量为4.8g,与100g溶质质量分数为9.8%的稀硫酸恰好完全反应,则生成H2的质量为______________g。
14.南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):
回答下列问题:
(1)操作a的名称是_______________。
(2)反应②的化学方程式为________________________。
(3)反应④的化学方程式为___________________;请列举小苏打在生活中的一种常见用途_______________________。
(4)向精制饱和食盐水中通入两种气体的顺序是:先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。这样操作的目的是___________________________。
(5)仔细观察流程图,其中可循环利用的物质除二氧化碳之外,还有___________。
15.在牙膏中,常用轻质碳酸钙粉末作摩擦剂。人们通常用下列方法生产轻质碳酸钙:将石灰石煅烧制得氧化钙,再将氧化钙加水制成石灰乳(主要成分是Ca(OH) 2),然后将净化后的石灰乳与二氧化碳作用得到碳酸钙。试用化学方程式表示上述反应的原理_______。
三、综合应用题
16.酸、碱、盐在生产和生活有广泛的应用。
(1)鉴别浓盐酸和浓硫酸,实验时同学们分别打开试剂瓶的瓶盖,通过观察现象把它们区分开,这是因为______。
(2)氢氧化钠溶液与盐酸反应时溶液pH的变化如图所示。
①下列说法正确的是______。(填字母)
A.c点所示溶液为碱性
B.用氯化镁溶液可以区分a、b、c三点处的溶液
C.a点所示溶液中溶质为NaCl和NaOH
D.该图所对应操作是将氢氧化钠溶液滴入盐酸中
②若将上述实验所用盐酸改为与其溶质质量分数相同的硫酸溶液mg,充分反应后,所得溶液的pH______7(填“>”、“<”或“=”)。
(3)小明同学探究酸碱盐之间反应的实验如图所示。
实验①中观察不到明显现象,不能判断反应是否发生,反思后改进实验,先向氢氧化钠溶液中滴入几滴______;实验后,小明同学将实验②、改进后的实验①中的废液与实验③中静置后的上层清液全部倒入同一只烧杯中,观察到先有气泡产生,后有白色沉淀,过滤得到无色溶液。则无色溶液中可能含有的溶质是______;也可推知实验③反应后的溶液中一定含有______。
17.为了应对新型冠状病毒疫情的蔓延,2020年1月25日,武汉市开始建设火神山和雷神山医院。在医院建设过程中使用了大量金属材料。
(1)铝的金属活动性比铁强,为什么铝制品比铁制品耐腐蚀?_______。
(2)向盛有硝酸亚铁和硝酸银混合溶液的烧杯中,加入一定量的金属Zn,充分反应后过滤,得到滤渣和滤液。
①若滤液为无色,则滤渣的成分是什么?_______。
②若反应后溶液的质量与原溶液的质量一样,请分析原因_______。
(4)如图是实验室模拟冶铁装置图,制取纯净的一氧化碳还原氧化铁并验证气体产物。
①该装置不够完善,从环保的角度写出一种改进的方法_______。
②若没有装置A,对实验有什么影响?_______。
③设计实验证明装置A中溶液的溶质成分_______。(写出实验步骤、现象和结论)。
18.学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH 溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。写出任一个反应的化学方程式______。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是______。
(3)要验证试管②中是否发生复分解反应,小明同学认为即探究试管②溶液中是否还有MgCl2(即Mg2+和CI-)。老师提示会对Cl-的检验有干扰,需要先除去,于是小明根据老师的提示设计了如图实验方案。
①沉淀A的化学式是______。
②老师评价该方案时指出:设计思路正确,但试剂选择有误。你认为应该将步骤Ⅰ的试剂改成______。小明按照修改后的方案进行了实验,最后得出试管②中没有发生复分解反应的结论,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是______。
③小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是______。
19.阅读下列短文,回答问题。
红色经典影片《闪闪的红星》中有一段儿童团员潘东子给红军送盐的故事。冬子开始把食盐装在竹筒中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹筒里的食盐全部溶成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。
(1)从微观角度分析,氯化钠是由______(填“分子”“原子”或“离子”)构成;从元素角度分析,氯化钠溶液中+1价的元素有______(填元素符号)。
(2)从盐水中重新得到食盐固体,需进行操作的名称是______。
(3)氯化钠的溶解度曲线如图。假设冬子的竹筒中有358g氯化钠,10℃时最少需用______g水溶解。
(4)氯化钠在生活中的用途有______(写出1点即可)。
(5)某同学配制50g溶质质量分数为10%的氯化钠溶液。
①需要固体氯化钠的质量为______g;
②配制过程有以下步骤;a.称量及量取 b.计算 c.溶解 d.装瓶贴标签,正确顺序是______(填序号);
A.bcad B.bacd
③将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为______g。
试卷第1页,共3页
试卷第2页,共2页
参考答案:
1.D
2.A
3.B
4.C
5.D
6.C
7.C
8.B
9.D
10.C
11. A 化学能→热能→化学能(或“化学能→热能、热能→化学能”) 分解反应 打开门窗,为可燃物提供更多氧气,使火势更猛(或其他合理答案)
12. Na N2O3 5OH- Zn2+ a b d c 4P+5O22P2O5 CuSO4+Ca(OH)2=Cu(OH)2↓+CaSO4 CaCO3CaO+CO2↑ Cu+2AgNO3=Cu(NO3)2+2Ag
13. 金属材料 稳定 低 Ag、Cu Al3+、Zn2+ 0.2
14. 过滤 CaO + H2O = Ca(OH)2 2NaHCO3Na2CO3+H2O+CO2↑ 作发酵粉的主要成分 使溶液显碱性,与尽量多二氧化碳反应生成更多的碳酸氢钠 氯化铵
15.CaCO3CaO+CO2↑;CaO+H2O=Ca(OH)2; CO2+Ca(OH)2=CaCO3↓+H2O
16. 浓盐酸具有挥发性(答案合理即可) C > 酚酞 CaCl2 NaOH、Ca(OH)2
17. 铝与氧气反应,在表面生成了致密的氧化铅薄膜,阻止了铝进一步被氧化 一定含银、铁,可能含锌 锌与硝酸银反应使溶液的质量减少了,锌与硝酸亚铁反应使溶液的质量增加了,当溶液减少的质量与增加的质量一样时,则溶液的质量不变 在装置的末端放一个燃着的酒精灯或连一个气球 无法验证反应的气体产物 取少量A中溶液于试管中,加入足量的CaCl2溶液(或BaCl2溶液等),有白色沉淀生成,说明溶液中含有碳酸钠;静置,向上层凊液中滴加酚酞溶液,溶液变红,说明溶液含有氢氧化钠
18.(1)或
(2)酚酞试液
(3) 硝酸钡 产生白色沉淀 经过步骤Ⅰ后溶液中有硝酸,会先和氢氧化钠发生反应
19.(1) 离子 Na、H
(2)蒸发
(3)1000
(4)作调味品
(5) 5 B 50
答案第1页,共2页
答案第1页,共2页
