沪教版(全国)6.3物质的溶解性同步练习(word版有答案)
文档属性
| 名称 | 沪教版(全国)6.3物质的溶解性同步练习(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 189.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-28 00:00:00 | ||
图片预览



文档简介
沪教版(全国) 6.3 物质的溶解性 同步练习
一、单选题
1.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
2.如图是甲、乙两物质的溶解度曲线,下列说法正确的是
A.t2℃时,甲的溶解度为50
B.甲、乙的溶解度都随温度的升高而增大
C.将甲溶液从t2℃降温至t1℃,一定有晶体析出
D.t1℃时,甲、乙两种饱和溶液 的溶质质量分数相等
3.如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.甲的溶解度等于乙的溶解度
B.升高温度可将甲的不饱和溶液变为饱和溶液
C.20℃时,100g乙的饱和溶液中溶质质量是30g
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
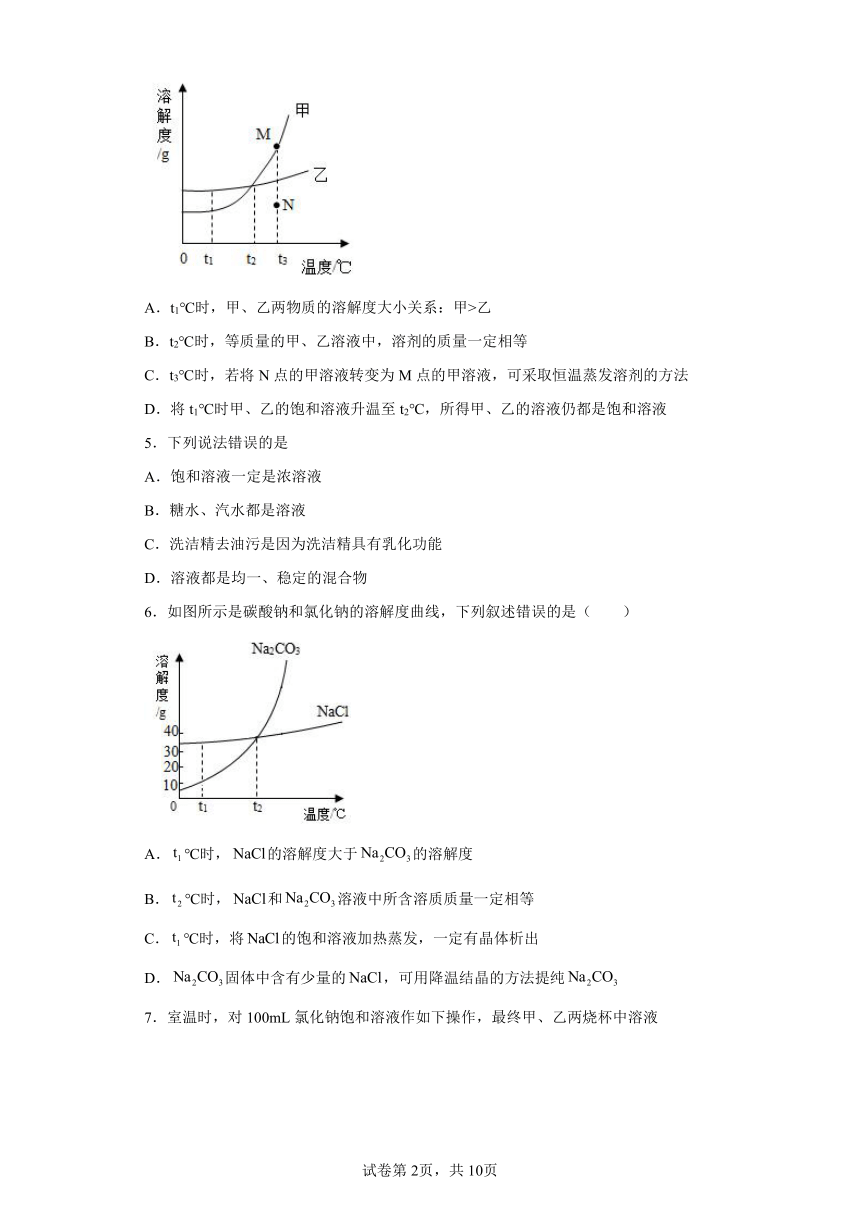
4.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1℃时甲、乙的饱和溶液升温至t2℃,所得甲、乙的溶液仍都是饱和溶液
5.下列说法错误的是
A.饱和溶液一定是浓溶液
B.糖水、汽水都是溶液
C.洗洁精去油污是因为洗洁精具有乳化功能
D.溶液都是均一、稳定的混合物
6.如图所示是碳酸钠和氯化钠的溶解度曲线,下列叙述错误的是( )
A.℃时,的溶解度大于的溶解度
B.℃时,和溶液中所含溶质质量一定相等
C.℃时,将的饱和溶液加热蒸发,一定有晶体析出
D.固体中含有少量的,可用降温结晶的方法提纯
7.室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液
A.溶质质量相同 B.溶质质量分数相同
C.均为不饱和溶液 D.溶剂质量相同
8.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
9.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
10.图1为甲、乙、丙三种固体的溶解度曲线,某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,下列说法正确的是
A.t3℃时,丙的饱和溶液不能再继续溶解乙物质
B.A、B、C溶液中,B的溶液溶质质量分数最大
C.将相同温度下的A、B、C三种溶液降温到t1℃,B析出晶体最多
D.A、B、C三种溶液中,只有B是饱和溶液
二、填空题
11.烧杯中盛有一定质量、温度为、溶质为的溶液,将其置于室温环境中,测定不同温度时析出固体的质量。测定结果记录如下表:
溶液的温度/ 75 65 50 35 20
析出固体的质量/ 0 0 2.0 4.5 8.4
若不考虑水蒸发对实验的影响,请回答下列问题:
(1)时,该溶液是否为饱和溶液?______(选填“是”、“否”或“无法判断”)。
(2)将时接近饱和的溶液变成饱和溶液,下列方法中一定能达到目的的有______(填序号)。
①升温 ②降温 ③加溶质 ④加水 ⑤加另一种固体 ⑥恒温蒸发水 ⑦与时的饱和溶液混合
(3)分析表中的数据可知的溶解性受温度影响的情况是______。
12.下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答
温度/℃ 20 30 40 50 60
溶解度/g NaCl 36.0 36.3 36.6 37.0 37.3
KNO3 31.6 45.8 63.9 85.5 110
(1)60℃时,氯化钠的溶解度为___________g。
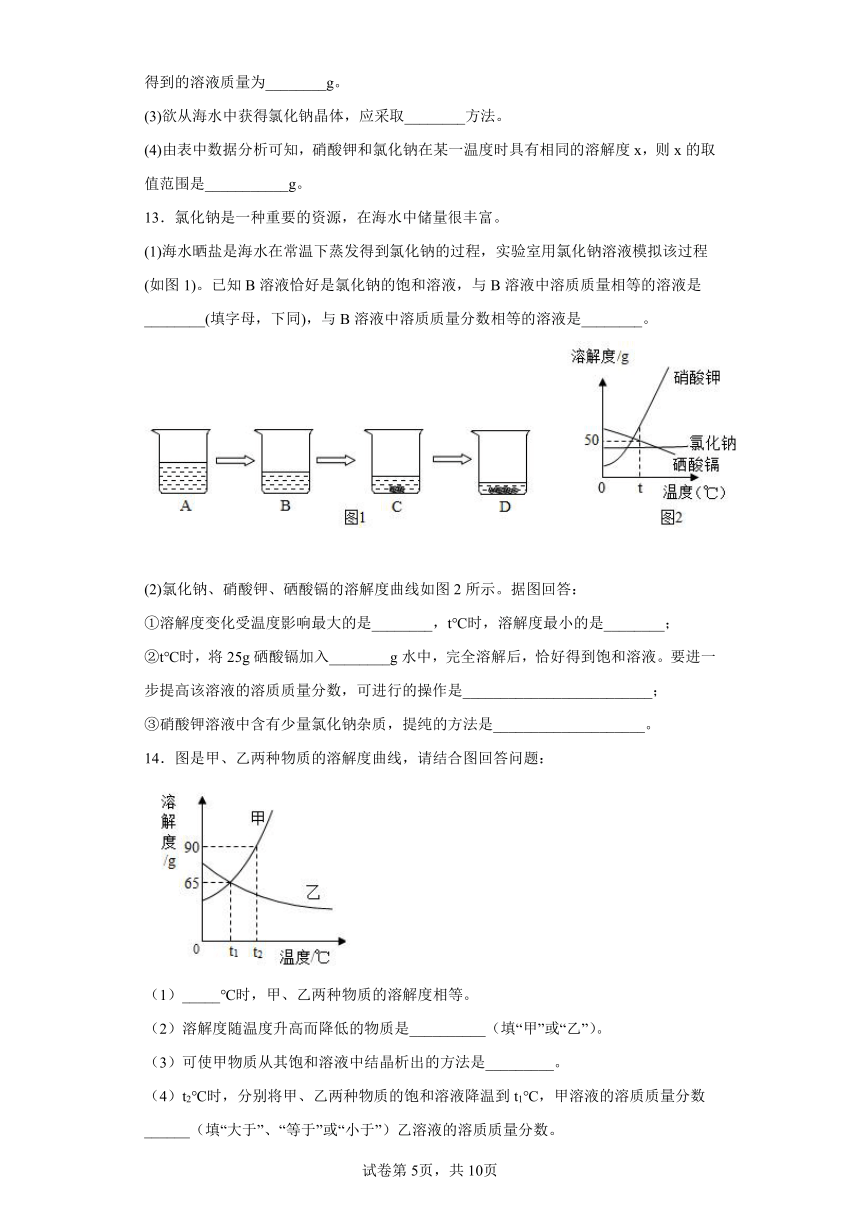
(2)在30℃时,硝酸钾的溶解度为_________g,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为________g。
(3)欲从海水中获得氯化钠晶体,应采取________方法。
(4)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范围是___________g。
13.氯化钠是一种重要的资源,在海水中储量很丰富。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程(如图1)。已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是________(填字母,下同),与B溶液中溶质质量分数相等的溶液是________。
(2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图2所示。据图回答:
①溶解度变化受温度影响最大的是________,t℃时,溶解度最小的是________;
②t℃时,将25g硒酸镉加入________g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是_________________________;
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是____________________。
14.图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
(1)_____℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是__________(填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是_________。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数______(填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行以下实验:
①实验过程中,B、C、D对应的溶液为不饱和溶液的是____________________。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是________________________________________。
15.如图为A、B、C三种固体物质的溶解度曲线。
(1)在_______℃时,A、C两种物质的溶解度相等。
(2)将t1℃ 时B物质的饱和溶液升温到t3℃,溶液中溶质的质量分数_______(选填“变大”、“变小”、“不变”)
(3)在t3℃时,A、B、C三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是_______。
三、综合应用题
16.如图是a、b、c三种物质的溶解度曲线,请回答下列问题:
(1)t2℃时,a、b、c三种物质的溶解度从大到小依次是:______
(2)P点表示:______
(3)将c的饱和溶液变为不饱和溶液,可采用的方法是:______
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是:______
(5)将300gt2℃时的a物质饱和溶液降温到t1℃,析出晶体的质量是:______。
17.水和溶液在生产、生活中起着十分重要的作用。
(1)如图所示,三个实验均和水有关。
①请指出实验 A 中过滤操作的两处错误:_____________、____________。
②实验 B 能说明 CO2 可溶于水,并写出发生反应的化学方程式为_____。
③实验 C,滴加水后能看到 U 形管中_____(填“左边”或“右边”)液面升高。
(2)下面是利用海水提取粗盐的过程。
下列分析正确的是(填序号)_____。
A海水进入贮水池,海水的成分基本不变
B在蒸发池中,海水中氯化钠的质量逐渐增加
C在蒸发池中,海水中水的质量逐渐减少
D析出晶体后的母液是氯化钠的不饱和溶液
(3)农业上常用溶质质量分数为 16%的氯化钠溶液来选种,良种会下沉,次种会漂浮。
①室温下氯化钠的溶解度约为 36g。上述选种用的氯化钠溶液是_____(填“饱和”或 “不饱和”)溶液。
②若用溶质质量分数为 24%的氯化钠溶液和蒸馏水来配制 300g 溶质质量分数为 16%的氯 化钠溶液,则需要蒸馏水的质量为_____。
(4)如图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①下列说法一定正确的是______________。
A甲的溶解度比乙的溶解度大
Bt1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C常温下,乙易溶于水
D从 t2℃降至 t1℃,甲、乙溶液中均有晶体析出
②甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓 缩,___________,然后过滤。
18.如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是 _______
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是_______小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,你认为出现这种现象的原因是_______
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为_______g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为_______使固体质量m1偏大,从而会使测定结果偏_______。
(5)最后一致同意按如下方案进行实验:
①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠完全反应(MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是_______
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,则m2=____g
19.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.D
4.C
5.A
6.B
7.A
8.D
9.B
10.D
11.(1)无法判断
(2)②③⑥
(3)一定量的水中,温度越高,M在水中溶解得越多
12. 37.3 45.8 145.8 蒸发结晶(或蒸发溶剂) 36.013. A C、D 硝酸钾 氯化钠 50 降低温度并加入硒酸镉 降温结晶法(或冷却热饱和溶液)
14. t1 乙 降温结晶 大于 B 甲物质溶于水时会放出热量,使溶液温度升高,甲物质的溶解度增大
15. t1 不变 C>B>A
16. a>b>c t1℃时,a、c物质的溶解度相等 降低温度 b>a>c 60g
17. 未使用玻璃棒引流 漏斗下端管口未紧贴烧杯内壁 右边 AC 不饱和 100g BC 冷却结晶
18. 37.5% 20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g 氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解 (150- m1) 过滤所得的氢氧化钠固体附带氢氧化钠溶液 小 不再产生白色沉淀 7.9
19.(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
答案第1页,共2页
答案第1页,共2页
一、单选题
1.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
2.如图是甲、乙两物质的溶解度曲线,下列说法正确的是
A.t2℃时,甲的溶解度为50
B.甲、乙的溶解度都随温度的升高而增大
C.将甲溶液从t2℃降温至t1℃,一定有晶体析出
D.t1℃时,甲、乙两种饱和溶液 的溶质质量分数相等
3.如图是甲、乙两种固体的溶解度曲线,下列说法正确的是( )
A.甲的溶解度等于乙的溶解度
B.升高温度可将甲的不饱和溶液变为饱和溶液
C.20℃时,100g乙的饱和溶液中溶质质量是30g
D.40℃时,分别用100g水配制甲、乙的饱和溶液,所需甲的质量大于乙的质量
4.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1℃时甲、乙的饱和溶液升温至t2℃,所得甲、乙的溶液仍都是饱和溶液
5.下列说法错误的是
A.饱和溶液一定是浓溶液
B.糖水、汽水都是溶液
C.洗洁精去油污是因为洗洁精具有乳化功能
D.溶液都是均一、稳定的混合物
6.如图所示是碳酸钠和氯化钠的溶解度曲线,下列叙述错误的是( )
A.℃时,的溶解度大于的溶解度
B.℃时,和溶液中所含溶质质量一定相等
C.℃时,将的饱和溶液加热蒸发,一定有晶体析出
D.固体中含有少量的,可用降温结晶的方法提纯
7.室温时,对100mL氯化钠饱和溶液作如下操作,最终甲、乙两烧杯中溶液
A.溶质质量相同 B.溶质质量分数相同
C.均为不饱和溶液 D.溶剂质量相同
8.下列有关溶液的说法错误的是
A.泥土与水混合不能形成溶液
B.硝酸铵溶于水能使水温降低
C.升高温度可使大多数固体物质的饱和溶液变为不饱和溶液
D.饱和溶液的溶质质量分数一定大于不饱和溶液
9.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
10.图1为甲、乙、丙三种固体的溶解度曲线,某同学按图Ⅱ所示进行实验,得到相应温度下的A、B、C三种溶液,下列说法正确的是
A.t3℃时,丙的饱和溶液不能再继续溶解乙物质
B.A、B、C溶液中,B的溶液溶质质量分数最大
C.将相同温度下的A、B、C三种溶液降温到t1℃,B析出晶体最多
D.A、B、C三种溶液中,只有B是饱和溶液
二、填空题
11.烧杯中盛有一定质量、温度为、溶质为的溶液,将其置于室温环境中,测定不同温度时析出固体的质量。测定结果记录如下表:
溶液的温度/ 75 65 50 35 20
析出固体的质量/ 0 0 2.0 4.5 8.4
若不考虑水蒸发对实验的影响,请回答下列问题:
(1)时,该溶液是否为饱和溶液?______(选填“是”、“否”或“无法判断”)。
(2)将时接近饱和的溶液变成饱和溶液,下列方法中一定能达到目的的有______(填序号)。
①升温 ②降温 ③加溶质 ④加水 ⑤加另一种固体 ⑥恒温蒸发水 ⑦与时的饱和溶液混合
(3)分析表中的数据可知的溶解性受温度影响的情况是______。
12.下表是氯化钠和硝酸钾在不同温度时的溶解度,根据此表回答
温度/℃ 20 30 40 50 60
溶解度/g NaCl 36.0 36.3 36.6 37.0 37.3
KNO3 31.6 45.8 63.9 85.5 110
(1)60℃时,氯化钠的溶解度为___________g。
(2)在30℃时,硝酸钾的溶解度为_________g,100g水中加入50g硝酸钾,充分搅拌后得到的溶液质量为________g。
(3)欲从海水中获得氯化钠晶体,应采取________方法。
(4)由表中数据分析可知,硝酸钾和氯化钠在某一温度时具有相同的溶解度x,则x的取值范围是___________g。
13.氯化钠是一种重要的资源,在海水中储量很丰富。
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程,实验室用氯化钠溶液模拟该过程(如图1)。已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是________(填字母,下同),与B溶液中溶质质量分数相等的溶液是________。
(2)氯化钠、硝酸钾、硒酸镉的溶解度曲线如图2所示。据图回答:
①溶解度变化受温度影响最大的是________,t℃时,溶解度最小的是________;
②t℃时,将25g硒酸镉加入________g水中,完全溶解后,恰好得到饱和溶液。要进一步提高该溶液的溶质质量分数,可进行的操作是_________________________;
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是____________________。
14.图是甲、乙两种物质的溶解度曲线,请结合图回答问题:
(1)_____℃时,甲、乙两种物质的溶解度相等。
(2)溶解度随温度升高而降低的物质是__________(填“甲”或“乙”)。
(3)可使甲物质从其饱和溶液中结晶析出的方法是_________。
(4)t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲溶液的溶质质量分数______(填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(5)小明同学用甲物质进行以下实验:
①实验过程中,B、C、D对应的溶液为不饱和溶液的是____________________。
②向B对应的溶液中再加入30g甲固体的过程中,发现固体全部溶解,一段时间后又有部分固体析出。你认为“全部溶解”的原因是________________________________________。
15.如图为A、B、C三种固体物质的溶解度曲线。
(1)在_______℃时,A、C两种物质的溶解度相等。
(2)将t1℃ 时B物质的饱和溶液升温到t3℃,溶液中溶质的质量分数_______(选填“变大”、“变小”、“不变”)
(3)在t3℃时,A、B、C三种物质的饱和溶液各100g,所含溶剂的质量由大到小的顺序是_______。
三、综合应用题
16.如图是a、b、c三种物质的溶解度曲线,请回答下列问题:
(1)t2℃时,a、b、c三种物质的溶解度从大到小依次是:______
(2)P点表示:______
(3)将c的饱和溶液变为不饱和溶液,可采用的方法是:______
(4)将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是:______
(5)将300gt2℃时的a物质饱和溶液降温到t1℃,析出晶体的质量是:______。
17.水和溶液在生产、生活中起着十分重要的作用。
(1)如图所示,三个实验均和水有关。
①请指出实验 A 中过滤操作的两处错误:_____________、____________。
②实验 B 能说明 CO2 可溶于水,并写出发生反应的化学方程式为_____。
③实验 C,滴加水后能看到 U 形管中_____(填“左边”或“右边”)液面升高。
(2)下面是利用海水提取粗盐的过程。
下列分析正确的是(填序号)_____。
A海水进入贮水池,海水的成分基本不变
B在蒸发池中,海水中氯化钠的质量逐渐增加
C在蒸发池中,海水中水的质量逐渐减少
D析出晶体后的母液是氯化钠的不饱和溶液
(3)农业上常用溶质质量分数为 16%的氯化钠溶液来选种,良种会下沉,次种会漂浮。
①室温下氯化钠的溶解度约为 36g。上述选种用的氯化钠溶液是_____(填“饱和”或 “不饱和”)溶液。
②若用溶质质量分数为 24%的氯化钠溶液和蒸馏水来配制 300g 溶质质量分数为 16%的氯 化钠溶液,则需要蒸馏水的质量为_____。
(4)如图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①下列说法一定正确的是______________。
A甲的溶解度比乙的溶解度大
Bt1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C常温下,乙易溶于水
D从 t2℃降至 t1℃,甲、乙溶液中均有晶体析出
②甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓 缩,___________,然后过滤。
18.如图所示是氢氧化钠的溶解度曲线,请回答下列问题:
(1)t℃时氢氧化钠饱和溶液的溶质质量分数是 _______
(2)室温为20℃时,小芳同学向100g20℃的水中加入150g氢氧化钠,发现氢氧化钠全部溶解,于是对此曲线的准确性提出了质疑,其理由是_______小明同学经过认真分析后对出现上述现象的原因作出了合理的解释,你认为出现这种现象的原因是_______
(3)他们想继续测定室温(20℃)时氢氧化钠的溶解度,小芳提出:将(2)中所得溶液冷却到20℃、过滤、干燥、称量固体质量为m1g,由此得出室温(20℃)时氢氧化钠的溶解度为_______g。
交流与反思:
(4)经讨论他们发现上述方案从操作的角度看,是因为_______使固体质量m1偏大,从而会使测定结果偏_______。
(5)最后一致同意按如下方案进行实验:
①将(2)中所得溶液冷却到20℃后,取溶液20.9g,向其中慢慢滴加MgCl2溶液至氢氧化钠完全反应(MgCl2+2NaOH=2NaCl+Mg(OH)2↓),表明氢氧化钠也完全反应的现象是_______
②过滤、洗涤、干燥、称量得固体质量为m2g,从而计算出室温(20℃)时氢氧化钠的溶解度,若室温(20℃)时氢氧化钠的溶解度确实为109g,则m2=____g
19.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.D
4.C
5.A
6.B
7.A
8.D
9.B
10.D
11.(1)无法判断
(2)②③⑥
(3)一定量的水中,温度越高,M在水中溶解得越多
12. 37.3 45.8 145.8 蒸发结晶(或蒸发溶剂) 36.0
14. t1 乙 降温结晶 大于 B 甲物质溶于水时会放出热量,使溶液温度升高,甲物质的溶解度增大
15. t1 不变 C>B>A
16. a>b>c t1℃时,a、c物质的溶解度相等 降低温度 b>a>c 60g
17. 未使用玻璃棒引流 漏斗下端管口未紧贴烧杯内壁 右边 AC 不饱和 100g BC 冷却结晶
18. 37.5% 20℃时氢氧化钠溶解度为109g,100g20℃的水中最多可溶解氢氧化钠的质量为109g 氢氧化钠溶于水放热,使水温升高,氢氧化钠溶解度增大,使氢氧化钠全部溶解 (150- m1) 过滤所得的氢氧化钠固体附带氢氧化钠溶液 小 不再产生白色沉淀 7.9
19.(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
答案第1页,共2页
答案第1页,共2页
