第七章 第二节 常见的酸和碱
图片预览










文档简介
课件54张PPT。第二节
常见的酸和碱学习流程1、温故知新
2、静心自学
3、交流提升
4、实验探究
5、当堂反馈 红色红色蓝色无色 紫色 无色 温故知新学习目标:1.通过观察认识常见酸碱的主要性质和用途,知道酸碱的腐蚀性。
2.初步学会常见酸碱溶液的稀释方法。
3.通过实验认识并归纳常见的酸和碱的化学性质。静心自学阅读P185-188标题一正文及活动与探究、交流与讨论、拓展视野部分。
归纳常见的酸的物理性质和化学性质及用途。 你已经知道哪些酸和碱?了解它们的性质吗?它们在生产、生活中有哪些应用? 交流讨论:1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、酸雨里含有什么酸?1、人的胃液里含有盐酸;
2、汽车电瓶里含有硫酸;
3、食醋里含有醋酸,也叫乙酸;
4、酸雨里含有亚硫酸,也可能含有硝酸。活动探究一:
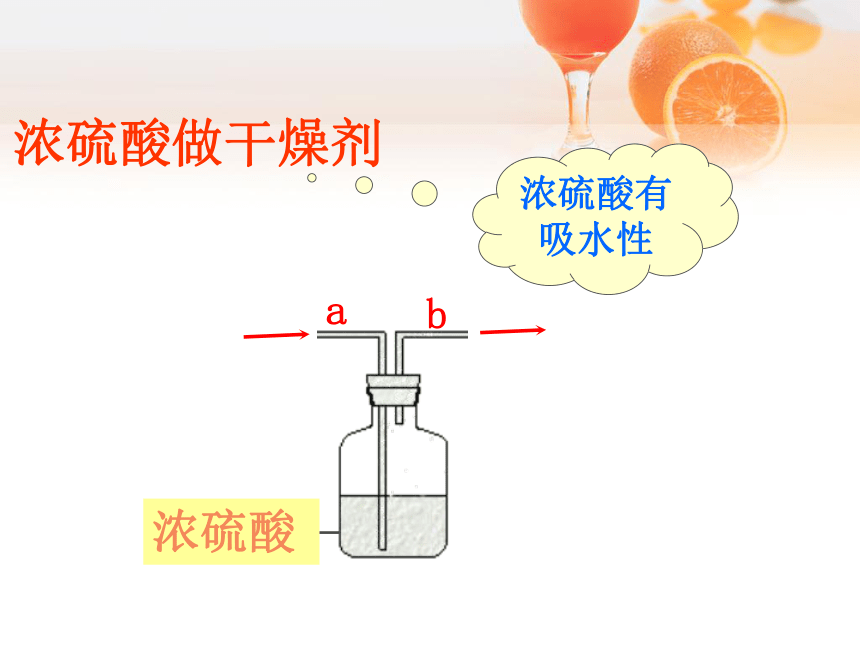
浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法[ 实验10-2]无色液体无色;粘稠、油状、液体有白雾出现无现象有刺激性气味无气味1.19g/mL1.84g/mL浓硫酸做干燥剂浓硫酸有吸水性浓盐酸和浓硫酸应 保存,否则浓盐酸溶质质量变 ,浓硫酸溶剂质量变 。密封大小交流讨论:活动探究三、
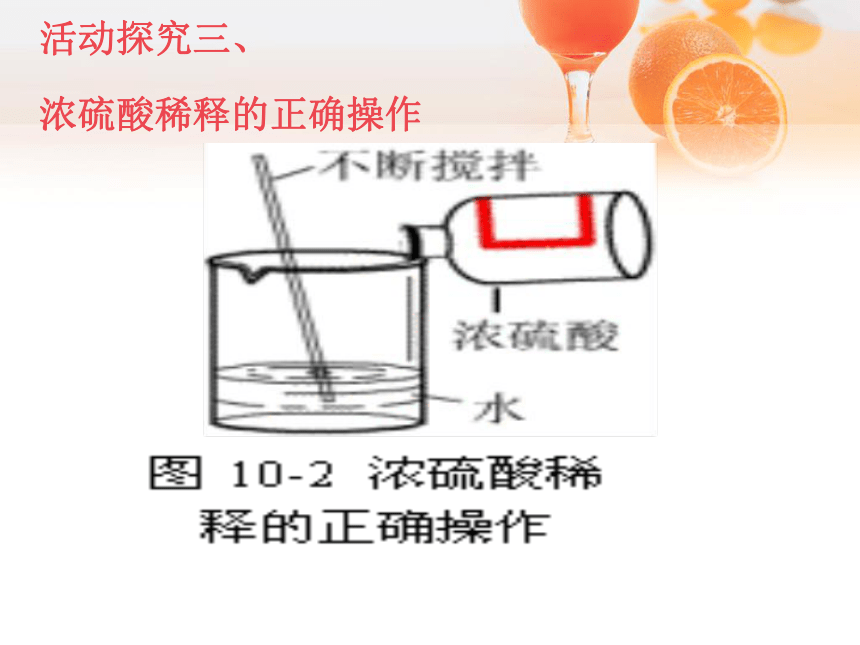
浓硫酸稀释的正确操作
[实验10-5]浓硫酸稀释的错误操作。实验时水一定要缓慢滴入锥形瓶,否则锥形瓶底会因冷、热不均而裂掉。图10-5 浓硫酸稀释的错误操作活动探究二、
浓硫酸的腐蚀性浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。 如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理? 如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理? 交流讨论:活动探究四、
酸的化学性质⒈ 酸溶液能与指示剂反应:结论:⒉ 酸溶液能与某些金属反应:
回顾并写出下列反应原理及现象,总结反应规律结论:⒊ 酸溶液能与金属氧化物反应:结论: 除铁锈时用稀盐酸还是用浓盐酸?为什么? 用稀盐酸除铁锈时会发生哪些反应? 通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?
请将你所知道的与同学们交流、讨论。酸的化学性质跟指示剂的反应
跟金属的反应
跟金属氧化物的反应盐酸用途胃液中含盐酸帮助消化硫酸用途浓硫酸做干燥剂浓硫酸有吸水性当堂反馈1,下列物质露置于空气中,溶液会增加的是:
( )
A 浓盐酸 B 蔗糖 C 浓硫酸 D 氯化钠溶液2,请你写出下列化学反应方程式
铁锈与稀硫酸反_____________________
人体内缺铁元素会引起贫血,可以服用少量铁粉来补充________________________3、如用稀盐酸或稀硫酸清除铁锈,能否长时间浸在酸中
4.下列说法错误的是 ( )
A.浓盐酸和浓硫酸都应该密封保存,因为它们都有挥发性
B.人的胃液中含有少量盐酸,可以促进食欲帮助消化
C.盐酸和硫酸都可以用于金属除锈
D.稀释浓硫酸时,一定要沿烧杯壁将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌
A 5.小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如右图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是( )
A.紫色 B.蓝色
C.红色 D.无色A第二课时
常见的碱你去尝一个未成熟的柿子,会有什么感觉?这是因为柿子里含有碱性物质生活中的碱像氢氧化镁和氢氧化铝那样的碱可以治疗对人体不利的胃酸过多症。工业中的碱石灰浆和水泥是用碱性
氢氧化钙制取的静心自学阅读P189-190标题一正文及活动与探究、交流与讨论、拓展视野部分。找出下列问题答案:
1.常见的碱指的是什么?化学式是什么?
2.氢氧化钙、氢氧化钠俗名是什么?
它们有什么用途?氢氧化钙是怎么制取的?
3.写出下列物质的主要成分的化学式:
石灰石 石灰水
生石灰 熟石灰 CaCO3CaOCa(OH)2Ca(OH)2观察固体烧碱、消石灰的颜色、状态,在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。碱的性质实验记录活动探究一:在试管中加一些固体氢氧化钠,加入水,振荡,观察它的溶解过程,并摸一摸试管,感觉溶液温度的变化。碱的性质实验记录活动探究二归纳总结 NaOH有强烈的腐蚀性,所以,它的俗名叫做苛性钠、火碱或烧碱。 如果不慎将碱液沾到皮肤上,应如何处理?注意!
在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。肥 皂石 油造 纸纺 织印 染含NaOH氢氧化钙的制法生石灰与水反应
CaO + H2O = Ca(OH)2反应放出大量的热在试管中加一些固体氢氧化钙,加入水,振荡,观察它的溶解过程。碱的性质实验记录活动探究二归纳与小结交流讨论:
氢氧化钠、氢氧化钙在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。碱的共同性质由于碱电离后都能生成OH-,因此也具有相同的性质。(1)与酸碱指示剂作用
A.紫色石蕊试剂遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红注:可溶性的碱才具有这样的性质 思考1、如何检验二氧化碳气体?写出化学方程式。
2、除去混合气体中的二氧化碳,用什么吸收好?写出相应的化学方程式。3、以上信息,你能总结出碱具有什么化学性质吗?请用通式表示。4、写出SO2、SO3分别和NaOH、Ca(OH)2发生反应的化学方程式。(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + SO2 == CaSO3↓ + H2O; 思考:非金属氧化物与碱的反应属于基本反应类型吗?为什么氢氧化钠固体要密封保存?思考1、写出氢氧化铜与硫酸、氢氧化铁与盐酸反应的化学方程式。
2、以上事实说明碱具有什么化学性质?
3、什么是中和反应?它与复分解反应有何关系?(3)与酸反应(中和反应)
碱 + 酸 → 盐 + 水
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O; 1、在硫酸铜溶液中滴加氢氧化钠溶液。
2、在氯化铁溶液中滴加氢氧化钠溶液。
3、在碳酸钠溶液中滴加石灰水。
4、在硫酸铜溶液中滴加石灰水。探究四:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOHCuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3 == 2NaOH + CaCO3↓请观察下面的化学方程式有什么特点,请归纳出它们的一些规律。化合物 化合物 化合物 化合物交换成分交流讨论:复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
可以用:AB + CD == AD + CB 表示
特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。当堂反馈1.碱溶液有相似的化学性质的原因是碱溶液中都含有( )
A.氢离子
B.氢氧根离子
C.金属离子
D.酸根离子B 练习一1、氢氧化钠是 色 体。 溶于水,溶解时放出 。2、固体氢氧化钠在空气中易 水分,而 ,所以它可以做为某些气体的 。 3、氢氧化钠有强烈的 性,所以它又叫 、 、 。 白固极易大量的热吸收潮解干燥剂腐蚀烧碱火碱苛性钠1、下列物质中,既可以降低土壤的酸性,又可用于配制农药波尔多液的是 ( )
A.氢氧化钠 B.氢氧化钙 C.胆矾 D.食盐
2、下珍关于氢氧化钠的描述中错误的是( )
A、易溶于水,溶解时放出大量的热
B、对皮肤有强烈的腐蚀作用
C、水溶液能使石蕊试液变红
D、能除去油污,可做厨房清洁剂练习B C4、下列气体中,可以用氢氧化钠干燥的是
(A)H2 (B)SO2 (C)CO2 (D)HCl
A5、下列物质暴露在空气中,质量增加并且变质的是
(A)浓硫酸 (B)火碱 (C)水 (D)浓盐酸
B6、下列关于氢氧化钠的叙述不下确的是( )A.露置于空气中易变质
B.能使紫色石蕊溶液变蓝色
C.溶于水时放出热量
D.能做治疗胃酸过多的药物D
2、静心自学
3、交流提升
4、实验探究
5、当堂反馈 红色红色蓝色无色 紫色 无色 温故知新学习目标:1.通过观察认识常见酸碱的主要性质和用途,知道酸碱的腐蚀性。
2.初步学会常见酸碱溶液的稀释方法。
3.通过实验认识并归纳常见的酸和碱的化学性质。静心自学阅读P185-188标题一正文及活动与探究、交流与讨论、拓展视野部分。
归纳常见的酸的物理性质和化学性质及用途。 你已经知道哪些酸和碱?了解它们的性质吗?它们在生产、生活中有哪些应用? 交流讨论:1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、酸雨里含有什么酸?1、人的胃液里含有盐酸;
2、汽车电瓶里含有硫酸;
3、食醋里含有醋酸,也叫乙酸;
4、酸雨里含有亚硫酸,也可能含有硝酸。活动探究一:
浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法[ 实验10-2]无色液体无色;粘稠、油状、液体有白雾出现无现象有刺激性气味无气味1.19g/mL1.84g/mL浓硫酸做干燥剂浓硫酸有吸水性浓盐酸和浓硫酸应 保存,否则浓盐酸溶质质量变 ,浓硫酸溶剂质量变 。密封大小交流讨论:活动探究三、
浓硫酸稀释的正确操作
[实验10-5]浓硫酸稀释的错误操作。实验时水一定要缓慢滴入锥形瓶,否则锥形瓶底会因冷、热不均而裂掉。图10-5 浓硫酸稀释的错误操作活动探究二、
浓硫酸的腐蚀性浓硫酸能夺取含碳、氢、氧等元素组成的化合物里的水分 ( 氢、氧元素 ), 生成黑色的炭和水。 如果不慎将浓硫酸沾到皮肤或衣服上,应如何处理? 如果将稀硫酸沾到皮肤或衣服上,是否也要进行这样的处理? 交流讨论:活动探究四、
酸的化学性质⒈ 酸溶液能与指示剂反应:结论:⒉ 酸溶液能与某些金属反应:
回顾并写出下列反应原理及现象,总结反应规律结论:⒊ 酸溶液能与金属氧化物反应:结论: 除铁锈时用稀盐酸还是用浓盐酸?为什么? 用稀盐酸除铁锈时会发生哪些反应? 通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?
请将你所知道的与同学们交流、讨论。酸的化学性质跟指示剂的反应
跟金属的反应
跟金属氧化物的反应盐酸用途胃液中含盐酸帮助消化硫酸用途浓硫酸做干燥剂浓硫酸有吸水性当堂反馈1,下列物质露置于空气中,溶液会增加的是:
( )
A 浓盐酸 B 蔗糖 C 浓硫酸 D 氯化钠溶液2,请你写出下列化学反应方程式
铁锈与稀硫酸反_____________________
人体内缺铁元素会引起贫血,可以服用少量铁粉来补充________________________3、如用稀盐酸或稀硫酸清除铁锈,能否长时间浸在酸中
4.下列说法错误的是 ( )
A.浓盐酸和浓硫酸都应该密封保存,因为它们都有挥发性
B.人的胃液中含有少量盐酸,可以促进食欲帮助消化
C.盐酸和硫酸都可以用于金属除锈
D.稀释浓硫酸时,一定要沿烧杯壁将浓硫酸慢慢注入水中,并用玻璃棒不断搅拌
A 5.小李在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如右图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是( )
A.紫色 B.蓝色
C.红色 D.无色A第二课时
常见的碱你去尝一个未成熟的柿子,会有什么感觉?这是因为柿子里含有碱性物质生活中的碱像氢氧化镁和氢氧化铝那样的碱可以治疗对人体不利的胃酸过多症。工业中的碱石灰浆和水泥是用碱性
氢氧化钙制取的静心自学阅读P189-190标题一正文及活动与探究、交流与讨论、拓展视野部分。找出下列问题答案:
1.常见的碱指的是什么?化学式是什么?
2.氢氧化钙、氢氧化钠俗名是什么?
它们有什么用途?氢氧化钙是怎么制取的?
3.写出下列物质的主要成分的化学式:
石灰石 石灰水
生石灰 熟石灰 CaCO3CaOCa(OH)2Ca(OH)2观察固体烧碱、消石灰的颜色、状态,在表面皿中放一些固体烧碱,露置在空气中一段时间,观察它发生什么变化。碱的性质实验记录活动探究一:在试管中加一些固体氢氧化钠,加入水,振荡,观察它的溶解过程,并摸一摸试管,感觉溶液温度的变化。碱的性质实验记录活动探究二归纳总结 NaOH有强烈的腐蚀性,所以,它的俗名叫做苛性钠、火碱或烧碱。 如果不慎将碱液沾到皮肤上,应如何处理?注意!
在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。肥 皂石 油造 纸纺 织印 染含NaOH氢氧化钙的制法生石灰与水反应
CaO + H2O = Ca(OH)2反应放出大量的热在试管中加一些固体氢氧化钙,加入水,振荡,观察它的溶解过程。碱的性质实验记录活动探究二归纳与小结交流讨论:
氢氧化钠、氢氧化钙在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。碱的共同性质由于碱电离后都能生成OH-,因此也具有相同的性质。(1)与酸碱指示剂作用
A.紫色石蕊试剂遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红注:可溶性的碱才具有这样的性质 思考1、如何检验二氧化碳气体?写出化学方程式。
2、除去混合气体中的二氧化碳,用什么吸收好?写出相应的化学方程式。3、以上信息,你能总结出碱具有什么化学性质吗?请用通式表示。4、写出SO2、SO3分别和NaOH、Ca(OH)2发生反应的化学方程式。(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O;
Ca(OH)2 + SO2 == CaSO3↓ + H2O; 思考:非金属氧化物与碱的反应属于基本反应类型吗?为什么氢氧化钠固体要密封保存?思考1、写出氢氧化铜与硫酸、氢氧化铁与盐酸反应的化学方程式。
2、以上事实说明碱具有什么化学性质?
3、什么是中和反应?它与复分解反应有何关系?(3)与酸反应(中和反应)
碱 + 酸 → 盐 + 水
如:NaOH + HCl == NaCl + H2O;
Ca(OH)2 + H2SO4 == CaSO4 + 2H2O; 1、在硫酸铜溶液中滴加氢氧化钠溶液。
2、在氯化铁溶液中滴加氢氧化钠溶液。
3、在碳酸钠溶液中滴加石灰水。
4、在硫酸铜溶液中滴加石灰水。探究四:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaClNa2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOHCuSO4 + Ca(OH)2 = Cu(OH)2↓+ CaSO4CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4
CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3 == 2NaOH + CaCO3↓请观察下面的化学方程式有什么特点,请归纳出它们的一些规律。化合物 化合物 化合物 化合物交换成分交流讨论:复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应。
可以用:AB + CD == AD + CB 表示
特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。当堂反馈1.碱溶液有相似的化学性质的原因是碱溶液中都含有( )
A.氢离子
B.氢氧根离子
C.金属离子
D.酸根离子B 练习一1、氢氧化钠是 色 体。 溶于水,溶解时放出 。2、固体氢氧化钠在空气中易 水分,而 ,所以它可以做为某些气体的 。 3、氢氧化钠有强烈的 性,所以它又叫 、 、 。 白固极易大量的热吸收潮解干燥剂腐蚀烧碱火碱苛性钠1、下列物质中,既可以降低土壤的酸性,又可用于配制农药波尔多液的是 ( )
A.氢氧化钠 B.氢氧化钙 C.胆矾 D.食盐
2、下珍关于氢氧化钠的描述中错误的是( )
A、易溶于水,溶解时放出大量的热
B、对皮肤有强烈的腐蚀作用
C、水溶液能使石蕊试液变红
D、能除去油污,可做厨房清洁剂练习B C4、下列气体中,可以用氢氧化钠干燥的是
(A)H2 (B)SO2 (C)CO2 (D)HCl
A5、下列物质暴露在空气中,质量增加并且变质的是
(A)浓硫酸 (B)火碱 (C)水 (D)浓盐酸
B6、下列关于氢氧化钠的叙述不下确的是( )A.露置于空气中易变质
B.能使紫色石蕊溶液变蓝色
C.溶于水时放出热量
D.能做治疗胃酸过多的药物D
